不稳定冠心病循环microRNA表达谱特点及功能分析
李素芳,陈 红,任景怡,李晶津,宋俊贤,耿 强
不稳定冠心病循环microRNA表达谱特点及功能分析
李素芳,陈 红*,任景怡,李晶津,宋俊贤,耿 强
(北京大学人民医院心脏中心,北京 100044)
明确不稳定冠心病患者循环microRNA(miRNA)表达谱,并对差异表达miRNA在细胞增殖中的调控作用进行探讨。(1)分别收集不稳定冠心病患者(试验组)及疑似心绞痛的非冠心病患者(对照组)血浆,通过miRNA芯片检测,得到试验组患者循环miRNA表达谱。(2)分别在3个不同的生物信息学数据库——TargetScan、miRanda和DIANAmT,对miRNA靶基因进行预测,得到在3个数据库均有预测的miRNA靶基因。(3)通过DAVID数据库,对上述靶基因在细胞增殖方面的功能进行聚类及信号通路分析。(4)通过实时(real time,RT)-PCR实验,进一步验证循环miRNA-19b(miR-19b)在两组中的表达水平。(5)结合功能聚类分析结果,对差异表达最明显的(miR-19b)在细胞增殖中的调控作用进行验证。(1)与对照组相比,试验组存在39个差异表达miRNAs,其中miR-19b差异表达最明显。(2)通过对miRNA靶基因的预测,发现有14个miRNAs与细胞增殖关系密切,其中miR-19b调控的细胞增殖相关基因最多。(3)RT-PCR检测证实不稳定冠心病患者血浆miR-19b水平较对照组明显增高。(4)细胞增殖实验表明,miR-19b明显抑制血管内皮细胞(EA.hy926细胞)增殖。不稳定冠心病患者具有特定的循环miRNA表达谱,这些miRNAs可能是不稳定冠心病的潜在生物标志物。miR-19b可能通过抑制内皮细胞增殖,发挥稳定动脉粥样硬化斑块的保护作用。
冠心病;微小RNAs;细胞增殖
微小RNAs(microRNAs,miRNAs)是一类在进化上高度保守的单链、非编码小分子RNA[~22nt],在转录后水平负性调控靶基因的表达。目前在人体中已发现1000多个miRNAs,约30%的人类蛋白编码基因受到miRNAs的调控[1,2]。miRNA参与调节体内许多生理和病理过程,与心血管疾病、糖尿病、肿瘤等多种疾病的发病或预后密切相关。早在2008年有关肿瘤的研究中发现,miRNAs广泛存在于血液循环中[3]。而且在不同的疾病状态或病理刺激下,循环miRNAs表达谱存在差异,因而可能成为一类新的诊断疾病的生物标志物。急性冠脉综合征主要包括不稳定冠心病(unstable coronary heart disease,UCHD)、急性心肌梗死、心源性猝死3大类。其中有关急性心肌梗死的miRNA标志物已有大量研究和报道,心肌特异表达或高表达的miRNAs——miR-1、miR-133、miR-208a、miR-499,可能是优于肌钙蛋白的诊断急性心肌梗死的生物标志物[4−11]。然而,目前有关UCHD的循环miRNA标志物的研究相对较少[12],其确诊主要依据患者的临床症状及冠状动脉造影检查。因此,本研究收集人民医院心内科UCHD患者及以胸痛收入院的非CHD患者的血浆,对UCHD的循环miRNA表达谱进行筛选,借助生物信息学分析差异表达miRNA的潜在生物学作用,并通过生物学实验对miRNA的作用进行验证。
1 对象与方法
1.1 入选与排除标准
试验组入选标准:同时满足(1)参照2011年美国心脏联合会(AHA)不稳定冠心病诊疗指南[13];(2)冠脉造影证实存在动脉粥样硬化,冠状动脉狭窄≥50%。对照组入选标准:同时满足(1)冠脉造影阴性;(2)平板运动阴性。排除标准:(1)心肌损伤标志物升高;(2)心肌炎、心源性休克;(3)严重肝肾功能异常病史;(4)恶性肿瘤;(5)自身免疫性疾病;(6)血液系统疾病;(7)急性炎症性疾病。
1.2 血浆标本的收集
冠状动脉造影前,留取患者血液至依地酸(EDTA)抗凝管。血液标本经过1000转/min、4℃、离心10min,得到上层液体即为血浆,分装后-70℃冻存。
1.3 循环miRNA的提取
采用miRNA提取试剂盒(miRNeasy kit,Qiagen公司),按照试剂盒说明书进行提取[14]。
1.4 miRNA芯片
采用TLDA(TaqMan low-density array)低密度芯片(TaqMan Array Human MicroRNA A+B Cards Set v3.0,ABI公司))进行筛查实验。使用Data Assist软件(TaqMan gene expression assays version 2.0)对芯片原始Ct值数据进行分析。
1.5 差异表达miRNA筛选
使用微矩阵显著性分析(Significant Analysis of Microarray,SAM)软件包筛选差异表达的miRNA,通过设置错误发现率(false discovery rate,FDR)值<0.0001%,差异倍数值(fold change)>1.5,得到组间表达差异的miRNA。
1.6 生物信息学分析
通过生物信息学miRNA靶基因预测工具——TargetScan、miRanda和DIANAmT,分析差异表达miRNA的潜在靶基因,将以上三个数据库分别得到的靶基因取交集,得到共同预测出的靶基因。然后利用DAVID数据库,分析这些miRNA潜在靶基因的生物学功能及介导这些功能的信号通路。
1.7 实时聚合酶链反应
采用TaqMan MicroRNA递转录试剂盒和带颈环结构的miRNA特异性探针(ABI公司,美国)进行(real-time polymerase chain reaction,RT-PCR),实验流程参照试剂盒说明书进行。提取血浆miRNA时,外源性加入化学合成的秀丽隐杆线虫[miRNA-39(miR-39),cel-miR-39,Qiagen公司,美国],10mol/样本,作为PCR的内参[15]。数据以2-△△CT表示。
1.8 细胞增殖的实验(CCK8实验)
利用转染试剂Lipofectamine 2000(Invitrogen,美国)将miRNA mimic(ABI公司,美国)转染至内皮细胞(培养条件:含10%胎牛血清DMEM培养基,5% CO2培养箱),24h后加入cell细胞计数盒2(counting kit2,CCK8)试剂继续孵育1h,检测样本在490nm波长处的吸光值,反映细胞增殖情况。
1.9 统计学处理
采用SPSS17.0进行统计学分析。统计学指标均进行正态性检验和方差齐性检验。分类变量采用卡方检验,连续变量采用独立样本检验。<0.05为差异有统计学意义。
2 结 果
2.1 研究人群一般情况
共入选64名受试者,其中对照组32人表现为非心源性胸痛或胸闷,冠脉造影阴性。32人表现为典型UCHD,并由冠脉造影证实为CHD。研究人群的临床基线资料见表1。
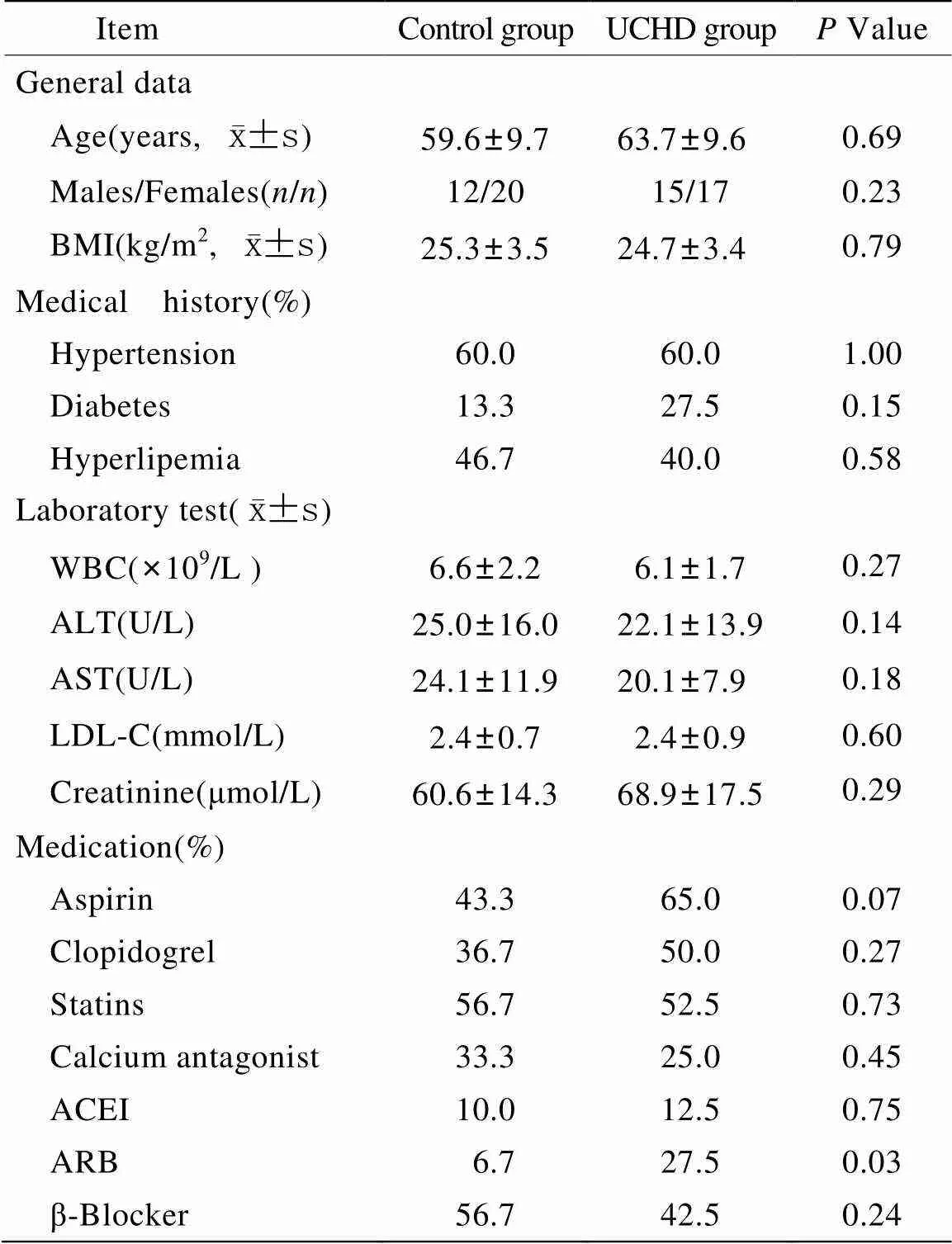
表1 研究人群基线资料
UCHD: unstable coronary heart disease; BMI: body mass index; WBC: white blood cell; ALT: alanine aminotransferase; AST: aspartate aminotransferase; LDL-C: low density lipoprotein cholesterol; ACEI: angiotensin-converting enzyme inhibitor; ARB: angiotensin receptor blocker. Allvalues represent comparisons between UCHD patients and controls. Comparisons between UCHD patients and controls were performed with Student’s-test for continuous variables and with chi-square test for categorical variables.
2.2 不稳定冠心病患者循环miRNA差异表达谱
共进行TaqMan miRNAs TLDA低密度芯片(A+B板)筛查实验24例(其中试验组12例,对照组12例)。经SAM软件分析,设置FDR值为<0.0001%,差异倍数>1.5,得到组间差异表达的miRNAs共39个,其中miR-19b差异表达最明显(表2)。
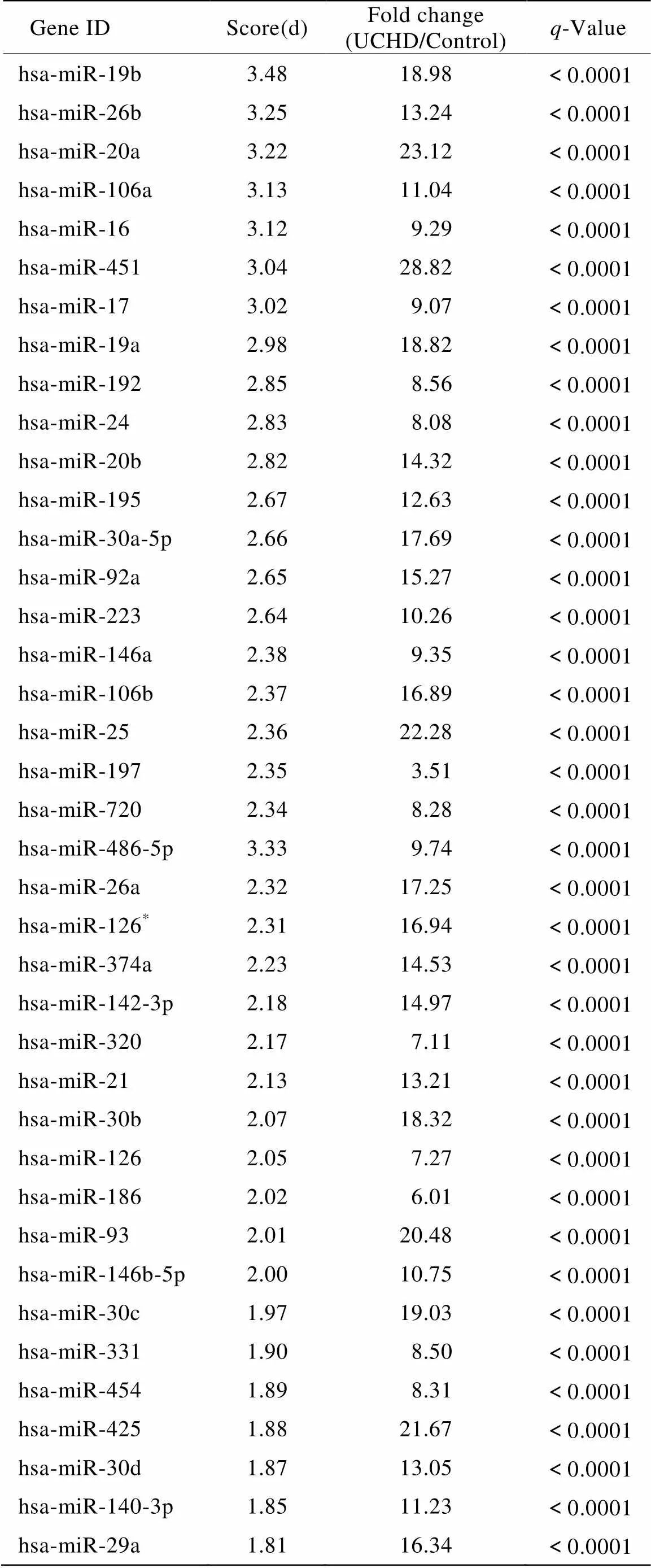
表2 不稳定冠心病患者39个差异表达的循环miRNAs
UCHD: unstable coronary heart disease. Circulating miRNAs show significant change in UCHD patients (=12) compared with controls (=12). Only miRNAs with more than 1.5-fold change and false discovery rate <0.0001% are shown here
2.3 差异表达miRNA参与细胞增殖的调控
将39个miRNA分别输入miRNA靶基因预测数据库——TargetScan、miRanda和DIANAmT,得到各个miRNA的潜在靶基因,将预测结果取交集,得到在3个数据库均有预测的靶基因及其相应的miRNA。因为血管细胞增殖是动脉粥样硬化斑块进展的一个重要病理过程,故在本研究中,我们分析了细胞增殖相关的miRNA及其靶基因。预测结果显示39个miRNA中,有14个miRNA调控细胞增殖相关的基因表达,而且受miR-19b调控的细胞增殖相关基因数目最多(图1)。将这些增殖相关靶基因输入到DAVID数据库,得到14个miRNA参与调控的主要信号通路(图2)。
2.4 miR-19b抑制内皮细胞增殖
冠心病患者血管内皮激活后,细胞发生增殖、迁移,最终导致血管新生,不利于动脉粥样硬化斑块稳定性的维持。首先,我们通过RT-PCR实验,在另外一组人群中(试验组20人,对照组20人)检测了血浆中miR-19b水平,PCR实验结果与芯片数据一致,即试验组患者循环miR-19b水平较对照组明显增高,约为对照组的3.65倍(<0.01,图3A)。为进一步验证miR-19b对内皮细胞的调控作用,通过CCK8实验证实,与对照组(NC mimic)相比,转染miR-19b mimic组(终浓度30nmol/L)的内皮细胞增殖受到明显抑制(约抑制40%,<0.001,图3B)。
3 讨 论
本研究通过miRNAs芯片筛查,发现一组UCHD患者特异性的循环miRNAs表达谱(包括miR-19b在内的一共39个miRNAs),与非心源性胸痛患者的循环miRNAs表达谱存在显著差异。通过生物信息学进一步分析发现,部分miRNAs在抑制细胞增殖中发挥潜在的调控作用。最后以差异表达最明显的miR-19b为研究对象,证明miR-19b具有抑制内皮细胞增殖的作用。
Hoekstra等[16]研究发现,与稳定型心绞痛相比,UCHD患者外周血单核细胞中的miR-198、miR-134、miR-370水平均明显升高。而本研究以血浆循环miRNA为检测目标,避免了从血液分离单核细胞的过程,缩短了检测时间,有利于将来的临床转化。在UCHD患者显著上调的循环miRNAs中,并未包含既往文献报道的心肌特异或高表达的miRNAs(如miR-1、miR-133、miR-208a、miR-499等)[4−11],提示这种差异表达循环miRNAs水平的变化出现在心肌损伤之前,因而具有早期预警的价值。此外,我们所发现的UCHD患者循环miRNA表达谱与2014年Zeller等[15]的研究结果相比,两项研究所发现的部分差异表达miRNA是一致的,他们的研究包含了在UCHD患者中循环miR-19b的上调,这有助于证明miR-19b与UCHD的相关性。
近期研究认为循环miRNAs不仅可以作为诊断疾病的标志物,而且可能在疾病状态下发挥重要的调控作用。几项重要研究结果均提示,循环miRNAs可以通过微颗粒、外泌体或者脂蛋白介导的方式在细胞与细胞之间发挥通讯媒介的作用,从而以自分泌/旁分泌的方式进入靶细胞并调节靶基因的表达[17,18]。内皮细胞异常增殖是动脉粥样硬化发生的重要病理性改变,内皮细胞增殖、迁移及形成新生血管,非常不利于斑块的稳定性。miRNA作为机体重要的调节分子,可能在斑块破裂前已经发挥了保护作用。因此,本研究还进一步具体分析了差异表达的miRNA靶基因,重点关注miRNA在内皮细胞增殖中的调控作用。通过生物信息学分析发现,39个差异表达的miRNAs中,有14个miRNA的靶基因与细胞增殖相关。上调最明显的miR-19b的增殖相关靶基因数目最多,其影响细胞增殖的信号通路有常见的TGF-β信号通路、Jak-STAT信号通路、MAPK信号通路等。最后,我们对miR-19b的功能进行了验证,细胞增殖实验结果表明,过表达miR-19b的内皮细胞增殖过程被明显抑制。
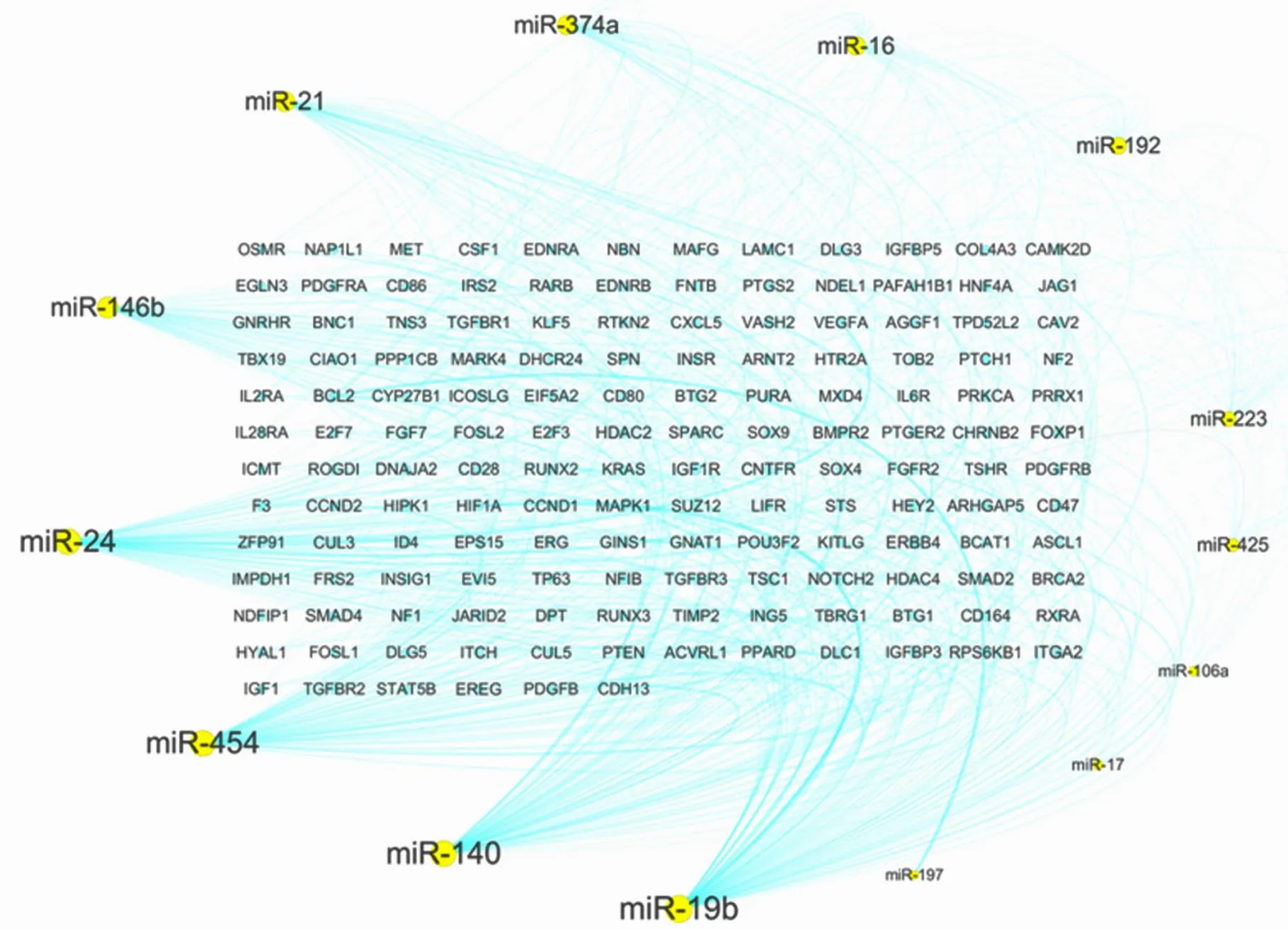
图1 在细胞增殖过程中具有潜在调控作用的miRNAs
Figure 1 The miRNAs potentially regulating cell proliferation
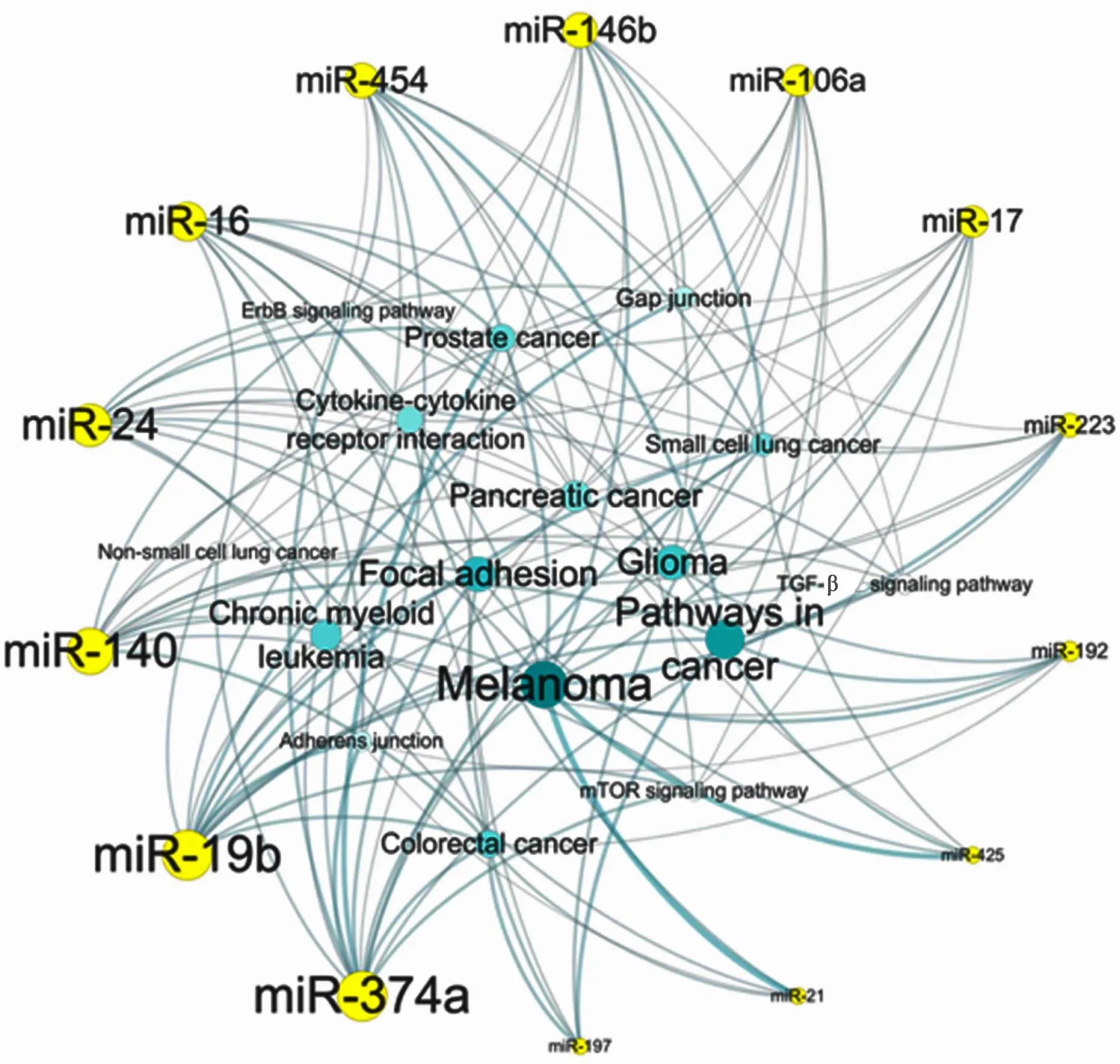
图2 介导miRNA发挥调控细胞增殖作用的信号通路
Figure 2 Signaling pathway mediating the regulating role of miRNA on cell proliferation
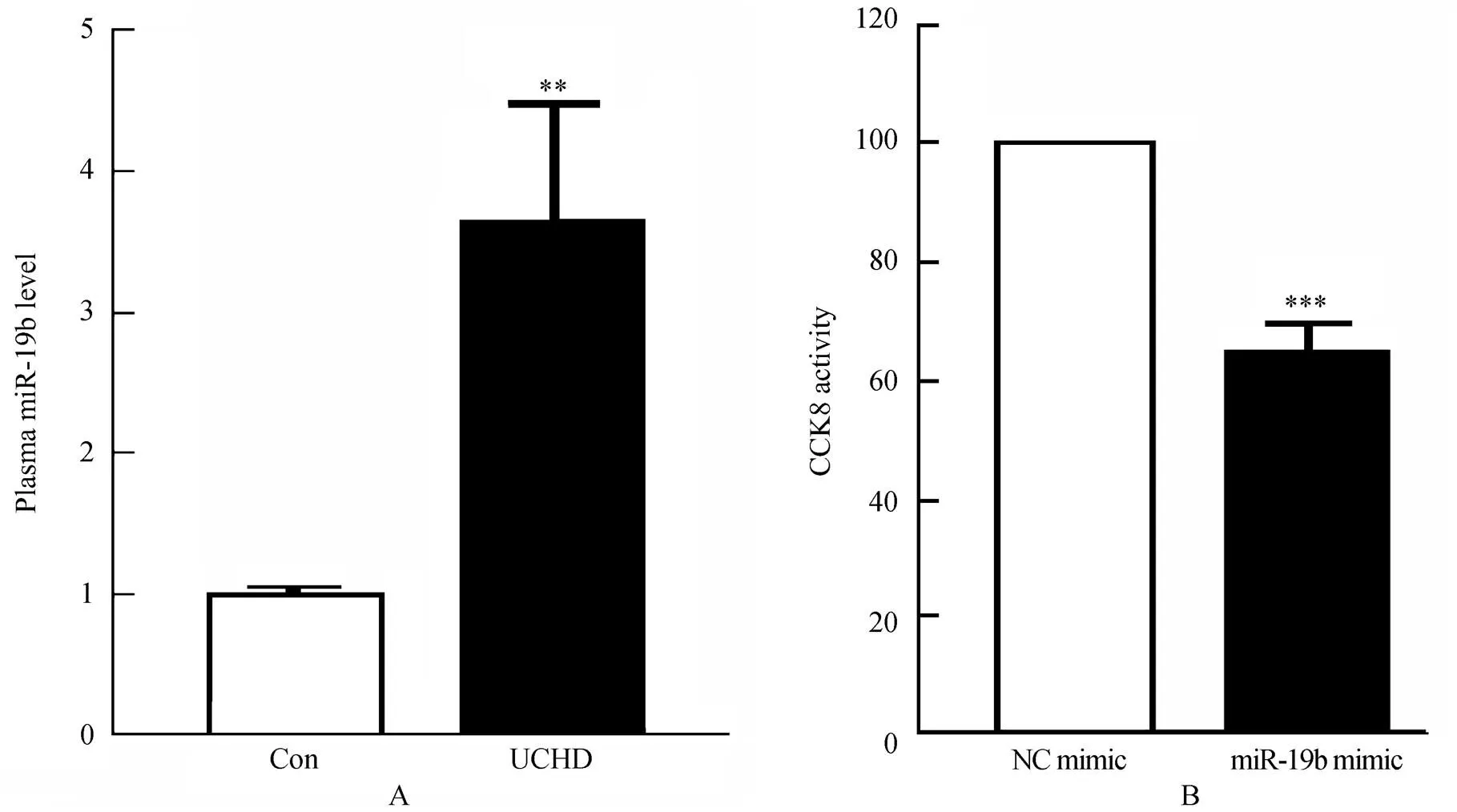
图3 不稳定冠心病患者血浆miR-19b水平和miR-19b对内皮细胞增殖的抑制作用
Figure 3 The miR-19b levels in plasma from UCHD patients (A) and inhibitory effects of miR-19b on the proliferation of endothelial cells (B)
Con: control group; UCHD: unstable coronary heart disease group; CCK8: cell counting kit 8. A: Real-time PCR analysis of the miR-19b levels in plasma from UCHD patients (=20). Compared with control group (=20),**<0.01. MiRNAs levels were normalized to the spiked-in cel-miR-39. B: The inhibitory role of miR-19b on endothelial proliferation. Compared with NC mimic,***<0.001 (=3)
本研究尚存在一些局限性,从生物标志物研究看,样本量偏小,且为横断面研究,因而距离临床的应用和推广尚有很长的一段距离[19];从miRNA作用机制研究看,仅初步探讨了miR-19b对内皮细胞的生物学作用,未来需要借助动物模型进一步探讨miR-19b对动脉粥样斑块稳定性的影响。
总之,本研究的结果提示,UCHD患者发生心肌梗死前,机体已经通过miRNA启动保护程序,从而延缓甚至避免疾病的进一步发展、恶化。我们的研究不仅为UCHD的诊断提供了潜在标志物,而且为避免恶性冠脉事件的发生提供了潜在的干预靶点。
[1] Lewis BP, Burge CB, Bartel DP. Conserved seed pairing, often flanked by adenosines, indicates that thousands of human genes are microRNA targets[J]. Cell, 2005, 120(1): 15−20.
[2] Berezikov E, Guryev V, van de Belt J,. Phylogenetic shadowing and computational identification of human microRNA genes[J]. Cell, 2005, 120(1): 21−24.
[3] Hoekstra M, van der Lans CA, Halvorsen B,. The peripheral blood mononuclear cell microRNA signature of coronary artery disease[J]. Biochem Biophys Res Commun, 2010, 394(3): 792−797.
[4] Wang GK, Zhu JQ, Zhang JT,. Circulating microRNA: a novel potential biomarker for early diagnosis of acute myocardial infarction in humans[J]. Eur Heart J, 2010, 31(6): 659−666.
[5] D’Alessandra Y, Devanna P, Limana F,. Circulating microRNAs are new and sensitive biomarkers of myocardial infarction[J]. Eur Heart J, 2010, 31(22): 2765−2773.
[6] Long G, Wang F, Duan Q,. Circulating miR-30a, miR-195 and let-7b associated with acute myocardial infarction[J]. PLoS ONE, 2012, 7(12): e50926.
[7] Yao Y, Du J, Cao X,. Plasma levels of microRNA-499 provide an early indication of perioperative myocardial infarction in coronary artery bypass graft patients[J]. PLoS One, 2014, 9(8): e104618.
[8] Olivieri F, Antonicelli R, Lorenzi M,. Diagnostic potential of circulating miR-499-5p in elderly patients with acute non ST-elevation myocardial infarction[J]. Int J Cardiol, 2013, 167(2): 531−536.
[9] Cheng Y, Tan N, Yang J,. A translational study of circulating cell-free microRNA-1 in acute myocardial infarction[J]. Clin Sci (Lond), 2010, 119(2): 87−95.
[10] Widera C, Gupta SK, Lorenzen JM,. Diagnostic and prognostic impact of six circulating microRNAs in acute coronary syndrome[J]. J Mol Cell Cardiol, 2011, 51(5): 872−875.
[11] Sayed AS, Xia K, Yang TL,. Circulating microRNAs: a potential role in diagnosis and prognosis of acute myocardial infarction[J]. Dis Markers, 2013, 35(5): 561−566.
[12] Li SF, Ren JY, Geng Q,. Circulating microRNA and the diagnosis of coronary heart disease[J]. Chin J Mult Organ Dis Elderly, 2014, 13(5): 381−385. [李素芳, 任景怡, 耿 强, 等.循环微小RNA与冠心病诊断[J]. 中华老年多器官疾病杂志, 2014, 13(5): 381−385.]
[13] Anderson JL, Adams CD, Antman EM,. 2011 ACCF/AHA Focused Update Incorporated Into the ACC/AHA 2007 Guidelines for the Management of Patients with Unstable Angina/Non-ST-Elevation Myocardial Infarction: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines[J]. Circulation, 2011, 123(18): e426−e579.
[14] Li S, Chen H, Ren J,. MicroRNA-223 inhibits tissue factor expression in vascular endothelial cells[J]. Atherosclerosis, 2014, 237(2): 514−520.
[15] Zeller T, Keller T, Ojeda F,. Assessment of microRNAs in patients with unstable angina pectoris[J]. Eur Heart J, 2014, 35(31): 2106−2114.
[16] Hoekstra M, van der Lans CA, Halvorsen B,. The peripheral blood mononuclear cell microRNA signature of coronary artery disease[J]. Biochem Biophys Res Commun, 2010, 394(3): 792−797.
[17] Fichtlscherer S, Zeiher AM, Dimmeler S. Circulating microRNAs: biomarkers or mediators of cardiovascular diseases[J]? Arterioscler Thromb Vasc Biol, 2011, 31(11): 2383−2390.
[18] Mause SF, Weber C. Microparticles: protagonists of a novel communication network for intercellular information exchange[J]. Circ Res, 2010, 107(9): 1047−1057.
[19] Hlatky MA, Greenland P, Arnett DK,. Criteria for evaluation of novel markers of cardiovascular risk: a scientific statement from the American Heart Association[J]. Circulation, 2009, 119(17): 2408−2416.
(编辑: 李菁竹)
Expression profiles and functional analysis of circulating microRNAs in unstable coronary heart disease
LI Su-Fang, CHEN Hong*, REN Jing-Yi, LI Jing-Jin, SONG Jun-Xian, GENG Qiang
(Heart Center, Peking University People’s Hospital, Beijing 100044, China)
To determine the expression profile of microRNAs (miRNAs) in the patients with unstable coronary heart disease and investigate the regulation role of differential expressed miRNAs in cell proliferation.(1) After the plasma samples of patients with confirmed unstable coronary heart disease and non-coronary heart disease with suspected angina (control) were collected, miRNAs array was employed to identify distinct miRNA expression profiles. (2) The potential target genes of the above miRNAs were predicted by 3 miRNA target prediction algorithms, TargetScan, miRanda and DIANAmT. (3) The genes predicted by the three algorithms were further analyzed for their regulation roles in cell proliferation and involed signaling pathways by DAVID database. (4) Real-time PCR were used to test plasma miR-19b levels in patients with unstable coronary heart disease compared with the controls. (5) Based on the results of function cluster analysis, the effect of the most differentially expressed miR-19b was detected on the regulation of cell proliferation.(1) Compared with the controls, there were 39 differentially expressed miRNAs, and miR-19b was the most obviously one. (2) By analyzing the target genes of the differential expressed miRNAs, there were 14 miRNAs closely related with cell proliferation, and miR-19b was the closest one. (3) Real-time PCR confirmed that the plasma miR-19b level was obviously higher in the patients with unstable coronary heart disease than in the controls. (4) The results of CCK-8 assay showed that miR-19b indeed inhibited the proliferation in EA.hy926 cells.There is a specific expression profile of circulating miRNAs in the patients with unstable coronary artery disease. The differentially expressed miRNAs may be the biomarkers of unstable coronary heart disease. MiR-19b may play a protective role in the stability of atherosclerotic plaque by inhibiting the proliferation of endothelial cells.
coronary heart disease; microRNAs; cell proliferation
R541.4; R342.3
A
10.11915/j.issn.1671-5403.2015.03.045
2014−12−02;
2014−12−18
国家科技重大专项“重大新药创制”项目(2012ZX09303019);国家自然科学基金(81470473,81270274);北京市自然科学基金(7132225,7122198)
陈 红, E-mail: chenhongbj@medmail.com.cn
(2012ZX09303019),(81470473, 81270274),(7132225, 7122198).

