油菜抗菌核病机制研究进展
李,2*
(1湖南农业大学油料作物研究所/国家油料作物改良中心湖南分中心,长沙410128;2长沙理工大学化学与生物工程学院,湖南长沙,410114)
油菜抗菌核病机制研究进展
李慧1,文李1,2,刘凯1,官春云1*
(1湖南农业大学油料作物研究所/国家油料作物改良中心湖南分中心,长沙410128;2长沙理工大学化学与生物工程学院,湖南长沙,410114)
摘 要:菌核病严重影响油菜产量。开展油菜菌核菌致病机理研究可为选育高抗菌核病油菜品种提供理论基础。综述了油菜菌核菌的病原学特征、菌核菌致病机理、寄主应答以及油菜抗菌核菌分子机制的研究进展,并对油菜菌核菌致病机理所面临的问题和研究趋势进行了总结和展望。
关键词:油菜;菌核菌;致病机理;抗病性
油菜是中国播种面积最大、地区分布最广的油料作物,其种植面积和总产量均居世界第一位[1]。油菜菌核病是由核盘菌(Sclerotinia sclerotiorum)引起的一种广谱性真菌病害,是我国油菜的三大病害之一。核盘菌是一种寄主种类广泛的重大植物病害,可侵染600多种重要作物和草类。菌核病对我国油菜造成的产量损失一般在10%~30%,严重时可达80%,同时也严重降低油菜品质[2]。目前国内外对菌核病的发病原因、侵染方式和过程、致病机理以及其模式生物拟南芥的抗病机制等方面进行了大量的研究,获得了一些相对抗病的油菜品种。
1 菌核病菌的病原学特征
核盘菌是一种腐殖营养型寄生真菌,属子囊菌亚门。核盘菌的生活史包括菌核形成、菌核萌发、菌丝生长3个阶段。大部分的核盘菌都是以菌核的形式存在。菌核可以在土壤中单独生存几年甚至更长的时间[2]。菌核呈不规则形状,前期为白色,后期外面为黑色,内部呈白色。菌核萌发分为子实体萌发和菌丝体萌发。子实体萌发生成子囊盘,盘上着生一层子囊和侧丝。子囊呈无色棍棒状,内含8个单胞子囊孢子;侧丝无色、丝状,夹生于子囊之间。子囊盘或者菌丝构成初侵染源。菌丝可以通过寄主表皮直接侵入寄主,还可沿着保卫细胞内侧间接侵入寄主,在寄主细胞间蔓延[3],并分泌果胶酶、纤维素酶、木质素降解酶及毒素等。其中内切多聚半乳糖醛酸酶是果胶酶中效率最高的一种酶,其可降解寄主细胞的中胶层——多聚半乳糖醛酸和多糖组份,造成细胞松弛,使病部软化腐烂,细胞死亡,引起落花落叶。
核盘菌的寄主范围十分广泛,可侵害400多种植物和亚种,比如十字花科的油菜,豆科的大豆,五茄科的人参等,严重影响了这些作物的产量和品质。菌核菌侵染油菜后,使油菜茎秆变白,在潮湿的条件下长出棉絮状白色菌丝,花和叶片形成红褐色的斑点,在感染后期,形成黑色的菌核。菌核菌的生长发育受温度、pH、光照等环境条件的影响。菌丝生长的最适温度范围为14~28℃,此范围内,3~4 d可以形成大量菌丝,5~7 d就可形成黑色菌核。pH对菌丝生长及菌核萌发的影响不大,pH为4~11时均能生长和萌发,最适生长的pH为5~7,即中性、偏酸性环境。光照的有无对菌丝的生长影响有限[4]。油菜菌核病的发生以及严重程度还和油菜的花期有关。周乐聪[5]研究发现,油菜的开花期与子囊盘的发生期相吻合的时间长短,与油菜成熟期病害发生的程度有着显著的回归关系。由此可见,菌核菌广泛的寄主范围,强大的寄生和腐生能力,是有生物学基础的。
2 菌核菌的病理研究
菌核菌的致病机理复杂,菌核菌的致病因子以及各个因子之间的相互作用机制还有许多尚不清楚的地方,但菌核菌在侵染油菜等植株时必须分泌一系列的毒素因子以达到侵染的目的是不容置疑的。这些致病因子包括:降解寄主细胞壁和角质层的酶类,破坏寄主细胞结构的附着器以及破坏寄主细胞膜和正常代谢的毒素等等[6]。另外,菌核菌的次生代谢产物草酸被认为在致病过程中有着重要作用。
2.1与油菜菌核菌致病有关的酶
寄主表皮的角质成分是病原菌成功侵入需要突破的第一道屏障。角质酶在植物病原真菌中广泛存在,它能够催化寄主表皮的角质多聚物水解。角质酶均为酯酶,属于丝氨酸酯酶,可水解多聚体角质的酯键、脂肪酸酯、乳化的甘油三酯等。目前,对角质酶在真菌病原物的侵染方面只在烟草赤星病、番茄胶孢炭疽菌等少数作物病害中发现[7,8]。在油菜菌核菌的研究中未见报道。
细胞壁是病原菌侵入寄主植物的主要屏障,因此细胞壁水解酶是菌核病菌侵染油菜成功与否的最关键因素。细胞壁的主要成分包括:果胶、纤维素、半纤维素、木质素和糖蛋白。分解以上物质的酶统称为细胞壁降解酶。其中研究最多的是果胶降解酶类。Vincenzo Lionetti等[9]研究了果胶甲酯酶在植物—真菌相互作用中的影响。果胶是以高度甲酯化的程度存在于细胞壁,在病原真菌果胶甲酯酶的作用下脱甲酯化。脱甲酯化的果胶严重影响了果胶与细胞壁其他成分的相互作用,细胞壁变得松弛,病原真菌更易侵染植株[10]。另一方面,脱甲酯化的果胶更易被植物分泌的果胶水解酶以及多聚半乳糖醛酸酶等果胶酶降解[11]。官春云[12]认为,在整个病原菌的侵染过程中,病原菌的营养是病原菌在寄主中建立寄生关系的关键因素。病原菌侵染植株需要大量的能量,只有大量的可利用的营养才能让这些病菌成功侵染植株,因此,细胞壁降解酶类和蛋白质降解酶类在发病过程中也起分解植物组织为病原菌提供营养的作用。另外,植物病原菌还能产生一些降解细胞膜和细胞内物质的酶,如蛋白酶、脂酶、淀粉酶等,用以降解蛋白质、类脂和淀粉等。
2.2草酸在油菜菌核菌致病中的作用
草酸普遍存在于植物界,且在植物体内常以草酸盐形式存在。草酸被认为与菌核病侵染有密切关系,是菌核菌侵染油菜的最主要毒力因素。Max-Well[13]和Lumsden[14]在菌核病菌侵染大豆的实验中检测到了受感染大豆组织中草酸的存在。Rai与Dhawan[15]首次证实了受感染的油菜组织中存在草酸。吴纯仁等[16,17]研究了草酸对不同时期油菜不同组织的毒性,以及草酸在受感染油菜的各个组织中结晶分布情况,进一步证明了草酸在菌核病菌感染过程中的重要作用。刘胜毅等[18]进行了草酸在油菜中的生理代谢研究,证实了油菜对菌核病的抗性与对草酸抗性高度一致。毛玮等[19]通过接种菌核病菌诱导与直接使用草酸诱导,研究了两种不同诱导条件下油菜组织中几种重要生物酶活性。在诱导过程中,草酸可能通过以下方式影响植物组织:草酸降低了寄主细胞的pH值,从而提高了病菌的细胞壁降解酶的活性,加速了寄主细胞解体;草酸抑制了与宿主抗性相关的酶以及光合作用酶的活性;草酸和钙结合成草酸钙晶体有可能堵塞导管或微管束而导致萎蔫;草酸对寄主细胞的直接毒害作用,表现在草酸有强的离子螯合能力,能改变寄主细胞膜透性,引起电解质丧失,破坏叶绿体结构,为病菌提供了营养和生存环境。但20世纪90年代后有研究表明,草酸是一种重要的非生物激发因子[20,21],能诱导植物中一些与防御反应相关的过氧化物酶的活性提高,低浓度的草酸甚至还能促进单倍体愈伤组织生长和植物再生。Brett Williams等[22]通过对草酸生成障碍类型的菌核菌突变株(A2)侵染植株,研究显示菌核菌分泌的草酸控制宿主内环境的氧化还原水平(主要是ROS),从而表现对宿主的致病性与抗性诱导作用。侵染初期,菌核菌分泌高浓度的草酸,形成高度还原性环境强烈抑制宿主氧爆发,从而抑制宿主受感染区域程序性细胞死亡为代表的防卫反应;随着侵染的加深,短时高浓度的草酸进入代谢途径,降低了因草酸造成的环境还原性,促使宿主内源氧爆发,诱发宿主所有氧爆发区域发生细胞程序性死亡,形成大面积腐殖质,从而有利于菌核菌扩布。
2.3类整合素蛋白在油菜抗菌核病中的作用
类整合素是动物体内广泛存在的一类胞外基质受体,它所介导的粘附作用参与细胞的多种功能,尤其是在胞外信号转导方面发挥着重要的作用。在植物和细菌、真菌等微生物中也存在类整合素蛋白。植物病原真菌中的类整合素蛋白在帮助其侵染寄主方面发挥着重要的作用。Zhu等[23]的研究发现,在菌核菌侵染的早期,可以检测到其类整合素蛋白基因表达明显上调,而将该基因沉默的突变株侵染油菜,菌核菌的致病性大大降低。于此同时,防卫反应相关基因PDF1.2和PR-1在接种后3 h就大幅度上调表达。这说明菌核菌类整合素蛋白是菌核菌的致病因子,在菌核菌致病中发挥着重要的作用。Caleb Knepper等[24]研究发现,拟南芥中的抗病蛋白NDR1是一种类类整合素蛋白,在拟南芥抗真菌感染中的信号转导方面发挥重要的作用。猜想其可能是类整合素蛋白识别受体,以此介导植株的抗病性。
3 寄主对菌核菌侵染的应答反应
多年以来,研究者们通过多种方式对寄主植物与菌核菌互作过程中的生理、生化和分子生物学方面进行了研究,在一定程度上解释了寄主应答和抵抗菌核菌的机理。
3.1细胞的程序化死亡
细胞的程序化死亡(programmed cell death,PCD)是单个细胞受其内在基因编程的调节,通过主动的生化过程而自杀死亡的现象,主要有细胞凋亡和自我吞噬两种方式。PCD在植物的生长、发育等过程中非常重要,也在植株/病原菌的相互作用过程中发挥着重要作用。PCD既能诱导植株的抗病性也能引起植株感病[25~27]。植物病原物互作过程中起初引发的过敏反应就是寄主引发的局部的、快速的PCD,可以阻止病原菌的扩展。同时严重的细胞程序化死亡也能导致植物的感病。因此对PCD的调控在植物与病原互作过程中也非常关键。PCD参与植物防卫反应的研究很多,如植物对病原细菌、真菌和病毒等的过敏反应。Kabbage等[28]发现,草酸分泌缺陷型菌核菌能限制细胞的死亡表型,但是却能导致植株的过敏反应表型。比如:诱发胼脂质的沉积以及氧爆,由此可以推测,细胞能识别这种非细胞凋亡现象并作出防御应答。进一步研究表明,突变菌株能够诱导寄主植物产生HR反应,而这种反应是由于寄主细胞的自我吞噬引起的。同时,PCD能够诱发植物体内的MAPKK磷酸化级联反应,放大植物抗病的信号途径,提高植株的抗病性[29]。相反的,对于腐生营养型真菌菌核菌而言,寄主产生的非自我吞噬引起的PCD可以为菌核菌的生长发育提供营养,导致感病。因此植物寄主和病原菌对细胞程序性死亡的调控决定了寄主植物的抗病和感病特征。
3.2氧爆
氧爆反应是植物在受到病原攻击时的早期反应之一,病原菌主要通过NADPH氧化酶和细胞壁过氧化物酶两种途径诱导产生活性氧自由基(reactive oxygen species,ROS)。ROS是PTI和ETI信号转导途径中的重要因子。寄主自身诱导产生合适浓度的ROS可以帮助寄主植物抵抗病原侵染,低浓度的ROS则可以作为第二信使,激活植物的抗氧化系统和防御反应。而病原诱导产生的高浓度的活性氧对寄主的蛋白、DNA和脂肪等会造成细胞的氧化性损伤,因此植物也具有一套清除氧自由基的抗氧化机制。菌核菌在侵染后期会诱导植物合成大量的ROS,并且诱导植物产生PCD反应,因此植物本身的抗氧化系统对抵抗菌核菌的入侵也非常重要。研究发现,大豆在接种菌核菌后,体内超氧化物和羟自由基的含量上升,同时丙二醛的含量也升高,证明菌核菌诱导大豆产生了氧爆反应。齐绍武等[30]对甘蓝型油菜品系接种后叶片的抗氧化相关酶的活性与抗菌核病的关系进行了研究,包括过氧化物酶、多酚氧化酶、苯丙氨酸解氨酶、超氧化物歧化酶的活性变化,发现这些酶的活性在菌核菌的胁迫下上调表达,而且抗病品种中的活性高于感病品种。
4 油菜抗菌核菌分子机制
4.1植物的先天免疫机制
植物在整个生长发育过程中时刻受到周围各种潜在病原微生物的侵染。在植物和病原菌长期相互作用过程中,植物进化出一系列复杂的防御机制来抵抗病原菌的侵染以保护自身。植物中抵抗外界微生物刺激所形成的系统被称为植物天然免疫系统,可分为两个层次。第一个层次为植物模式识别受体(Pattern recognition recptors,PRRs),识别病原相关分子模式(Pathogen-associated molecular patterns,PAMPs)或病原菌的损伤模式分子(Damage-associated molecular patterns,DAMP),触发病原相关分子模式触发的免疫反应(PAMP-triggered immunity,PTI),激活植物体中促丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)信号通路使植物产生早期应答反应;第二个层次为病原菌产生效应因子抑制基础免疫响应PTI,而植物产生针对性更强的抗性蛋白(Resistant,R)识别效应因子,并通过效应因子触发型免疫(Effector-triggered immunity,ETI)来重建植物的抗性。Jones等[31]提出四阶段Z字模型来阐述植物免疫系统的运作。病原菌模式分子(PAMP)被模式分子识别受体(PRR)识别,启动植物的PTI并激活植物体中MAPK信号通路使植物产生早期应答反应,抑制病原菌的定殖。PTI为非寄主抗病性,由于非寄主抗病性的普遍存在,病原菌仅可以侵染有限的寄主植物,使之罹病。成功的病原菌克服植物的PTI,为此进化产生了多种专化性效应子,增强了病原物的致病性,得以干扰和克服植物PTI,因此植物产生了效应子激发感病性(Effector-triggered susceptibility,ETS)而罹病。病原菌的效应子被植物抗病基因(R基因)产物识别,启动效应子激发免疫性(Effector-triggered immunity,ETI),导致侵染点的细胞产生过敏性坏死反应。大多数R基因编码NBS-LRR类蛋白,识别作用可能是NBS-LRR类蛋白与效应子之间的直接识别,也可能是间接识别。识别作用使病原物进一步产生小的效应子,植物产生的专化R基因,结果ETI再次被启动(图1)。
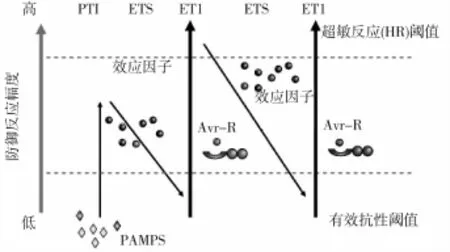
图1 植物与病原体间互作模式图(Jones and Dangl,2006)
PAMP或DAMP与特定的受体结合后激发下游的信号转导机制,并诱导抗病基因的表达。PRRs参与真核生物中高度保守的丝裂原活化蛋白激酶级联(MAPK cascades),通过MAPKKK-MAPKKMAPK逐级磷酸化,传递细胞信号。MAPK在植物信号传递中起重要作用,识别和早期事件激发茉莉酸(JA)、乙烯(ET)等内源信号分子产生,操控信号传递途径[32]。腐生菌(如菌核菌)的感染启动植物体内JA/ET信号途径。信号分子经过复杂的放大、传递和整合过程,才能活化相关的转录因子,活化的转录因子进入细胞核,才能激活防卫基因的转录和表达。拟南芥中,PRRs对PAMP/DAMP的识别激活植物体中的MAPK信号通路使植物产生早期应答反应,调控拟南芥ET和植保素(camalexin)的生物合成,以产生对腐生菌的抗病反应。MPK23/4/6与抗广谱病原菌相关,这些激酶通过控制ET及植保素的合成来参与抗病反应,拟南芥MAPK3和MAPK6磷酸化下游蛋白并诱导ET合成,启动植物的防御机制[33],超表达MAPK4基因可以增强油菜对菌核菌的抗病能力[34]。
4.2油菜抗菌核菌相关基因研究
植物受到病原菌、机械损伤等各种生物/非生物胁迫后,会发生一系列防卫反应。防卫反应包括宿主细胞产生的过敏性坏死、细胞壁组分交联、形成小乳突或诱导各种防御相关蛋白的表达。研究表明,水杨酸、茉莉酸和乙烯是植物抗病和抗逆信号转导途径的重要调控因子。水杨酸在植物抵抗活体营养型真菌中发挥着重要的作用,而茉莉酸和乙烯在植物抵抗死体营养型真菌中发挥着重要的作用。近年来,不少研究工作者尝试用转基因技术阻断菌核菌对植物的侵染,如将抗菌核菌细胞壁酶类或者草酸降解代谢相关酶基因转入植物中,以提高植物抗菌核菌的能力。多聚半乳糖醛酸酶(Polygalacturonase inhibitor protein,PGIP)可以抑制多聚半乳糖醛酸酶(Polygalacturonase,PG)的活性,减少PG对植物细胞壁的降解,激活并表达PGIP在内的一些防卫相关的基因,可以抵抗菌核菌的侵染[35]。将与草酸降解相关的草酸氧化酶基因OXO或者草酸脱羧酶OXDC转入植物,降解菌核菌代谢产生的草酸,可以提高油菜抗菌核菌的能力[36,37]。R蛋白脂质转移蛋白(Lipid Transfer Protein,LTP)广泛分布于植物、动物和微生物中。Fan Y等将LTP基因转移到油菜中并诱导LTP蛋白的表达可以提高油菜抗菌核菌的能力;转基因的油菜种子对草酸有更强的抵抗能力,菌核菌侵染后,转基因植株的丙二醛含量比非转基因的植株低,超氧化物歧化酶和过氧化物酶的含量升高[38]。菌核菌侵染油菜会诱导植物体细胞产生大量的自由基,诱导寄主细胞的程序化死亡。Rietz S等研究发现,油菜中的类萌芽素蛋白在抑制植物体内氧爆方面发挥作用,推测其可能在某种程度上能抑制菌核菌在油菜中的扩展,但其具体的作用机制还有待进一步的验证[39]。另外,每种生物/非生物胁迫都能激活一个或多个抗性信号传导途径,导致一系列抗性基因的诱导表达[40,41]。植物抗病防御反应的信号传导主要有氧爆、R基因介导的信号转导途径、水杨酸(SA)、一氧化氮(NO)、茉莉酸(JA)、乙烯(ET)以及他们的衍生物介导的信号途径[42]。Wang Zheng等[43]研究发现,菌核菌侵染油菜时,油菜体内的SA、JA信号途径是被顺式激活的。SA信号途径响应时间比JA信号途径响应时间早。这其中包括一系列基因,如SA、JA合成途径关键酶基因,ICS1、PDF1.2、LOX、AOS、AOC、WRKY70、WRKY75、NPR1等。Wang Zheng等[44]在甘蓝型油菜中过表达MPK4基因,能提高油菜对菌核菌和灰霉菌的抗性,同时激活PDF1.2基因的表达。ERFl和0RA59被证明是拟南芥中茉莉酸和乙烯信号的节点,组成型表达ERFl激活了一系列抗性相关基因PDF1.2和ChiB的表达并显著增强了对灰霉等真菌的抗性[45]。在油菜中组成型表达BnERF56能增强油菜对腐生营养型真菌核盘菌和灰霉菌的抗性[46]。研究表明,拟南芥转录因子(TF)WSKY33受MAPK3/MAPK6激活,WSKY33调节拟南芥植保素camalexin(抗腐生菌重要的次生代谢产物)的合成基因(PAD3和CYP71B15)的表达。
4.3油菜抗菌核菌基因组和蛋白组研究
以上这些研究均从单基因角度出发,研究角度片面和分散,缺少高通量鉴定策略,而菌核菌和油菜的互作过程涉及多种代谢途径和调控机制。Zhao J等先后利用全基因组芯片技术和寡核苷酸技术,比较抗/感菌核菌油菜栽培品种在感染菌核菌后基因差异表达的mRNA差异,找到了大量的差异基因[47]。Liang等[48]用2DE蛋白质组技术分析菌核菌感染和草酸胁迫情况下油菜蛋白质组的变化,发现油菜中与蛋白质生物合成、信号转导、胁迫响应和光合作用等生命活动相关的一些蛋白质发生了变化,抗氧化酶包括过氧化氢酶(CAT)、过氧化物酶(POD)、超氧化物歧化酶(SOD)均被抑制。Garg等对两个感/抗油菜品种的子叶进行比较蛋白组学分析,找到了一些与抗病相关的蛋白质,这些蛋白质参与乙烯的合成、抗氧化及基础代谢等生物学功能[49]。Wen等用2DE蛋白组技术分析了两个感/抗品种接种菌核菌后不同时期的蛋白质组变化,发现了一些与氧爆、JA、ET信号途径及细胞程序化死亡相关的差异蛋白。他们在油菜感染菌核菌的不同时间段表达是变化的,这在一定程度上为解释油菜抗菌核菌的机理提供了研究基础[50]。虽然通过以上方法找到了许多差异表达的基因或蛋白,却未对差异基因进行深入的功能分析,也未对这些基因是否与油菜抗菌核菌免疫机制相关做进一步的验证分析,因而无法解析油菜抗菌核菌的分子机理。
5 总结和展望
菌核病是油菜的三大病害之一,是造成我国油菜减产的主要原因。菌核菌侵染植株时,分泌一系列降解植物细胞壁和角质的酶及草酸,造成细胞壁松弛并及时侵入植株体内,加重病害。油菜抗菌核病是一个多因素促发的防御反应,虽然对以上不同致病因子在菌核菌侵染油菜中的作用研究,为我们从源头上克服菌核菌的侵染提供了思路,但是靠单个基因的超表达并不能从根本上阐明菌核病的致病机理。运用高通量的鉴定技术是研究油菜抗菌核菌机理的趋势,但是如何对这么多的差异蛋白进行整理和归纳仍然任重而道远。
各种不同的植物激素在植物抗逆中发挥着不同的作用。水杨酸、细胞分裂素、赤霉素在植物抵抗细菌机械损伤及活体营养型真菌中发挥着一定的作用;茉莉酸、乙烯在植物抵抗死体营养型真菌中发挥着重要的作用;同一植物激素在不同的植物体内也发挥着不同的抗病效果。植物体内的各种信号途径都不是孤立的,而是相互交联形成的大的网络结构,弄清楚各个信号途径的交联作用将为提高植物的某一生物特性提供更明了的意见。在油菜抗腐生菌菌核菌的相关研究中,应着重研究乙烯和茉莉酸信号途径在油菜抗菌核病中的作用机理,以期找到与油菜抗菌核菌密切相关的转录因子,为提高油菜的抗病性及抗性品种的选育提供更直接的依据。
参考文献:
[1] 侯树敏,Malgorzata Jedryczka,李强生,等.利用油菜花瓣实验检测油菜菌核病[J].中国农学通报,2009,25(17):203-205.
[2] Adams PB,AyersWA.Ecology of Sclerotinia species[J]. Phytopathology,1979,69:896-899
[3] 吴纯仁,刘后利.油菜菌核菌致病机理研究Ⅳ.病菌侵入途径和附着胞结构观察[J].华中农业大学学报,1990,9(1):56-58.
[4] 宋 超,唐庆华,李国英.新疆核盘菌的培养性状及其致病性研究[J].石河子大学学报,2007,25(3):269 -272.
[5] 周乐聪.油菜菌核病流行与防治的研究概况[J].中国油料,1994(增刊):101-108.
[6] 朱小惠,陈小龙.油菜菌核病的致病机理和生物防治[J].浙江农业科学,2010(5):1035-1039.
[7] 刘 辉.烟草赤星病菌角质酶的纯化、性质及在致病中的作用研究[D].泰安:山东农业大学硕士学位论文,2009.
[8] Cruickshank RH.The influences of epicuticular wax disruption and cutinase resistance on penetration of tomatoes by colletotrichum gloeosporioides[J].Phytopathology,2008,143(9):519-524.
[9] Vincenzo Lionetti,Felice Cervone.Methyl esterification of pectin p lays a role during p lant-pathogen interactions and affects plant resistance to diseases[J].Journal of Plant Physiology,2012,169:1623-1630.
[10]Yoneda A,Ito T,Higaki T,et al.Cobtorin target analysis reveals that pectin functions in the deposition of cellulose microfibrils in parallel with cortical microtubules[J]. Plant,2010,64:657-667.
[11]Kars I,Krooshof GH,Wagemakers L,et al.Necrotizing activity of five Botrytis cinerea endopolygalacturonases produced in Pichia pastoris[J].Plant,2005,43:213-225.
[12]官春云.性别决定及作物育种[J].作物研究,1994(S1):75-76.
[13]MaxWell DP,Lumsden RD.Oxalic acid production by Sclerotinia sclerotiorum in infected bean and inculture[J].Phytopathology,1970,60:1395-1398.
[14]Lumsden RD,Dow RL.Histopathology of Sclerotinia sclerotiorum infection of bean[J].Phytopathology,1973,63:708-715.
[15]Rai JN,Dhawan S.Studies on purification of toxlemetabolite produced by Sclerotinia sclerotiorum causing white rot disease of crucifers[J].Ind Phytopmthil,1976,29:406-411.
[16]吴纯仁,刘后利.草酸毒素在油菜抗病育种中的应用[J].中国农科学,1991,24(4):41-46.
[17]吴纯仁,刘后利.油菜菌核病的致病机理Ⅲ.罹病组织内草酸毒素积累和分布的初步分析[J].植物病理学报,1991,21(2):135-139.
[18]刘胜毅,周必文,潘家荣.油菜对毒素草酸的吸收代谢与抗性机理[J].植物病理学报,1998,28(1):33-37.
[19]毛 玮,侯英敏,刘志文.核盘菌和草酸诱导下的油菜几种酶活力的变化分析[J].大连工业大学学报,2011,30(1):39-42.
[20]Mucharromah EK,Kuc J.Oxalate and phosphate inducesystemic resistance against disease caused by fungibacteria and viruses in cucumber[J].Crop Protection,1991,10(4):265-270.
[21]Liu S,Wang H,Zhang J.In vitromutation and selection of doubled-haploid Brassica napus lines with improved resistance to Sclerotinia sclerotiorum[J].Plant Cell Reports,2005,24:133-144.
[22]Brett Williams,Mehdi Kabbage,Kim Hyo-Jin,et al. Tipping the balance:Sclerotinia sclerotiorum secreted oxalic acid suppresses host defenses by manipulating the host redox environment[J].PLoS Pathogens,2011,7(6):1-10.
[23]Zhu Wenjun,Wei Wei.A secretory protein of necrotrophic fungus Sclerotinia sclerotiorum that suppresses host resistance[J].PLoSONE,2013,8(1):e53901.
[24]Caleb Knepper,Elizabeth A.Arabidopsis NDR1 is an integrin-like protein with a role in fluid loss and plasma membrane-cell wall adhesion[J].Plant Physiology,2011,156:286-300.
[25]Coffeen WC,Wolpert TJ.Purification and characterization of serine proteases thatexhibit caspase-like activity and are associated with programmed cell death in Avena sativa[J].Plant Cell,2004,16:857-873.
[26]Liu Y,Schiff M,Czymmek K,et al.Autophagy regulates programmed cell death during the plant innate immune response[J].Cell,2005,121:567-577.
[27]Kim KS,Min JY,Dickman MB.Oxalic acid is an elicitor of plant programmed cell death during Sclerotinia sclerotiorum disease development[J].Mol Plant Microbe Interact,2008,21:605-612.
[28]Kabbage M,W illiams B,Dickman MB.Cell death control:the interplay of apoptosis and autophagy in the pathogenicity of Sclerotinia sclerotiorum[J].PLoS Pathog,2013,9(4):e1003287.
[29]Lai Zhibing,Wang Fei.A critical role of autophagy in plant resistance to necrotrophic fungal pathogens[J]. The Plant Journal,2011,66:953-968.
[30]齐绍武,官春云.甘蓝型油菜品系一些酶的活性与抗菌核病的关系[J].作物学报,2004,30(3):270-273.
[31]Jones JD,Dangl JL.The plant immune system[J].Nature,2006,444:323-329.
[32]LiangW,Yang B,Yu BJ,et al.Identification and analysis of MKK and MPK gene families in canola(Brassica napus L.)[J].BMCGenomics,2013,14:392.
[33]Tsuda K,Sato M,Stoddard T,et al.Network properties of robust immunity in plants[J].PLoS Genetics,2009,5:e1000772.
[34]Wang Z,Mao H,Dong CH,et al.Overexpression of Brassica napus MPK4 enhances resistance to Sclerotinia sclerotiorum in oilseed rape[J].Molecular Plant-m icrobe Interactions,2009,22:235-244.
[35]Bashi ZD,Rimmer SR.Brassica napus polygalacturonase inhibitor proteins inhibit Sclerotinia sclerotiorum polygalacturonase enzymatic and necrotizing activities and delay symptoms in transgenic plants[J].Can J Microbiol,2013,59(2):79-86.
[36]Williams B,Kabbage M.Tipping the balance:Sclerotinia sclerotiorum secreted oxalic acid suppresses host defenses by manipulating the host redox environment[J].PLoS Pathog,2011,7(6):100-107.
[37]da Silva LF,Dias CV.Expression of an oxalate decarboxylase impairs the necrotic effect induced by Nep1-like protein(NLP)of Moniliophthora perniciosa in transgenic tobacco[J].Mol Plant Microbe Interact,2011,24(7):839-848.
[38]Fan Y,Du K,Gao Y,et al.Transformation of LTP gene into Brassica napus to enhance its resistance to Sclerotinia sclerotiorum[J].Russian Journal of Genetics,2013,49(4):380-387.
[39]Rietz S,Bernsdorff FE.Members of the germin-like protein family in Brassica napus are candidates for the initiation of an oxidative burst that impedes pathogenesis of Sclerotinia sclerotiorum[J].Exp Bot,2012,63(15):5507-5519.
[40]Bostock RM.Signal crosstalk and induced resistance:Straddling the line between cost and benefit[J].Annu Rev Phytopathol,2005,43:545-580.
[41]Rojo E,Solano R,Sanchez-Serrano.Interactions between signaling compounds involved in plant defense[J].Plant Growth Regul,2003,22:82-98.
[42]Thatcher LF,Anderson JP,Singh KB.Plant defense responses:Whathave we learnt from Arabidopsis[J].Funct Plant Biol,2005,31:1-19.
[43]Wang Zheng,Tan Xiaoli.Defense to Sclerotinia sclerotiorum in oilseed rape is associated with the sequential activations of salicylic acid signaling and jasmonic acid signaling[J].Plant Science,2012,184:75-82.
[44]Wang Zheng,Mao Han,Dong Caihua,et al.Overexpression of Brassica napus MPK4 enhances resistance to Sclerotinia sclerotiorum in oilseed rape[J].The American Phytopathological Society,2009,22(3):235-244.
[45]Solano R,Stepanova A,Chao QM,etal.Nuclear events in ethylene signaling:a transcriptional cascademediated by ETHYLENE-INSENSITIVE3 and ETHYL-ENERESP0NSE-FACT0R1[J].Genes Dev,1998,12:3703-3714.
[46]Berrocal-Lobo M,Molina A,Solano R.Constitutive expression of ETHYL-ENERESP0NSE-FACT0R1 in Arabidopsis confers resistance to several necrotrophic fungi[J].Plant,2002,29:23-32.
[47]Zhao J,Buchwaldt L,Rimmer SR,et al.Patterns of differential gene expression in Brassica napus cultivars infected with Sclerotinia sclerotiorum[J].Mol Plant Pathol,2009,10(5):635-649.
[48]Liang Y,Strivastava S,Rahman MH,et al.Proteome change in leavesof Brassica napus L.as a result of Sclerotinia sclerotiorum challenge[J].Journal of Agricultural and Food Chemistry,2008,56:1963-1976.
[49]Garg H,Li H,Sivasithamparam K,etal.Differentially expressed proteins and associate histological and disease progression changes in cotyledon tissue of a resistance and susceptible genotype of Brassica napus infected with Sclerotinia sclerotiorum[J].PloS One,2013,8(6):e65205.
[50]Wen L,Tan TL,Shu JB,et al.Using proteomic analysis to find the proteins involved in resistance against Sclerotinia sclerotiorum in adult Brassica napus[J].European Journal of Plant Pathology,2013,137:505-523.
中图分类号:S435.654
文献标识码:A
文章编号:1001-5280(2015)01-0084-07
DO I:10.3969/j.issn.1001-5280.2015.01.21
收稿日期:2014 11- 16
作者简介:李 慧(1989-),女,湖南邵阳人,硕士研究生,Email:lihuihncs@163.com。*通信作者:官春云,教授,中国工程院院士,Email:guancy2011@aliyun.com。
基金项目:湖南省自然科学基金(13JJ2027)。
Research Progress on Resistance Mechanism of Brassica napus to Sclerotinia sclerotiorum
LIHui1,WEN Li1,2,LIU Kai1,GUAN Chun-yun1*
(1 Oil Crops Institute/National Oil Crops Improvement Center,Hunan Agricultural University,Changsha,Hunan 410128,China;2 College of Chemical and Biological Engineering,Changsha University of Science and Technology,Changsha,Hunan 410114,China)
Abstract:Sclerotinia sclerotiorum influences the yield of Brassica napus seriously.Research on pathogenic mechanism of Sclerotinia sclerotiorum in oilseed rape can provide the theoretical foundation for breeding.In this paper,the research progress on etiology characteristics,pathogenic mechanism of Sclerotium sclerotium,the host response and resistance mechanism of Brassica napus to Sclerotinia sclerotiorum were summarized,and the current problems and research trend on pathogenicmechanism of Sclerotium sclerotium were prospected.
Keywords:oilseed rape;Sclerotium sclerotium;pathogenicmechanism;disease resistance

