肽基脯氨酰顺反异构酶抑制剂胡桃醌对宫颈鳞癌SiHa细胞凋亡的作用*
张 巍, 金 瑛, 朱文赫, 李 妍, 罗 军, 芦晓静, 陈默然, 姜艳霞
(吉林医药学院,吉林 吉林 132013)
肽基脯氨酰顺反异构酶抑制剂胡桃醌对宫颈鳞癌SiHa细胞凋亡的作用*
张 巍△, 金 瑛, 朱文赫, 李 妍, 罗 军, 芦晓静, 陈默然, 姜艳霞
(吉林医药学院,吉林 吉林 132013)
目的: 探讨肽基脯氨酰顺反异构酶抑制剂胡桃醌对宫颈鳞癌SiHa细胞增殖和凋亡的影响及其促凋亡的机制。方法: 选取处于对数生长期的SiHa细胞,将其分为空白对照组和不同剂量(10、20、50、80及100 μmol/L)胡桃醌给药组,共6组。采用MTT法观察胡桃醌对SiHa细胞的抑制作用,并计算出半数抑制浓度(IC50=20.4 μmol/L),依据IC50确定胡桃醌的有效浓度;选取与IC50接近的浓度(20 μmol/L)通过Hoechst 33258及流式细胞术测定胡桃醌对SiHa细胞凋亡的影响,Western blot检测凋亡相关蛋白caspase-3、8、9以及抑癌基因PTEN的蛋白水平。结果: MTT实验结果显示,与对照组比较,各给药组对细胞活力的抑制作用明显,差异有统计学意义(P<0.05);Hoechst 33258检测表明,20 μmol/L胡桃醌处理细胞12 h后可出现明显的细胞核典型凋亡细胞形态,流式细胞术检测结果说明胡桃醌可诱导SiHa细胞出现早期凋亡;Western blot检测显示与正常对照组相比,20 μmol/L胡桃醌处理细胞12 h后,cleaved caspase-3、8、9及PTEN的蛋白水平明显增加。结论: 胡桃醌可以抑制SiHa细胞的活力,并诱导细胞凋亡,其机制主要是通过抑制caspase途径并增加抑癌基因的表达。
胡桃醌; 肽基脯氨酰顺反异构酶; 细胞凋亡; SiHa细胞
肽基脯氨酰顺反异构酶(peptidyl-prolylcis/transisomerase,Pin1)是癌细胞中普遍存在的高表达的基因之一,其在肿瘤细胞中与细胞的分化和增殖有关,在肿瘤细胞中过表达,在正常组织中则低表达,去除它则肿瘤细胞增殖减低,凋亡增加。胡桃醌(juglone)是从胡桃揪新鲜根、枝皮及青果皮等中提取出来的羟基奈醌类化合物,黄色针状结晶,熔点为155 ℃, 有升华性,微溶于热水,是核桃楸中毒性物质之一[1]。Hennig等[2]的研究发现胡桃醌可以抑制Pin1的活性,Pin1可特异性催化蛋白分子中磷酸化的Ser/Thr-Pro基序发生顺反异构转变。近来的研究报道显示,胡桃醌对多种癌细胞株具有活性作用,包括S180实体瘤、小鼠腹水型肝癌和自发性胃癌等[2-3]。Bhargava等[3]和Varga等[4]研究还发现:胡桃醌对人外周血的淋巴细胞钾离子通道具有封闭作用,影响了细胞的生长和T细胞增殖;胡桃醌还可直接修饰巯基基团,使RNA转录起始前复合物断裂,导致细胞mRNA的合成抑制,发挥阻断转录的作用[4-5]。除此之外,胡桃醌还具有诱导细胞凋亡的重要作用。另外的一些实验发现,醌类化合物对细胞生长的抑制作用表现在S期的抑制,而且这种细胞毒性作用于醌类物质的酚羟基个数相关[6]。而我们的前期研究中发现,胡桃醌可抑制宫颈癌HeLa细胞(含HPV18 DNA)的增殖及促其发生凋亡的作用[7]。本实验旨在研究胡桃醌对另外一种宫颈鳞癌SiHa(含HPV16 DNA)的细胞凋亡的影响,从而为胡桃醌的抗宫颈癌作用提供重要的理论依据。
材 料 和 方 法
1 药物、试剂和仪器
SiHa细胞系由本院科研实验室保存。3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)、胡桃醌(5-羟基-1,4-奈醌)、Hoechst 33258和二甲基亚砜(dimethyl sulfoxide,DMSO) 购于Sigma。I 抗兔抗人cleaved caspase-3,8,9和PTEN单克隆抗体均购自Abcam。Olympus 倒置显微镜(Olympus)。
2 实验方法
2.1 细胞培养 用含10%小牛血清、1×105U/L青霉素及100 mg/L链霉素的DMEM高糖培养液并置于5% CO2、95%湿度及37 ℃的培养箱中培养。细胞培养过程中,2 d更换1次培养液,每周按1∶3传代。
2.2 细胞活力的检测 将培养的SiHa细胞按1×108/L的密度接种于96孔板,分为空白对照组及实验组(10、20、50、80及100 μmol/L浓度的胡桃醌)共6组,再培养24 h 后,与空白对照组一起每孔加入20 μL MTT(5 g/L), 37 ℃继续孵育4 h。4 h后取出弃去上清液,每孔加入150 μL DMSO,测量前振板10 min,于570 nm测定A值。IC50通过计算软件获得。
2.3 细胞凋亡率检测 取IC50附近浓度值20 μmol/L,采用Hoechst 33258染色法,细胞培养12 h后,吸出孔内培养液,用PBS 冲洗2 次,每次2 min; 加入多聚甲醛固定15 min,吸出固定液,用PBS 洗2 次,每次2~3 min; 每孔加入1 mL Hoechst 33258 工作液,避光染色5 min,荧光显微镜下检测细胞凋亡,随机观察5个视野。
2.4 Annexin V/PI双染法检测细胞凋亡 取对数生长期细胞接种于6 孔培养板过夜,弃上清,加入20 μmol/L胡桃醌,同时设正常对照组。继续培养12 h,PBS 洗涤细胞1 次,按试剂盒说明书分别加入Annexin V-FITC和PI,用流式细胞仪检测细胞凋亡率。Annexin V及PI均阳性的细胞为凋亡细胞。
2.5 蛋白印迹法检测蛋白表达 按2.4方法处理细胞,加药12 h 后提取细胞蛋白,BCA 法测蛋白浓度,变性后上样30 μg,于12% SDS-PAGE 分离蛋白,湿转至PVDF 膜并用5%脱脂奶粉于37 ℃条件下封闭2 h,抗 cleaved caspase-3、8、9和PTEN的 I 抗(1∶1 000)4 ℃孵育过夜,HRP标记的 II 抗室温孵育2 h,曝光显影。实验组的表达水平与对照组相比为相对表达量。
3 统计学处理
采用SPSS 13.0统计软件分析数据。各组数据用均数±标准差(mean±SD)表示。组间均数比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 胡桃醌对SiHa细胞生长的影响
MTT实验表明胡桃醌对SiHa细胞生长的抑制作用呈剂量依赖关系,随胡桃醌浓度的增加抑制作用增强;各给药组与对照组比较,有统计学意义(P<0.05)。IC50为20.4 μmol/L,见图1。
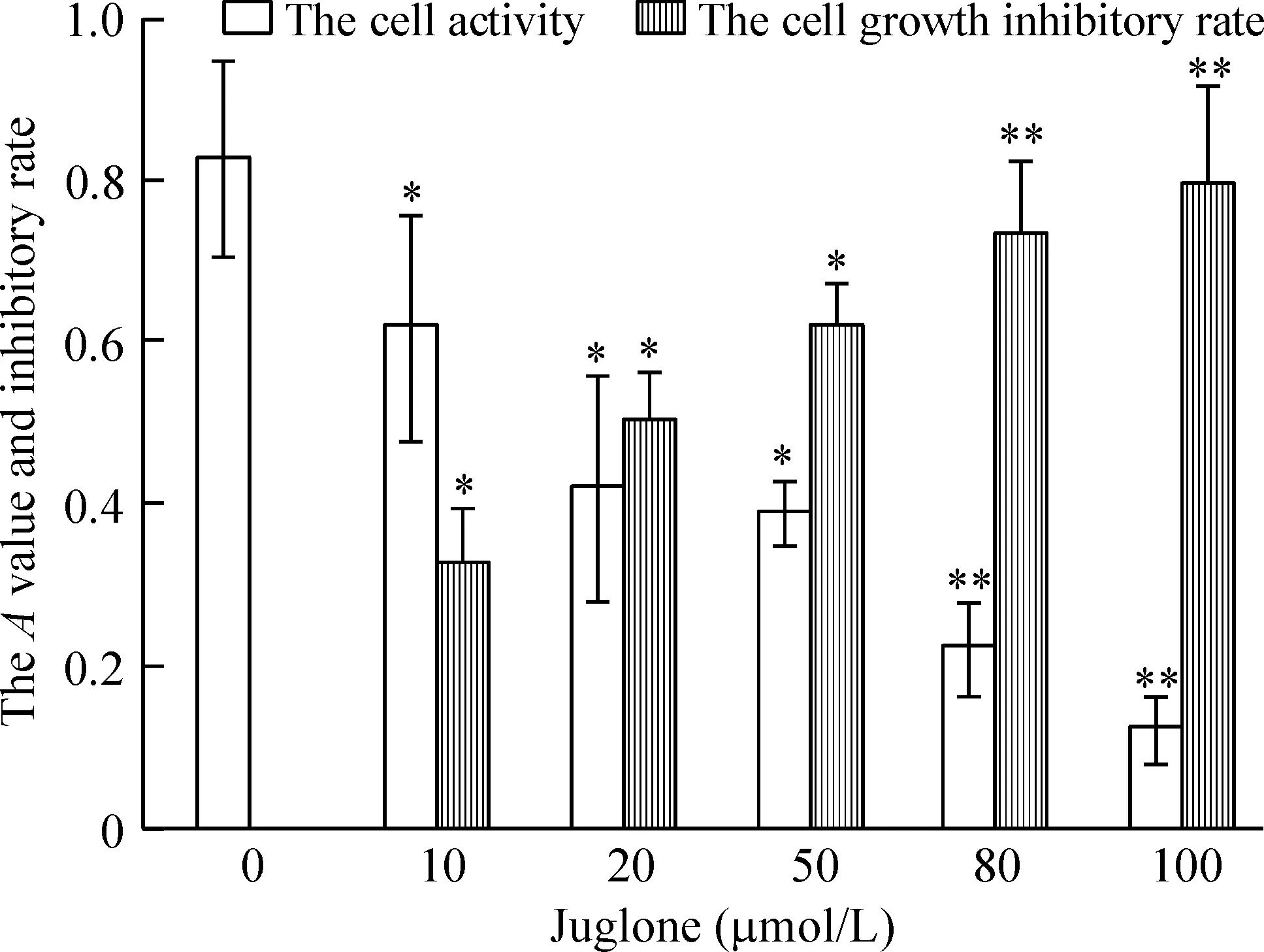
Figure 1.The effect of different concentrations of juglone on the cell viability. Mean±SD. n=4. *P<0.05, **P<0.01 vs 0 μmol/L.
2 胡桃醌对SiHa细胞核形态的影响
对照组SiHa细胞大小均一,成弥散均匀的淡蓝色弱荧光;经20 μmol/L胡桃醌处理12 h后,SiHa细胞核明显皱缩,并可见致密强荧光,存在核碎裂和凋亡小体等强荧光团块,见图2。
3 胡桃醌对SiHa细胞早期凋亡的影响
如图3所示,胡桃醌(20 μmol/L)与SiHa细胞作用12 h后,细胞早期凋亡率(右下象限)明显高于正常对照组(P<0.05)。
4 Western blotting 法确定胡桃醌对SiHa细胞内caspase-3、8、9和PTEN蛋白含量的影响
如图4所示,Western blotting 法分析表明20 μmol/L胡桃醌组cleaved caspase-3、8、9和PTEN蛋白表达均升高。
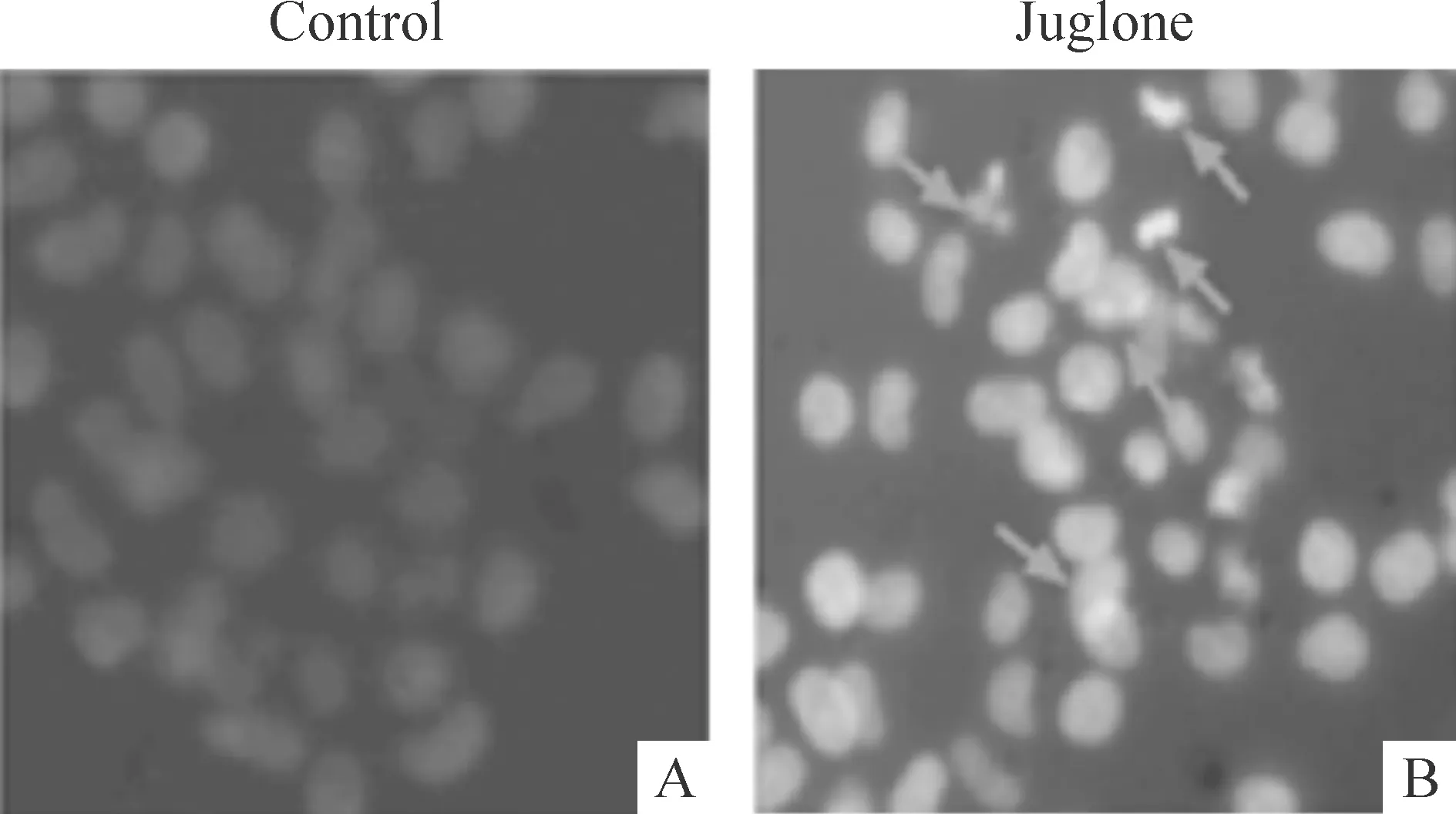
Figure 2.The nuclear morphological changes of the SiHa cells treated with 20 μmol/L juglone(×400).

Figure 3.The effect of juglone (20 μmol/L) on the early apoptosis of SiHa cells. Mean±SD. n=3. *P<0.05 vs control group.
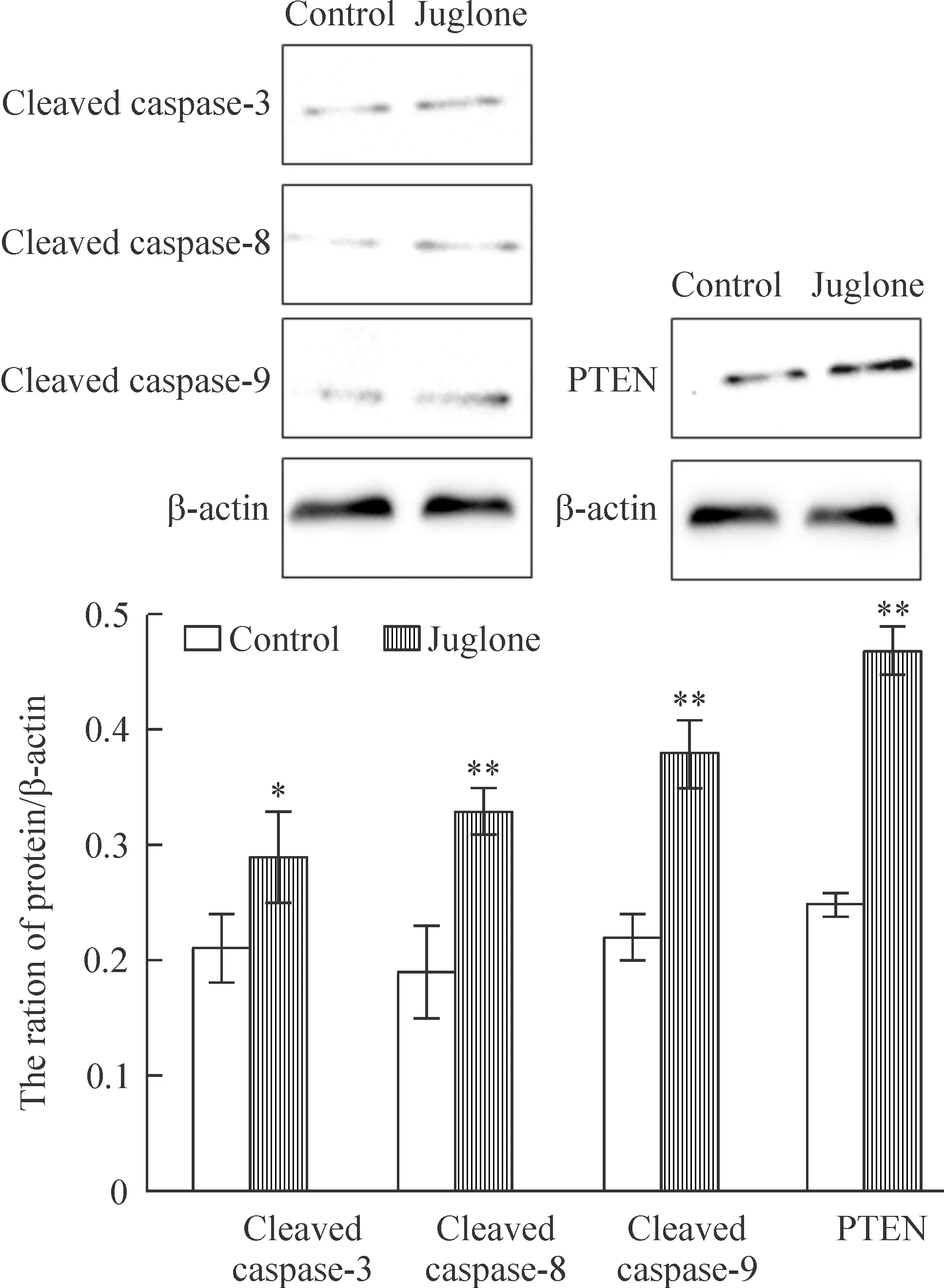
Figure 4.The protein levels of caspase-3, 8, 9 and PTEN in the SiHa cells treated with juglone at concentration of 20 μmol/L for 12 h. Mean±SD. n=3. *P<0.05, **P<0.01 vs control group.
讨 论
宫颈癌是妇科常见恶性肿瘤,人乳头瘤病毒(human papillomavirus, HPV)是它的主要致病原因, 在对宫颈癌高危人群的筛查及治疗效果评价时,HPV是主要生物学指标[8-10]。在对HPV的治疗上,目前尚无理想药物,在高危HPV16、18等感染问题上,尤其缺乏针对性的特效方法。我国物产丰富,植物药用资源很多, 在中草药研究中,发现了一批疗效好、不良反应小的天然抗癌、抗病毒药物,这为病毒感染所致癌症的防治工作带来了新的希望[11]。
胡桃醌又名5-羟基-1,4-萘醌,是一种从胡桃楸的叶、皮及外果壳中提取天然环状醌类,早有抗肿瘤作用的报道。Pin1在各类癌细胞中普遍高表达,与癌细胞的分化与增殖有关,在正常组织中表达却很低,敲除Pin1则肿瘤细胞增殖减低,细胞凋亡增加[12]。胡桃醌抗肿瘤活性的机制是胡桃醌与Pin1催化域不可逆性结合,抑制Pin1的活性,抑制了细胞的增殖,促进细胞的凋亡[13-14]。
本实验以HPV16阳性的人宫颈鳞癌细胞株SiHa为研究对象, 研究发现不同浓度的胡桃醌可明显抑制SiHa细胞生长,其IC50为20.4 μmol/L。
细胞凋亡是指基因控制细胞自主的有序的死亡,以维持内环境的稳定,这与细胞坏死过程明显不同,细胞凋亡是一个主动过程,涉及一系列基因的激活与表达,在受控中发挥生物调节作用;而细胞坏死是病理条件下自体损伤现象,是一个被动的过程,细胞凋亡是为更好地适应生存环境,主动的一种死亡过程[15]。Caspase是一个在细胞凋亡中起关键作用的酶家族,caspase-3可以剪切caspase-2、6、7、9的前体,这种蛋白酶剪切是细胞凋亡的重要组成部分。Caspase-8通常以酶原形式存在,在细胞凋亡过程中被激活,其被认为是caspase凋亡通路上游的酶,被激活后可激活下游的caspase-4、6、9和10。Caspase-9也属于上游酶,被激活后可活化最关键的酶caspase-3,从而促进后续的细胞凋亡过程。本研究结果通过细胞核染色检测观察,发现胡桃醌可诱导癌细胞凋亡,进一步对其机制研究也发现,胡桃醌可导致cleaved caspase-3、8、9表达升高。PTEN为一种抑癌基因,通过化学通路传导,把信号传给细胞,使细胞停止分裂并进入程序性死亡[16]。本研究发现胡桃醌可促进SiHa细胞的PETN蛋白表达。说明胡桃醌的促凋亡机制可能是通过激活caspase途径以及提高抑癌基因的表达来实现的。
本研究旨在为宫颈癌的治疗提供一个新的思路,其具体的作用机制及药物作用的靶点等仍待进一步深入细致的研究。
[1] 万志强,李 薇,崔久嵬,等. 胡桃醌对白血病细胞增殖的抑制作用[J]. 吉林大学学报:医学版,2012, 38(3):486-489.
[2] Hennig L,Christner C,Kipping M,et al.Selective inactivation of parvulin-like peptidyl-prolylcis/transisomerases by juglone[J].Biochemistry,1998,37(17): 5953-5960.
[3] Bhargava UC, Westfall BA.Antitumor activity ofJuglansnigra(black walnut) extractives[J]. J Pharm Sci, 1968, 57(10):1674-1677.
[4] Varga Z, Bene L, Pieri C, et al. The effect of juglone on the membrane potential and whole-cell K+currents of human lymphocytes[J]. Biochem Biophys Res Commun, 1996, 218(3):828-832.
[5] Xu HL, Yu XF, Qu SC, et al. Anti-proliferative effect of Juglone fromJuglansmandshuricaMaximon human leukemia cell HL-60 by inducing apoptosis through the mitochondria-dependent pathway[J]. Eur J Pharmacol, 2010, 645(1-3):14-22.
[6] Movsesyan VA, Stoica BA, Yakovlev AG, et al. Anan-damide-induced cell death in primary neuronal cultures: role of calpain and caspase pathways[J]. Cell Death Differ, 2004, 11(10):1121-1132.
[7] 张 巍,赵行宇,李 妍,等. 不同浓度的胡桃醌对HeLa细胞的细胞凋亡作用的影响[J]. 解放军医学杂志, 2012, 38(2):13-16.
[8] 周 莉,陈 姗,张帝开. 持续性人乳头瘤病毒感染与宫颈癌的研究进展[J].中国病理生理杂志, 2010, 26(12): 2482-2486.
[9] Duenas-Gonzalez A, Serrano-Olvera A, Cetina L, et al. New molecular targets against cervical cancer|[J]. Int J Womens Health, 2014, 6:1023-1031.
[10]Gao YE, Zhang J, Wu J, et al. Detection and genotyping of human papilloma virus DNA in cervical cancer tissues with fluorescence polarization[J]. Acta Biochim Biophys, 2003, 35(11):1029-1034.
[11]赵 峰,刘培勋. 中药抗肿瘤及其转移机制研究进展[J]. 中国中西医结合杂志, 2007, 27(2):178-181.
[12]张崇敬,张志辉,徐柏玲,等. Pin1及其抑制剂的研究进展[J]. 药学学报, 2008, 43(1):9-17.
[13]Chao SH, Greenleaf AL, Price DH. Juglone, an inhibitor of the peptidyl-prolyl isomerase Pin1, also directly blocks transcription[J]. Nucleic Acids Res, 2001, 29(3):767-773.
[14]Li ZB, Wang JY, Jiang B, et al. Benzobijuglone, a novel cytotoxic compound fromJuglansmandshurica, induced apoptosis in HeLa cervical cancer cells[J]. Phytomedicine, 2007, 14(12):846-852.
[15]于春艳,刘 希,张 钰,等. 自噬溶酶体抑制剂氯化铵促进维生素K3诱导人宫颈癌HeLa细胞凋亡的作用[J]. 中国病理生理杂志,2013, 29(7):1197-1201.
[16]王 斌,傅庆诏,李晓翠,等. 野生型PTEN基因对卵巢癌细胞株的影响[J].中国病理生理杂志, 2007, 23(8):1516-1519.
Pin1 inhibitor juglone induces apoptosis in human cervical cancer SiHa cells
ZHANG Wei, JIN Ying, ZHU Wen-he, LI Yan, LUO Jun, LU Xiao-jing, CHEN Mo-ran, JIANG Yan-xia
(JilinMedicalCollege,Jilin132013,China.E-mail:jlmmczw@163.com)
AIM: To explore the effect of peptidyl-prolylcis/transisomerase (Pin1) inhibitor juglone on apoptosis of human cervical cancer SiHa cells. METHODS: Cultured SiHa cells were incubated with juglone at concentrations of 10, 20, 50, 80 and 100 μmol/L for 24 h. The SiHa cell activity was detected by methyl thiazolyl tetrazolium (MTT) assay. The cell apoptosis was analyzed by flow cytometry with Hoechst 33258 staining. The protein levels of cleaved caspase-3,8,9 and PTEN was determined by Western blotting. RESULTS: In different doses of juglone groups, the SiHa cell growth was greatly inhibited (P<0.05) in a dose-dependent manner as compared with control group. The IC50of juglone was 20.4 μmol/L. After treatment with juglone at concentration of 20 μmol/L for 12 h, the apoptosis of SiHa cells was induced, and the typical morphological changes of cell apoptosis such as karyopyknotic pyknic hyperfluorescence bolus, nuclear fragmentation and apoptotic body were observed by Hoechst 33258 staining. The early apoptotic rate was increased significantly as compared with the control. The protein levels of cleaved caspase-3, 8, 9 and PTEN were also increased significantly as compared with control group. CONCLUSION: Juglone significantly inhibits the cell activity and induces the apoptosis of SiHa cellsinvitroby inhibiting the caspase pathway and increasing the expression of anti-oncogene.
Juglone; Peptidyl-prolylcis/transisomerase; Apoptosis; SiHa cells
1000- 4718(2015)03- 0543- 04
2014- 09- 23
2014- 12- 29
国家自然科学基金资助项目(No. 21102055);吉林省科技厅科技发展项目(No. 20130101157JC);吉林省教育厅“十二五”教育技术研究项目(No. 2012-314;2014-371)
△ 通讯作者 Tel: 0432-64560459; E-mail: jlmmczw@163.com
R363;R730.23
A
10.3969/j.issn.1000- 4718.2015.03.028

