普通超声与实时弹性超声在诊断甲状腺癌转移性颈部淋巴结中的应用
郑璇,陈松旺
南京医科大学附属南京医院(南京市第一医院) 功能科, 江苏 南京 210000
普通超声与实时弹性超声在诊断甲状腺癌转移性颈部淋巴结中的应用
郑璇,陈松旺
南京医科大学附属南京医院(南京市第一医院) 功能科, 江苏 南京 210000
目的探讨普通超声与实时弹性超声在诊断甲状腺癌转移性颈部淋巴结中的应用价值。方法回顾性分析我院56例甲状腺癌患者的普通超声及实时弹性超声检查资料。普通超声根据5个评分标准的总分判断淋巴结是否转移。实时弹性成像中,运用2种方法对淋巴结进行评估,一种是RTE4分评级法,另一种是测量形变比值(EXL值),采用受试者工作曲线ROC计算出EXL的临界值。普通超声与弹性超声联合诊断采取联合评价方法。3种方法的诊断结果均与术后病理结果进行对比。结果普通超声诊断甲状腺癌转移性颈部淋巴结的灵敏度、特异度、准确度分别为76%、90%和82%,弹性超声诊断的灵敏度、特异度、准确度分别为89%、75%和83%,两种方法联合诊断的灵敏度、特异度、准确度分别96%、88%和92%。EXL2/1的最佳临界值为2.17,灵敏度为88%,特异度为88%,ROC曲线下的面积为0.91。结论普通超声与弹性超声联合诊断能够提高甲状腺癌转移性颈部淋巴结的诊断效能。
普通超声;弹性超声;甲状腺癌;转移性淋巴结
甲状腺癌是临床上常见、多发的肿瘤,发病率逐年递增,是近20年发病率增长最快的实体恶性肿瘤,年均增长6.2%。目前,已经是占女性恶性肿瘤第5位的常见肿瘤。甲状腺癌最常见的病理类型为甲状腺乳头状癌,容易并发颈部淋巴结转移,术前判断淋巴结的转移与否,对手术方案的选择、淋巴结清扫范围的确定、患者预后及后续治疗都有很重要的意义。超声检查作为甲状腺及淋巴结疾病的首选检查方法,在疾病的初诊及术后复查中占有极其重要的地位。以往诊断淋巴结是否转移最常用的方法为触诊及超声,近年来,弹性超声的应用使经验触诊向电子触诊转变。本研究的目的是研究普通超声、弹性超声及二者联用在甲状腺癌转移性颈部淋巴结诊断中的应用价值。
1 资料与方法
1.1 研究对象
收集2014年4月~9月于我院经手术病理或穿刺活检证实的甲状腺癌患者56例,淋巴结共159枚,其中男24例,女32例,年龄19~84岁,平均43.6岁。所有患者术前均行颈部淋巴结普通超声及弹性超声检查,根据美国癌症联合委员会(American Joint Committee on Cancer,AJCC)提出的颈部淋巴结分区标准,将淋巴结分区,并记录每个淋巴结的部位、大小、纵横比、形态、内部回声、血流情况,根据RTE4分评级法[1]将淋巴结分型、评分并测量相对形变比值EXL2/1等。
1.2 仪器与方法
采用百胜Mylab Twice超声诊断仪,线阵宽频探头,探头频率为3~14 MHz,对每个病人的颈部淋巴结进行术前常规普通超声及弹性超声扫查。
(1)普通超声评价方法:查阅相关文献,总结普通超声5个评定标准,见表1。短轴≤临界值为良性,短轴>临界值为恶性[2]。根据AJCC的诊断标准[3]:短轴的临界值Ⅰ区为11 mm,Ⅱ区为13 mm,Ⅲ区为5 mm,Ⅳ区为9 mm,Ⅴ区为7 mm,Ⅵ区为6 mm。纵横比为超声检查取最大切面时纵径与横径的比值,纵径是指与皮肤垂直的淋巴结最大径,横径是指与皮肤平行的淋巴结最大径。内部回声均匀或门样结构为良性,不均匀为恶性,不均匀包括液化、钙化等。门样血流或无血流为良性,丰富血流、混合型血流或边缘血流为恶性[4]。第VII区因不能被超声扫查到,所以排除在外。淋巴结的每项标准分数相加为此淋巴结的得分,5~6分为良性淋巴结,7~10分为转移性淋巴结[5]。

表1 普通超声诊断标准及评分
(2)弹性超声评价方法:嘱患者取头部正位,颈部肌肉放松,以1~2次/s的频率垂直于颈部切面轻压探头,探头加压方向为辐射轴的方向,取得较稳定的弹性图像并使脂肪层组织为较均匀的绿色时,冻结图像,根据RTE4分评级法[1]将每个淋巴结分型并评分,见表2。用描记法先画出目标淋巴结(1区)所在范围,再画出对比组织颈部肌肉(2区)的范围,软件自测2区与1区的EXL2/1。

表2 弹性超声诊断标准及评分(RTE分型及评分)
(3)普通超声与弹性超声联合评价方法:将每个淋巴结的不同超声评分与弹性评分相加,良性淋巴结与恶性淋巴结的临界分值为10~11分,其中5~10分为良性淋巴结,11~18分为恶性淋巴结[5]。
1.3 统计学方法
采用SPSS 19.0统计软件进行数据处理,短轴、纵横比、形态、内部回声、血流情况及普通结果、弹性结果和联合诊断结果采用χ2检验和Fisher精确概率法检验,以P<0.05为差异有统计学意义。分级资料的比较采用秩和检验,以P<0.05为差异有统计学意义。运用受试者工作特征曲线(Receiver Operating Characteristic,ROC),得出EXL2/1数值以及特异度、敏感度、最佳临界值。
2 结果
56例患者中,乳头状癌52例,滤泡状癌1例,髓样癌2例,未分化癌1例。经病理证实,转移性淋巴结92枚,其中乳头状癌75枚,滤泡状2枚,髓样癌3枚,未分化癌12枚;未转移淋巴结67枚。
2.1 普通超声诊断与病理诊断结果比较
普通超声诊断甲状腺癌颈部淋巴结转移与否的标准中,形态没有统计学意义,但是短轴、纵横比、内部回声、血流情况在转移性淋巴结组和非转移性淋巴结组中有明显差别,转移组淋巴结较非转移组淋巴结短轴更大、内部回声更不均匀,见表3。
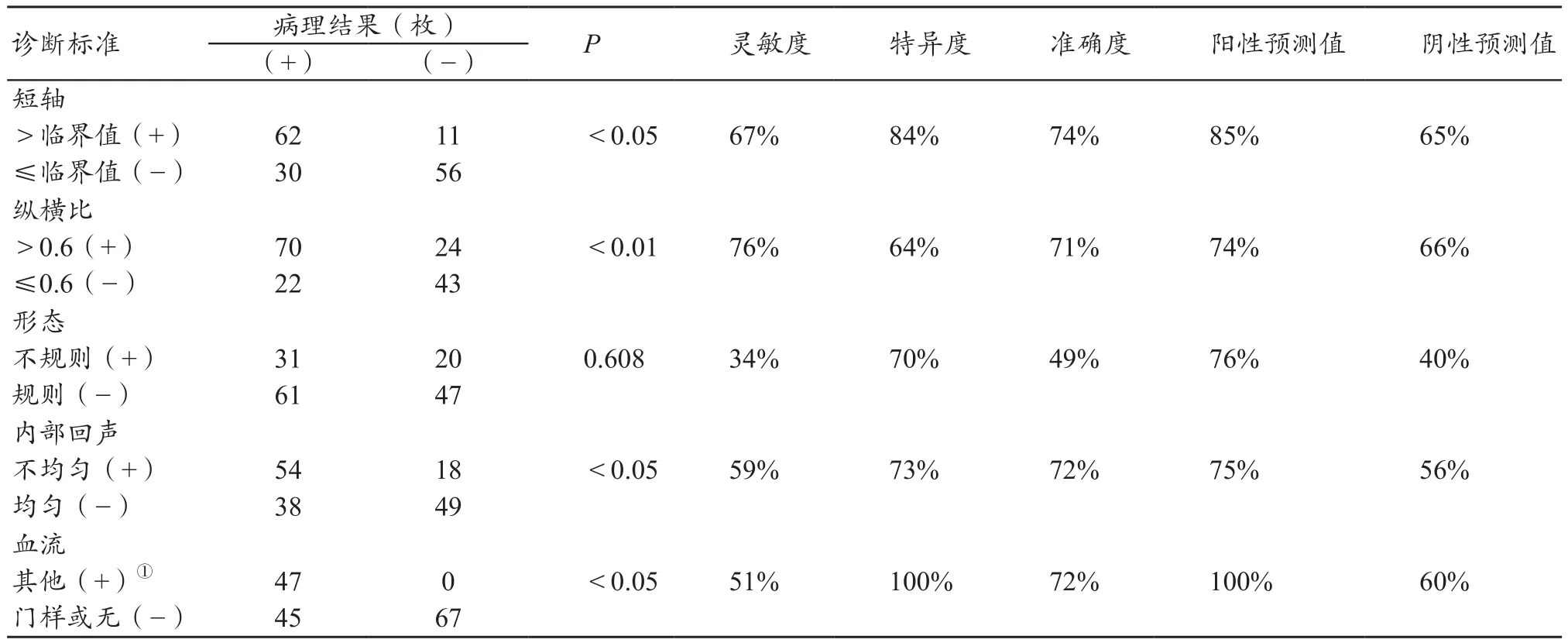
表3 普通超声诊断与病理诊断结果对比
2.2 普通超声、弹性超声及二者联合诊断结果与病理结果对比
普通超声、弹性超声及二者联合诊断结果与病理结果对比,见表4~5。

表4 3种诊断方法与病理诊断的结果比较(枚)
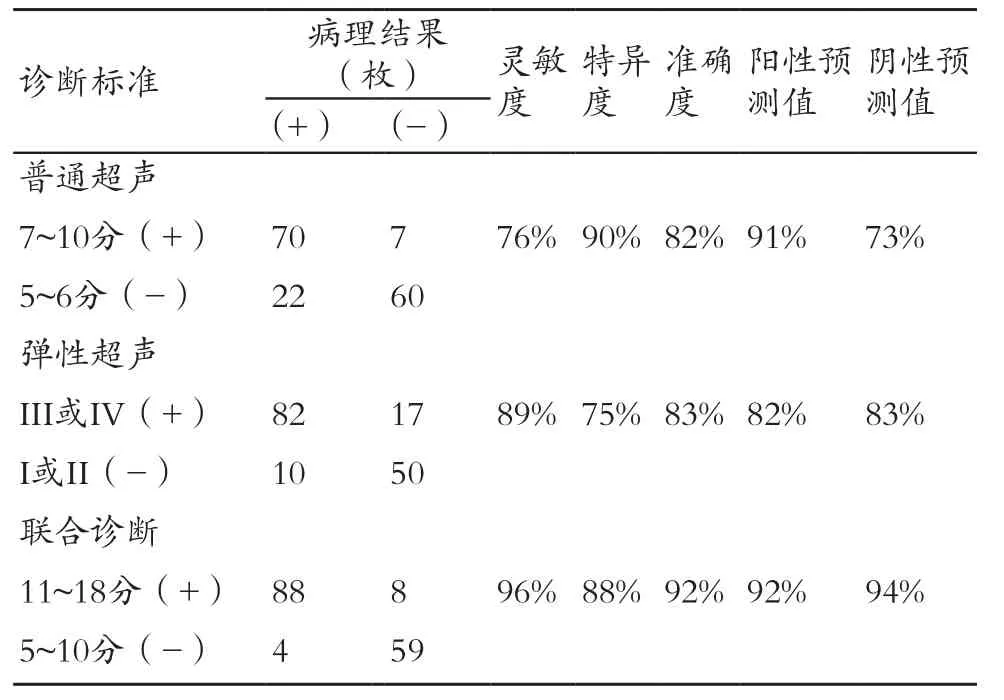
表5 3种诊断方法的灵敏度、特异度、准确度、阳性预测值、阴性预测值比较
由表5可知,弹性超声在诊断甲状腺癌颈部转移性淋巴结方面,灵敏度较普通超声高,但特异度较普通超声稍低,联合诊断方法可取得较高的灵敏度与特异度。普通超声及弹性超声图像,见图1。
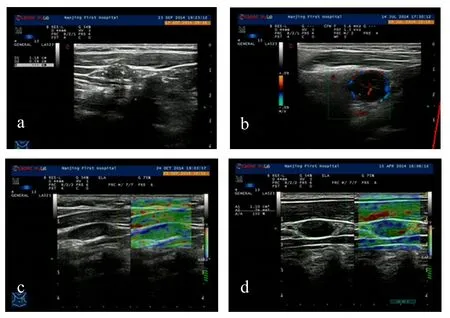
图1 普通超声及弹性超声图像
根据ROC曲线得出EXL2/1的临界值为2.17,敏感度为88%,特异度为88%,ROC曲线下面积为0.91,见图2。
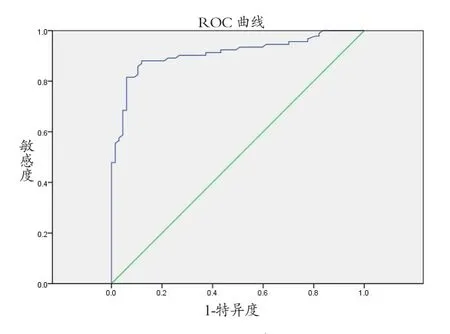
图2 ROC曲线图
注:① 表示边缘血流、混合血流或丰富血流信号。
3 讨论
普通超声是根据淋巴结的大小、纵横比、形态、边界、内部回声、血流情况等来判断淋巴结是否转移,弹性超声能够提供病灶硬度方面的信息。以往常用触诊来感知淋巴结的大小及硬度,此种方法较为主观,淋巴结的深度也影响触诊的敏感度。而运用弹性超声,可将病灶的硬度“可视化”“定量化”。本研究结果显示:普通超声特异度较弹性超声高,弹性超声灵敏度较普通超声高,二者结合能够取得更好的诊断效果。
3.1 普通超声
短轴最能代表淋巴结大小,Lyshchik[6]等以8 mm作为颈部淋巴结的临界值,诊断准确度为65%,本次研究中得出的准确度为74%,可见不同分区的淋巴结应以相应的临界值来作为评价标准。转移性淋巴结纵横比多>0.6,可能与癌细胞浸润开始于皮质,导致淋巴结的结构改变有关。本研究中纵横比的灵敏度为76%,与Lyshchik等[6]的研究结果基本一致。但由于淋巴结炎症、淋巴结结核、淋巴瘤等也可使淋巴结趋向圆形,因此其特异性较低。正常淋巴结内可见淋巴门结构或呈均匀低回声,本研究中38枚转移性淋巴结被误诊为正常淋巴结,可能与肿瘤浸润早期尚未浸润淋巴门结构有关。甲状腺癌转移性淋巴结多表现为内部回声不均匀,液化坏死或微小钙化。甲状腺乳头状癌及髓样癌转移性淋巴结易发生微小钙化,乳头状癌较髓样癌更常见[7],有研究显示肿瘤细胞释放血管生成因子促进丰富的新生血管生成,使得转移性淋巴结内血流丰富而紊乱,血管走行不规则或增粗扭曲。正常淋巴结为无血流或门样血流,而当血流丰富、散乱分布时,则转移的可能性增大[8]。本次研究中以血流情况进行评估,阳性淋巴结共47枚,病理证实均为转移性淋巴结;阴性淋巴结共112枚,病理证实45枚为转移性淋巴结,可能与部分淋巴结较小,内部血流显示欠佳及浸润早期门样血流尚未被破坏有关。
3.2 弹性超声
对于淋巴结弹性图像的评分现在并没有一个统一的标准[9-10]。本文采用RTE4分评级法。经统计显示:弹性超声阴性但病理阳性10枚,其中8枚淋巴结伴大部分液化坏死,无回声区表现为红绿相间的彩色伪像,高回声区表现为较均匀的蓝色区域,高回声所占比例<50%,评级为Ⅰ-Ⅱ级;另2枚淋巴结内部回声尚均匀,图像中心以绿色为主,外周条状蓝色区域,评级为Ⅰ级。液体在弹性超声中大部分表现为红蓝相间的彩色伪像,当液体量较大时表现为中心的彩色伪像失落,诊断为阴性;淋巴结内的高回声表现为蓝色区域,当液化坏死范围较小时,则以蓝色高回声为主。所以弹性超声不适用于范围较大的液化坏死性淋巴结的诊断。肿瘤细胞初期未引起内部的改变,仅表现为周边结构较中心结构硬,在弹性图像上表现为周边的蓝色伪彩,但在二维图像中基本与正常淋巴结无异。本研究中弹性超声阳性但病理结果阴性的淋巴结共17枚。在弹性图像中,有6枚淋巴结蓝色区域>50%,但并非均匀深蓝色,而表现为大部分浅蓝色。有学者称,弹性图像中深蓝色区域的硬度要大于浅蓝色区域的硬度。Teng等[11]表示,结核淋巴结、瘢痕淋巴结等都可能会表现出较硬的区域,也可导致结果假阳性。
淋巴结的EXL2/1值,与应变率(Strain Ratio,SR)相同,没有时间参数。第一个感兴趣区(Region of Interest,ROI)为淋巴结本身,第二个感兴趣区为对比组织,据ROC曲线得出EXL2/1的最佳临界值为2.17,敏感度为88%,特异度为88%。此临界值相对于Lyshchik[6]、Alam[5]的研究结果较大,这可能与不同弹性成像软件或操作者经验和入选病理差异有关。迄今仍然没有一个标准化对比组织的选择[6,12-15]。本次研究均选取肌肉的纵切面,但ROI的大小与位置尚缺乏统一标准[6,11-14],因此所得结果有所差异。
EXL2/1的诊断灵敏度与RTE4分评级法相近,特异度却高于RTE4分评级法,这与其他学者研究成果相近。另外,评分法并没有对浅蓝色与深蓝色进行区分,EXL2/1却可以避免这种情况。但是由于不同公司的仪器使用公式的差异导致了应变指数有所差异,这又限制了弹性成像定量分析在临床的推广及应用。
3.3 普通超声与弹性超声对比
普通超声与弹性超声均诊断为阳性的淋巴结共69枚,其中病理结果阳性62枚,阴性7枚。7枚非转移性淋巴结中3枚位于侧颈部,4枚位于颌下区,体积偏小,呈近圆型,未见明显血流信号。弹性图像蓝色区域所占比例约50%~80%,评级为III级。由于颌下区及颈部生理弧度影响,获取弹性图像时除了手法上的偏差外还有一些不可避免的客观因素,所以获得的弹性图像有所误差。
普通超声诊断为阴性、弹性超声诊断为阳性淋巴结共30枚,其中病理结果阳性20枚,阴性10枚。当肿瘤细胞初期浸润淋巴结时,加以弹性超声辅助诊断,对于正确的诊断有很好的辅助作用。10枚非转移性淋巴结普通超声诊断为阴性,可能是由于某些良性病变病灶存在时间长,内部出现机化,结核淋巴结及瘢痕淋巴结等导致病灶硬度增加[11,16],从而使评分时出现假阳性结果。除了手法及颈部生理弧度等客观因素所导致的误差外,蓝色区域的深浅也是导致弹性成像出现假阳性的原因之一。
弹性超声诊断阴性、普通超声诊断阳性的淋巴结共8枚,其中病理结果阳性8枚,阴性0枚。普通超声中,8枚转移性淋巴结均为液化坏死型淋巴结,且液化范围较大。弹性图像中,多表现为红绿相间的彩色区域,评价为阴性。本次研究中,液化坏死淋巴结共14枚,弹性超声误诊的8枚液化坏死的淋巴结内,几乎均为无回声区;而余下6枚淋巴结表现为形态不规则的高回声区,内部可见少量液性暗区,蓝色区域所占比例>50%,弹性评价为阳性。所以当淋巴结液化坏死时,并不适用弹性超声诊断,只运用二维图像即可做出较可靠的诊断。
弹性超声与普通超声均诊断为阴性的淋巴结共52枚,病理结果阳性2枚,阴性50枚。2枚阳性淋巴结均来自于乳头状癌,弹性图像中,一枚表现为边缘少量弧形蓝色区域,其余为较均匀绿色区域,评级为I级;另一枚表现为全淋巴结较均匀的绿色区域,未见明显蓝色区域,评级为I级。可能与肿瘤细胞刚浸润皮质有关。另外,淋巴结为立体组织,由于肿瘤刚浸润淋巴结中的某一小部分,而此部分并未在所选取的最大切面中。所以,对于普通超声诊断为阴性的淋巴结,若弹性图像中边缘显示蓝色区域,应怀疑是否有转移的可能性。对于此类普通超声和弹性超声表现均不典型的转移性淋巴结,临床中可以通过穿刺活检来明确病理性质,但一般对于表现不典型的淋巴结,很少行穿刺活检,所以对于此类淋巴结的诊断还有待于进一步探索。
4 结论
在临床工作中,临床医师可根据普通超声的典型声像特征及多普勒超声的血流特点,对淋巴结的性质做出较为准确的诊断,但是对于不典型的病例仍然难以鉴别,此时可运用弹性超声,从淋巴结硬度方面进行评价。弹性超声虽然有较高的敏感性,但是也有一定的局限性,比如所选取的淋巴结不能靠近动脉、气管及骨骼等组织;需要加以练习才能取得较稳定的弹性图像;并不适用于大范围液化坏死型淋巴结的诊断。对于液化坏死型淋巴结,利用普通超声即可对其做出较为准确的诊断。RTE4分评级法是弹性图像的经典评价方法,但是在临床应用中也有一定的局限性,比如未描述蓝色区域的深浅之分,以及并未将蓝色区域所属淋巴结的部位考虑在内等。EXL2/1值在弹性评价中可以克服RTE分级的部分不足,具有较高的灵敏度、特异度、准确度,但也尚缺乏统一的标准,限制了其在临床的应用。对于弹性超声还有很多尚未统一及值得优化的区域,但其灵敏度较高,可以对非典型转移性淋巴结做出正确的诊断,综合分析超声检查的多项指标,更有利于有效地鉴别淋巴结的性质,为临床诊断和治疗及预后提供重要的参考价值。
[1] Iagnocco A,Kaloudi O,Perella C,et al.Ultrasound elastography assessment of skin involvement in systemic sclerosis:lights and shadows[J].J Rheumatol,2010,37(8):1688-1691.
[2] Teng DK,Wang H,Lin YQ,et al.Value of ultrasound elastography in assessment of enlarged cervical lymph nodes[J].Asian Pac J Cancer Prev,2012,13(5):2081-2085.
[3] Castelijns JA,van den Brekel MW.Imaging of lymphadenopathy in the neck[J].Eur Radiol,2002,12(4):727-738.
[4] Wu CH,Hsu MM,Chang YL,et al.Vascular pathology of malignant cervical lymphadenopathy:qualitative and quantitative assessment with power Doppler ultrasound[J].Cancer,1998,83(6): 1189-1196.
[5] Alam F,Naito K,Horiguchi J,et al.Accuracy of sonographic elastography in the differential diagnosis of enlarged cervical lymph nodes:comparison with conventional B-mode sonography[J].AJR Am J Roentgenol,2008,191(2):604-610.
[6] Lyshchik A,Higashi T,Asato R,et al.Cervical lymph node metastases:diagnosis at sonoelastography-initial experience[J].Radiology,2007,243:258-267.
[7] Ahuja A,Ying M.Sonography of neck lymph nodes.Part2: abnormal lymph nodes[J].Clin Radiol,2003,58(5):359-366.
[8] Ying M,Bhatia KS,Lee YP,et al.Review of ultrasonography of malignant neck nodes:greyscale, Doppler, contrast enhancement and elastography[J].Cancer Imaging,2014,13(4):658-669.
[9] Bhatia KS,Cho CC,Yuen YH,et al.Real-time qualitative ultrasound elastography of cervical lymph nodes in routie clinical practice: interobserver agreement and correlation with malignancy[J].Ultrasound Med Biol,2010,36(12):1990-1997.
[10] Ishibashi N,Yamagata K,Sasaki H,et al.Real-time tissue elastography for the diagnosis of lymph node metastasis in oral squamous cell carcinoma[J].Ultrasound Med Biol,2012,38(12): 389-395.
[11] Teng DK,Wang H,Lin YQ,et al.Value of ultrasound elastography in assessment of enlarged cervical lymph nodes[J].Asian Pac J Cancer Prev,2012,13(5):2081-2085.
[12] Ying L,Hou Y,Zheng HM,et al.Real-time elastography for the differentiation of benign and malignant superficial lymph nodes:a meta-analysis[J].Eur J Radiol,2012,81(10):2576-2584.
[13] Dudea SM,Botar-Jid C,Dumitriu D,et al.Differentiating benign from malignant superficial lymph nodes with sonoelastography[J].Med Ultrason,2013,15(2):132-139.
[14] Wojcinski S,Dupont J,Schmidt W,et al.Real-time ultrasound elastography in 180 axillary lymph nodes:elasticity distribution in healthy lymph nodes and prediction of breast cancer metastases[J].BMC Med Imaging,2012,12:35.
[15] Choi JJ,Kang BJ,Kim SH,et al.Role of sonographic elastography in the differential diagnosis of axillary lymph nodes in breast cancer[J].J Ultrasound Med,2011,30(4):429-436.
[16] 郭培杰,陈松旺,赵美丽.甲状腺癌颈部转移性与非转移性淋巴结的超声特征[J].中国医疗设备,2014,(6):169-172,139.
Application of Real-Time Ultrasound Elastography and Conventional B-Mode Ultrasonography in Diagnosis of Thyroid Carcinoma Metastatic Cervical Lymph Nodes
ZHENG Xuan, CHEN Song-wang
Department of Function, The First Affiliated Hospital of Nanjing Medical University, Nanjing Jiangsu 210000, China
ObjectiveTo discuss the effectiveness of application of real-time ultrasound elastography and conventional B-mode ultrasonography in diagnosis of thyroid carcinoma metastatic cervical lymph nodes.MethodsIn this retrospective study, 56 patients with thyroid carcinoma were examined by both conventional B-mode ultrasonography and real-time ultrasound elastography. B-Mode sonographic diagnosis was based on the total scores of fi ve criteria in order to identify lymph node metastases. In real-time ultrasound elastography, two methods were used to assess the lymph nodes, including the RTE4 method and EXL measurement. The the critical value of the EXL was calculated through the ROC (Receiver Operating Characteristic) curve. The combination of real-time ultrasound elastography and conventional B-mode ultrasonography was also used to diagnose the thyroid carcinoma metastatic cervical lymph nodes. Comparisons were made between the diagnostic results and postoperatively pathological results.ResultsSensitivity, specificity and accuracy of conventional B-mode ultrasonography were 76%, 90% and 82% respectively in comparison with elastography’s 89%, 75%, 83% and the combination diagnosis method’s 96%, 88%, 92%. The best critical value of EXL2/1 was 2.17. Sensitivity and speci fi city were both 88%. The area under the ROC was 0.91.ConclusionCombination of application of conventional B-mode ultrasonography and ultrasound elastography could improve the diagnosis of thyroid carcinoma metastatic cervical lymph nodes.
B-mode ultrasonography; ultrasound elastography; thyroid carcinoma; metastatic cervical lymph nodes
R445.1;R736.1
B
10.3969/j.issn.1674-1633.2015.06.011
1674-1633(2015)06-0050-05
2015-01-21
2015-05-24
陈松旺,主任医师,博士研究生,南京医科大学附属南京医院(南京市第一医院)功能科主任。
通讯作者邮箱:chensongwang@126.com

