超临界CO2萃取在植物化学物提取中的研究进展
汪 洋,李 焱*
(贵州大学 化学与化工学院,贵州 贵阳 550025)
超临界流体(supercritical fluid,SCF)是指介于液体和气体之间的特殊流体,兼具有液体和气体的双重物性[1]。超临界流体萃取(supercritical fluid extraction,SFE)就是利用处于临界温度和临界压力之上的SCF作为萃取剂从液体或固体中提取出特定的成分,该技术是一种新型的物质分离技术[2]。SFE同时具有精馏和液相萃取的特点,实现了萃取和分离过程一体化,使用的溶剂较少、方法简单,且节省能源。此外,低温萃取保留了天然有效成分(如易挥发性和热敏性物质)、又不引入其他溶剂,真正做到了被萃取物质的纯天然。目前,SCF有很多种,如二氧化碳(CO2)、氟氢烃、低分子烷烃、一氧化二氮(N2O)等,其中CO2具有不可燃、无毒、临界温度(31 ℃)接近室温等特点而被广泛运用。
植物化学物(phytochemicals,PC)是指由植物代谢产生的多种低分子质量的末端产物(次级植物代谢产物),并通过降解或合成产生不再对代谢过程起作用化合物的总称。在植物化学物中,除人们所熟悉的维生素E和胡萝卜素外,还包括多酚类、萜烯类、类黄酮、植物甾醇、植物雌激素、原花色素、皂苷以及一些生物碱等[3]。植物化学物的有效提取对提高功能性食品、类药剂营养品的质量和功能十分重要。传统的提取方法如回流法、煎煮法、浸渍法、渗漉法等在有效成分保留、去杂方面存在损失大、周期长、工序多、效率低等缺点。利用超临界CO2(supercritical carbon dioxide,SC-CO2)萃取可以有效地避免此类不足,SC-CO2萃取被广泛运用在植物化学物的提取实验中。本文对SC-CO2萃取植物化学物的研究进行了综述以便能够为该方面研究提供参考。探讨了SC-CO2萃取技术的原理,结合实例说明萃取温度、萃取压力以及夹带剂对萃取效果的影响,并针对超临界二氧化碳流体在植物化学物提取中的展望和存在问题进行了讨论,展望了该技术的应用前景。
1 SC-CO2萃取技术的原理
SC-CO2萃取分离过程的原理是利用SC-CO2对某些特殊天然产物具有特殊的溶解能力,且这种溶解能力与其密度有关,即利用压力和温度对SC-CO2溶解能力的影响而进行的。因此通过调节压力和温度,改变CO2溶剂的密度,进而增强CO2溶剂的溶解能力,提取目标物质,之后再通过减压、升温等操作实现萃取剂与目标物质的分离。临界点附近及超临界区域的压力和温度调控是获取高纯度目标物质的关键,萃取效率与被萃取物质的极性、分子质量大小、沸点等存在着密切的关系[4]。超临界流体与气体、液体的物理性质比较见表1。从表1可知,超临界流体兼有液体和气体的双重特性,扩散系数大,黏度小,渗透性好,与液体溶剂相比,可以更快地完成传质,达到平衡,促进高效分离过程的实现,CO2作为超临界流体更适合天然活性物质的提取。
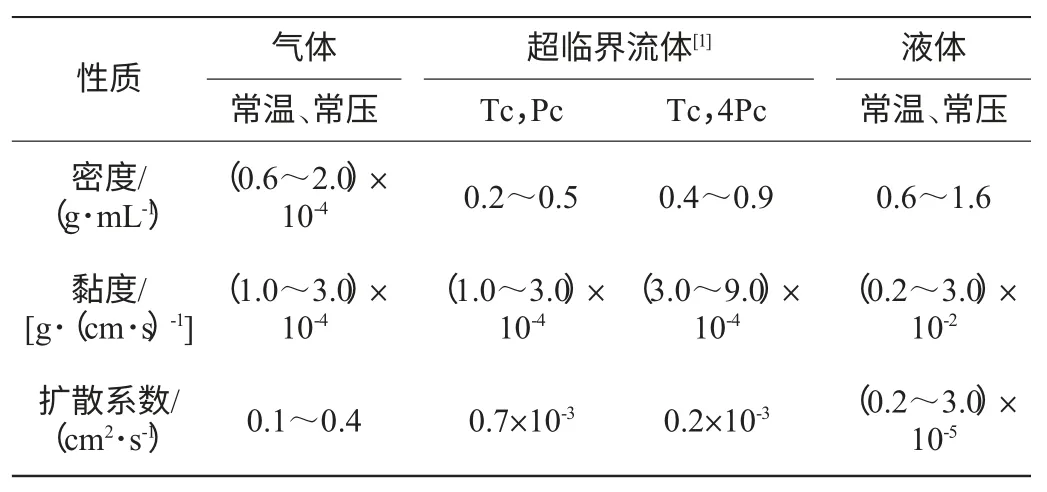
表1 超临界流体与液体、气体的性质比较[5]Table 1 Comparison of the properties of the supercritical fluid,liquid and gas
一般情况下,SC-CO2的密度增大,溶质的溶解能力也相应增大。尤其在接近临界点时,密度发生较小变化,往往会引起SC-CO2的溶解能力发生较大的变化。即温度和压力的微小变化,便会引起溶质的溶解度发生几个数量级的变化。在超临界状态下,将SC-CO2与待分离的组分接触,使其有选择性地将极性、沸点和分子质量不同的成分萃取出来。当然,各压力范围所得到的萃取物不可能是单一的,但可以控制条件得到最佳比例的混合成分,然后借助减压、升温的方法使SC-CO2变成普通的CO2,被萃取物质则完全或基本析出,从而达到分离提纯的目的,所以SC-CO2萃取过程是由萃取和分离组合而成的,其装置如图1所示。对于SC-CO2萃取技术,影响因素主要有萃取温度、压力、萃取时间、CO2流速以及夹带剂(常见的有甲醇、乙醇、氯仿等)的选择。其中选择适宜夹带剂可以有效的改善萃取效果。
与传统的萃取技术相比,SC-CO2萃取技术具有很大的优势:(1)萃取剂在常压常温下为气体,因此很容易与萃余相分离;(2)CO2在生理上是安全的;(3)便于调节,SC-CO2的溶解能力可以通过调节压力、温度以及引入夹带剂等来改变;(4)其基本的工艺方案很容易实现工业放大[6];(5)操作简单,萃取、分离一步到位;(6)SC-CO2价廉、易得,操作安全。

图1 SC-CO2萃取装置Fig.1 Equipment of SC-CO2extraction
2 SC-CO2萃取在植物化学物提取中运用
2.1 植物挥发油和精油的SC-CO2萃取
植物挥发油和精油为强亲脂性成分,主要由萜类和芳香族化合物等组成。该成分主要存在于杏仁、当归、姜黄、灵芝等药用植物的种子、根茎、叶花中,在医疗过程中充当活性物质。这些物质大都具有热敏性、沸点低、极性小,常见的蒸馏法由于温度较高,因而活性物质损失较大,SC-CO2萃取,因温度较低,可使活性物质得以完整保存。另外,由于SC-CO2的强亲脂性,使这些脂溶性成分可较快较彻底地被萃取分离,提取率较高。正因如此,SC-CO2萃取被广泛地运用在植物挥发油和精油的提取当中,有关研究实例见表2,表明SC-CO2萃取技术可以较好地应用于植物挥发油和精油分离提取。

表2 植物挥发油和精油的SC-CO2萃取实例Table 2 SC-CO2extraction instance of volatile oils and essential oils
2.2 植物黄酮类的SC-CO2萃取
黄酮类化合物是指基本母核为2-苯基色原酮的一类化合物,一般泛指具有两个苯环通过中间三碳相互联结(C6-C3-C6)而成的一类化学成分。其分子结构中有酮基,颜色常呈黄色,故有黄酮之称。由于取代基团的不同,形成了结构上的差异,使得黄酮类成分种类较多。在植物界分布较普遍,最集中于被子植物。黄酮类化合物的主要功能有抗菌消炎、降低血压、抗肿瘤等,由于化学结构上的特征,决定了大多数化合物具有生物活性[19]。在传统提取方法中常见的有碱法提取、醇提取、热水提取等。根据粗产品的性质选择适宜的提纯方法,如系统溶剂法、pH值梯度萃取法、硼酸络合法等。这些传统的提取方法存在明显的排污量大、有效成分损失多、成本高等一系列缺点。SC-CO2萃取对于黄酮类化合物是一种非常有效的提取方法。与传统方法相比,有流程短、效率高、萃取分离一步完成等优势。有关研究实例见表3,表明SC-CO2萃取技术可以较好地应用于植物黄酮类分离提取。

表3 黄酮类的SC-CO2萃取实例Table 3 SC-CO2extraction instance of flavonoids
2.3 生物碱的SC-CO2萃取
生物碱是中药有效成分中非常重要的一类,亦是人们在植物性药材中研究最早最多的一类成分。生物碱的定义还没有一个严格的表述,目前较常用的定义是:生物碱是指来源于生物的含氮的碱性有机化合物。然而,实际上生物碱并不包括氨基酸、肽类、蛋白质等含氮化合物,大部分生物碱的化学结构复杂,多含有复杂的含氮杂环结构,绝大多数具有显著的生物活性。从现有的研究情况来看,直接用SC-CO2萃取技术分离生物碱比较困难。因为生物碱类化合物大多数是与有机酸结合成盐存在于植物中,有些则与一些特殊的酸结合。为改善具体操作中的萃取、分离效果可加入适当的碱化剂和夹带剂。如从罗汉果中提取罗汉果甜苷V时,用纯CO2不能得到,而用乙醇作夹带剂就能得到。有关研究实例见表4,表明SC-CO2萃取技术可以较好地应用于生物碱的分离提取。

表4 生物碱的SC-CO2萃取实例Table 4 SC-CO2extraction instance of alkaloids
2.4 皂苷类的SC-CO2萃取
皂苷是以三萜或甾体为苷元的糖苷类化合物,广泛分布于自然界,是天然产物研究中的重要领域。传统溶剂提取皂苷存在周期长、溶剂残留、环境污染、不适合大规模工业生产等缺陷。皂苷作为分子和极性较大的天然产物,用超临界CO2萃取需要改变温度、压力等条件以及应用夹带剂(改性剂)进行。夹带剂是在纯的超临界流体中加入的一种少量的、可以与之混溶的、挥发性介于被分离组分与超临界组分之间的物质。夹带剂可以是某一种物质(如乙醇、水),也可以是两种或多种物质的混合物,它可影响溶质在超临界流体中的溶解度和选择性。皂苷作为极性成分,超临界CO2萃取往往选择含有乙醇的混合溶剂作为夹带剂。使用合适的表面活性剂在CO2中形成胶束或微乳液,能够增大皂苷等极性、亲水类物质的溶解度。目前超临界CO2萃取中应用的表面活性剂为含氟和含硅类表面活性剂,而不是传统的表面活性剂,但含氟和含硅类表面活性剂价格昂贵,故寻找和合成低成本、低毒性的表面活性剂正在进一步研究中。有关研究实例见表5,表明SC-CO2萃取技术可以较好地应用于植物皂苷类的分离提取。

表5 皂苷类的SC-CO2萃取实例Table 5 SC-CO2extraction instance of saponins
2.5 其他植物化合物组分的SC-CO2萃取
除上述研究之外,在植物甾醇、醌及其衍生物、酚类等有效成分的提取也得到一系列的研究。有关研究实例见表6,表明SC-CO2萃取技术可以较好地应用于其他植物化学物如植物甾醇、醌及其衍生物、酚类等的分离提取。

表6 其他植物化学物组分的SC-CO2萃取实例Table 6 SC-CO2extraction instance of other components
3 总结与展望
SC-CO2萃取与传统的溶剂提取法相比,具有适用范围广、对原料成分无破坏、对产品和环境无污染、提取效率高和操作方便等优点。在国外,特别是在日本,目前这一技术在生产方面得到广泛地应用。在国内,该技术在植物化学物提取方面的研究是继其成功运用于食品提取之后才逐渐开展起来的。其发展迅速,在短短几十年时间内,有关学者进行了大量的研究工作,获得了大量的积累,至今已对大量原料进行了实验室小试和近20个品种的中间放大实验,有些产品(如青蒿素、丹参酮等)和技术已经或即将走向工业化。然而,SC-CO2萃取技术同样具有自身的缺陷,由于CO2分子的极性小和分子质量低,所以SC-CO2流体对于许多强极性和高分子量的物质提取效果较弱。
目前在实验室已取得了大量的研究成果,然而要将这些成果转化成现实的生产力还有许多问题要解决。首先,为弥补SC-CO2萃取技术的不足,应考虑将其与其他分离手段和检测手段有效结合起来,使分离的质量更高,效果更佳。其次,对许多基础研究的工作有待加强,要力求能对获得目标成分的可能性程度进行良好的预测,设计出最优工艺流程。再者,在夹带剂使用方面还缺乏足够的理论方面的研究,可预测性差,主要靠实验摸索。因此,开展这方面的研究工作也具有重大的理论意义和使用价值。
[1]刘淑集,吴成业,苏永昌,等.超临界萃取技术在海洋水产的应用研究进展[J].福建水产,2013,35(5):402-406.
[2]武 剑,石绍伟,胡利娜.超临界CO2萃取技术在植物化学物提出中应用[J].食品研究与开发,2014,35(15):52-56.
[3]孙长颢.营养与食品卫生学[M].北京:人民卫生出版社,2008.
[4]白 亮,陶永清,肖传作,等.超临界CO2萃取天然产物的应用现状[J].中国酿造,2015,34(5):16-20.
[5]于娜娜,张丽坤,朱江兰,等.超临界流体萃取原理及应用[J].化工中间体,2011(8):38-35.
[6]宋照斌,郭清泉,宋启煌,等.超临界CO2萃取与低碳经济[J].广东化工,2011,38(214):1-2.
[7]戴 琳,单银花,王志祥,等.超临界CO2萃取玫瑰精油的工艺优化[J].食品工业科技,2015,36(3):266-269,274.
[8]刘亚娟,刘 芸,王志祥.超临界CO2萃取烟草精油的工艺研究[J].化学与生物工程,2014,31(6):59-63.
[9]陈建华,孙 伟,翁少伟,等.香桂桂皮精油的超临界CO2萃取及其GC-MS 分析[J].中国调味品,2013,38(9):107-111.
[10]黄秀锦,王海平,黄和升,等.十三香精油提取工艺研究[J].中国调味品,2013,38(2):53-55.
[11]PENG H,GUO Z D,ZHANG J C.Study on medicinal active constituents of fennel using SFE-CO2[J].Chinese Med J,2003,32(6):337-339.
[12]马玉花,赵 忠,李科友,等.超临界CO2流体萃取杏仁油工艺研究[J].农业工程学报,2007,23(4):272-275.
[13]GE F H,LI Y,XIE J M.Study on essential oil of Chaihu using SFE-CO2[J].Chinese Med J,2004,35(3):149-152.
[14]王丹清,王宏涛,吴大鹏,等.超临界CO2萃取分离桔油中的萜烯和含氧化合物[J].化学工程,2010,5(5):9-13.
[15]宋大巍,贾 建.超临界萃取生姜精油工艺研究[J].农产食品科技,2010,4(3):15-17.
[16]王 勇,杨卫丽,张 华,等.飞机草挥发油的超临界CO2萃取工艺[J].中国现代中药,2015,17(1):51-52.
[17]刘明石,催玮琪,金元宝,等.超临界CO2萃取沉香叶挥发油工艺条件优化研究[J].中国酿造,2014,33(2):63-65.
[18]黄景晟,张 帅,刘 飞,等.超临界CO2萃取陈皮挥发油及其化学成分分析[J].现代食品科技,2013,29(8):1961-1966.
[19]苏 航,陈 真,等.黄酮类物质改善认知功能障碍作用机制的研究[J].北方药学,2015,12(6):95-96.
[20]曾品涛,郑一敏,胥秀英,等.超临界CO2萃取麦冬中高异黄酮类物质的工艺研究[J].中国药业,2010,19(24):45-46.
[21]姚建国,蒋永红,周卯星,等.超临界CO2萃取丹参中的丹参酮[J].山西中医学院学报,2003,4(1):41-44.
[22]陈 瑛,孙兴力,王文渊.红薯叶中黄酮类化合物的超临界提取研究[J].广州化工,2011,39(6):82-84.
[23]林英男,时 伟.超临界CO2提取桑叶中总黄酮的工艺研究[J].齐鲁工业大学学报,2014,8(3):32-36.
[24]张诗静,史书龙,孙 琴,等.超临界CO2萃取赶黄草中黄酮类化合物的工艺研究[J].中成药,2013,35(9):2043-2047.
[25]ZHANG Z W,XIE M Y,WANG Y X,et al.Supercritical carbon dioxide fluid extraction of functional components fromMomordica charantiaL.fruits[J].Food Sci,2010,31(6):137-141.
[26]DENG Q H,GAO Y.Experiment on active constituents in gingkgo using the second SFE[J].Chinese Traditional and Herbal Drugs,2001,30(6):419-423.
[27]赵德胜,赵艳玲,王海峰.超临界CO2萃取甘草黄酮工艺的研究[J].江苏农业科学,2012,40(2):213-215.
[28]邓 祥,黄小梅,吴 狄.川佛手中总黄酮的超临界CO2萃取工艺的优化[J].重庆文理学院学报,2014,35(5):94-98.
[29]罗喜荣,苑天红,杨 军,等.瑞香狼毒总黄酮超临界CO2萃取工艺优化[J].湖北农业科学,2013,52(6):1404-1406.
[30]朱晓娜,曹伟伟,李明静.十二烷基苯磺酸钠-超临界二氧化碳萃取槐花总黄酮的工艺研究[J].化学研究,2012,23(2):73-77.
[31]么宏伟,谢晨阳,吴洪军,等.龙葵果总生物碱的提取研究[J].中国林副特产,2013(1):14-18.
[32]曾王旻,马奕颜,李巨秀.超临界CO2流体萃取燕麦麸皮中的生物碱[J].农产品加工·学刊,2012(1):73-76.
[33]蔡建国,张 涛,陈 岚.超临界CO2流体萃取博落回总生物碱的研究[J].中草药,2006,37(6):853-854.
[34]张 良,袁 瑜,李玉峰.CO2超临界萃取川贝母游离生物碱工艺研究[J].西华大学学报:自然科学版,2008,27(1):39-41.
[35]赵旭壮,郭维强,唐远谋,等.超临界CO2萃取茶叶中咖啡碱工艺研究[J].食品与发酵科技,2011,47(5):34-36.
[36]冯自立,陈德经,季晓辉,等.响应曲面分析法对青藤碱超临界CO2流体萃取条件的优化[J].计算机与应用化学,2010,27(7):928-932.
[37]耿中峰,吕惠生,张 敏,等.石蒜中加兰他敏的超临界CO2萃取工艺研究[J].中草药,2008,39(4):543-546.
[38]邓传波,夏延斌,邓洁红,等.超临界CO2流体萃取食用级辣椒碱研究[J].食品与机械,2012,28(3):135-138.
[39]阿依古丽·塔西,古丽克孜·阿日甫,李慕春,等.新疆辣椒中辣椒碱超临界CO2萃取工艺研究[J].亚太传统医药,2009,5(10):37-39.
[40]王立红,周丽莉,礼 彤.胡椒中胡椒碱超临界二氧化碳萃取工艺的优化[J].时珍国医国药,2008,19(7):1803-1804.
[41]刘 文,韩 笑,王学勇.超临界CO2萃取白芷中欧前胡素的研究[J].中国药学杂志,2003,38(2):99-100.
[42]黄 雪,冯光炷,雒廷亮,等.超临界CO2萃取三七总皂苷[J].精细化工,2008,25(3):238-242.
[43]邓楚津,聂芳红.超临界CO2萃取剑麻中总皂苷的工艺研究[J].食品研究与开发,2008,29(2):41-44.
[44]罗登林,罗 磊,刘建学,等.表面活性剂对超临界CO2萃取人参中皂苷的影响[J].农业工程学报,2009,25(增刊1):204-207.
[45]吴 彦,魏和平,陈红梅,等.超临界CO2萃取桔梗总皂苷的工艺研究[J].中国医药工业杂志,2010,41(2):103-105.
[46]钱国平,杨亦文,吴彩娟,等.超临界CO2从黄花蒿中提取青蒿素的研究[J].化工进展,2005,24(3):286-291.
[47]邢翠萍,汪春生,李长彪.超临界CO2从滇紫草中提取紫草素的研究[J].精细石油化工,2000(2):40-43.
[48]卢 智.超临界CO2流体萃取芦荟大黄素的研究[J].食品工程,2011(1):36-38.
[49]郑伟然,陶永华,苗宏伟,等.炮姜超临界CO2萃取6-姜酚的工艺研究[J].中草药,2011,42(10):2023-2025.
[50]赖锡湖,黄 卓,李 坚,等.超临界CO2萃取茶叶籽油及其成分分析[J].食品与机械,2011(2):38-40.
[51]高爱新,王舟莲,王敬文,等.超临界CO2萃取技术提取松花粉中植物甾醇的研究[J].食品科技,2010,35(4):208-210.
[52]张 怡,赵扬帆,郑宝东.超临界流体CO2萃取姬松茸酚类物质的研究[J].中国农学通报,2008,24(10):110-114.
[53]石冰洁,申家杰,张泽廷,等.超临界CO2萃取天然维生素E 的工艺研究[J].北京化工大学学报:自然科学版,2008,35(6):21-24.
[54]姚 忠.用超临界CO2浓缩α-生育酚的试验研究[J].江苏理工大学学报:自然科学版,1999,20(6):1-4.

