一株拮抗菌C-5的分离及鉴定
韦 露 陈 偿 龙云映 蔡奕明
(1.中国科学院 南海海洋研究所 广东省应用海洋生物学重点实验室, 广东 广州 510301; 2.中国科学院大学 北京 100049; 3.暨南大学 生命科学技术学院, 广东 广州 510632)
海地瓜(Acaudina molpadioidea)是属于海参纲(Holothuriodea), 芋参目(Molpadida), 尻参科(Caudinidae), 海地瓜属(Acaudina)[1]。其资源丰富, 广泛分布于中国沿海海域。海参养殖产业是沿海渔民增收致富和捕捞渔民转产转业的新途径, 受市场需求和利润的驱使, 养殖速度不断加快, 规模不断壮大, 密度过高,容易造成病害暴发。弧菌(Vibrio)是危害水产养殖动物的主要病原菌[2], 目前, 生产中防治细菌性疾病常用的方法是使用抗生素, 而大量抗生素的施用会导致药物残留和耐药菌株的出现, 人们食用含抗生素残留的海鲜产品, 也会威胁健康, 这些负面效应日益引起人们的关注, 因此, 积极寻找抗生素的替代品显得尤为重要[3]。其中, 开发绿色环保的益生菌已成为国际上研究的热点[4-5]。
益生菌是一种活的微生物, 能够维持宿主肠道平衡、增强新陈代谢、促进生长发育、改善微生物生态调控, 从而提高宿主动物的健康水平、增强机体免疫力, 也被称为微生态调节剂[6]。Kozasa[7]首次将微生态制剂应用于水产上, 用从土壤中分离的芽孢杆菌(Bacillus toyoi)处理日本鳗鲡(Anguilla japonica),降低了爱德华氏菌引起的死亡, 从此益生菌的研究迅猛发展。目前, 潘雷等[8]已经报道, 饵料中添加益生菌可以改善大菱鲆(Scophthalmus maximus)幼鱼的肠道菌群以及显著提高了部分免疫指标; 张汉华等[9]研究指出, 益生菌可以对对虾养殖系统起到生态调控的效果; 邹文政等[10]发现, 从养殖水体中可以筛选出对大黄鱼(Pseudosciaena crocea)病原弧菌有明显拮抗作用的海洋细菌。
微生态制剂因其无毒、无残留、抗药性小、生态健康等特点成为近年来海水养殖的改良剂[11]。虽然市场上已有多种有益菌产品, 但是多数是国外进口或者陆源性菌株, 目前, 尚未有报道来源于地瓜参肠道的益生菌株生产微生态制剂。本研究目的是从健康的野生地瓜参肠道内分离筛选对病原弧菌具有拮抗作用的益生菌, 进一步在养殖生产中应用微生态制剂、控制疾病、改良水质、提高养殖动物存活率和免疫力等提供理论基础。
1 材料与方法
1.1 菌株
1.1.1 实验菌株
从地瓜参肠道共分离到81株细菌作为体外拮抗供试菌株。
1.1.2 病原性指示弧菌
副溶血弧菌(Vibrio parahaemolyticus)13150 (Vp13150)购自广东省疾病预防与控制中心(CDC), 为鱼类致病菌。
1.1.3 其他指示菌
枯草杆菌(Bacillus subtilis)、金黄色葡萄球菌(Staphylococcus aureus)、紫色杆菌(Chromobacterium.Violaceum) CV026、溶藻弧菌(Vibrio alginolyticus)(E167)、杀鲑气单胞菌(Aeromonas salmonicida)199(A.saL)和霍乱弧菌(Vibrio cholerae) 006, 解淀粉芽孢杆菌(L1) (Bacillus amyloliquefaciens)L1(解淀粉芽孢杆菌L1为事先经过拮抗实验没有拮抗性的细菌),均由本实验室保藏。上述所有菌株均用普通LB培养基, 30 ℃恒温培养。
1.2 实验方法
1.2.1 拮抗菌的筛选与抗菌谱测定
从地瓜参肠道分离到81株待测菌株, 参照文献[12]的琼脂扩散法进行测定, 以抑菌圈大小初步判定抑菌活性, 并将初筛得到的拮抗菌测定其对 7株病原指示菌的抑菌谱。
1.2.2 拮抗菌的鉴定
采用Biolog细菌鉴定系统, 进行菌株95种碳源利用的理化分析。以C-5总DNA为模板, 以通用引物(27F和1492R)对其16S rDNA进行PCR扩增[13],经测序后所得序列提交至NCBI进行Blast同源性比对, 确定其在系统进化中的位置, 进行分子鉴定。
1.2.3 拮抗菌C-5胞外产物对病原菌的抑菌作用
参照Sugita[14]的方法, 制备拮抗菌的胞外产物。以副溶血弧菌 Vp13150为病原指示菌, 以无拮抗性菌株 L1胞外产物作对照组, 加入等量 C-5无菌上清,同时做3个平行, 每隔2 h取样测定OD600, 绘制曲线。
1.2.4 卤虫安全性实验
根据 Goulden[15]的方法, 将过夜孵化 30只卤虫放入无菌海水, 运用12孔板, 加入 5个浓度梯度的细菌(C-5 和 Vp13150)至终浓度为 104、105、106、107、108cfu/mL, 不加细菌孔为对照组。所有处理需做 3个平行, 连续观察 3 d, 计算卤虫死亡率, 并采用寇氏法计算半致死浓度。

采用寇氏法(Karber氏法), lg LC50=XK-C∑[Pi+P(i+1)] , 式中:XK为最大剂量的对数;C为相邻剂量比值的对数;Pi、P(i+1)为各剂量组的死亡率。此时试验组对应的浓度LC50, 即为半致死剂量浓度。
1.2.5 药敏实验
采用常规的琼脂扩散(K-B)法, 对筛选得到的拮抗菌 C-5菌株进行 20种常用抗生素的敏感性测定,以抑菌圈直径大小作为敏感与耐药的判定指标[16]。
1.2.6 优化拮抗菌的生长条件
研究3个培养条件(pH、温度、NaCl质量分数)对拮抗菌C-5生长的影响。
温度: 10、20、25、30、37、45 ℃
pH值: 4.0、5.0、 6.0、 7.0、 8.0、 9.0、 10.0、 11.0
NaCl质量分数: 0%、1%、2%、3%、4%、5%
以上实验除了考察因素外, 发酵条件都是在接种量1%、30 ℃、200 r/min下培养24 h后, 取样测定各条件的OD600值, 以不接菌的LB培养基作空白对照。以培养温度、初始pH、NaCl质量分数为横坐标, OD600值为纵坐标绘制各自曲线[17]。
1.3 数据统计
实验数据采用Origin 8.1, SPSS17.0中的单因素方差分析(ONE-WAY ANVOA)进行统计分析, 均值采用Duncan法进行多重比较, 数据以平均值±标准差表示。
2 结果
2.1 拮抗菌的筛选与抗菌谱
先分离得到的 81株细菌, 再用打孔法筛选到 1株抑菌谱较广且对副溶血弧菌具有较强抑制作用的拮抗菌 C-5, 其抗菌谱结果见表1。结果显示, 除副溶血弧菌外, C-5对其余溶藻弧菌、杀鲑气单胞菌等病原菌有拮抗作用, 此外还能有效抑制临床的霍乱弧菌和紫色杆菌。从余下拮抗性较弱的80株中, 挑出一株L1作为后续试验的阴性对照菌。

表1 C-5和L1对7种指示菌的抗菌活性Tab.1 Antimicrobial activities of the bacterium C-5 and L1 towards 7 indicator bacteriums
2.2 拮抗菌C-5的鉴定
拮抗菌C-5的生理生化检测结果见表2, 菌株C-5菌落形态呈灰白色, 革兰氏阴性, 发酵葡萄糖、果糖、麦芽糖等多种糖类, 可利用柠檬酸盐, 不液化明胶等。

表2 C-5菌株的生化特征Tab.2 Biochemical analysis of isolated C-5
16S rDNA测序结果比对可知(图1), 其与霍氏肠杆菌(Enterobacter hormaechei)TMPSB-T10 (EU 047556.1)同源性99%。属于霍氏肠杆菌(Enterobacter hormaechei)中的成员, 此菌株在 NCBI上的登录号为 KJ660958, 依据鉴定结果并结合菌株号, 最后鉴定该拮抗菌C-5为肠杆菌属Enterobactersp.

图1 基于16S rDNA构建C-5的系统进化树Fig.1 Phylogenetic tree of C-5 base on 16S rDNA
2.3 拮抗菌 C-5的胞外产物对副溶血弧菌的抑菌作用
从图2可知, 实验组副溶血弧菌的生物量从0~4 h为迟缓期, 细菌几乎没有生长; 5~12 h为对数期, 细菌量急剧增长; 12~14 h为稳定期, 维持在一定水平; 16 h后为衰退期, 生物量逐渐下降; 对照组0~10 h一直稳定在较低水平, 至12 h后开始缓慢上升。
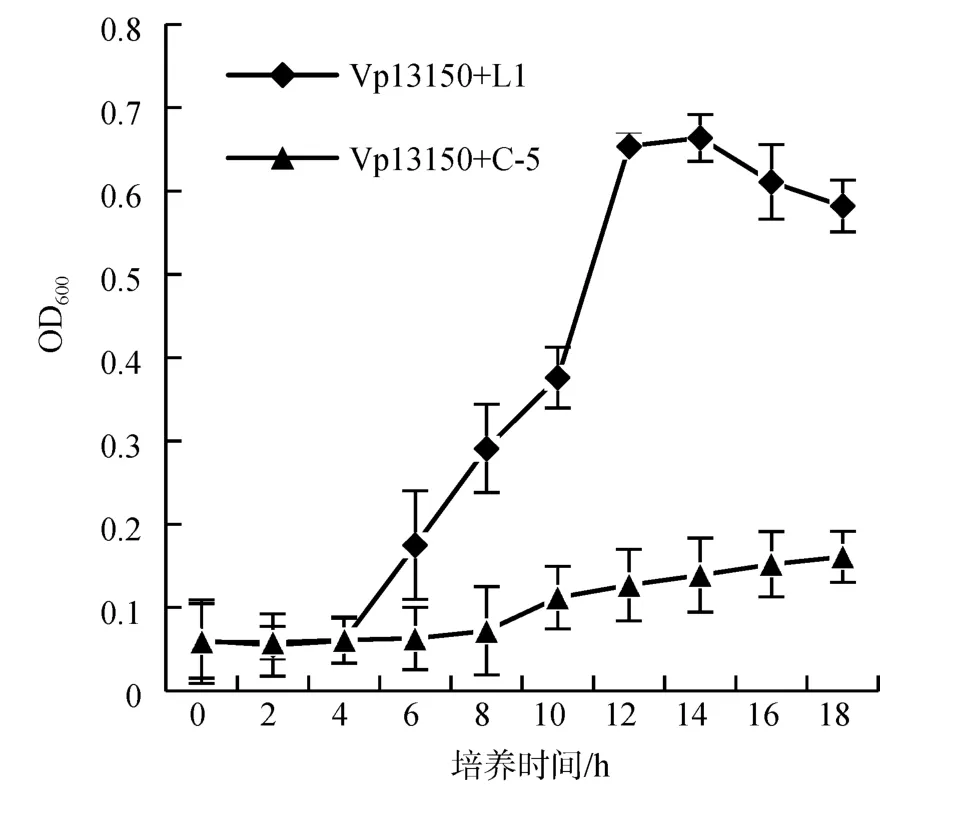
图2 拮抗菌C-5胞外产物对副溶血弧菌Vp13150的抑菌作用曲线Fig.2 Inhibitory curve of extracellular products of antagonistic bacterium C-5 against V. parahaemolyticus13150
2.4 卤虫毒性实验
半致死浓度(LC50)测定实验表明卤虫感染副溶血弧菌72 h后的LC50为105cfu/mL, 感染拮抗菌C-5的LC50为108cfu/mL。具体结果见表3。
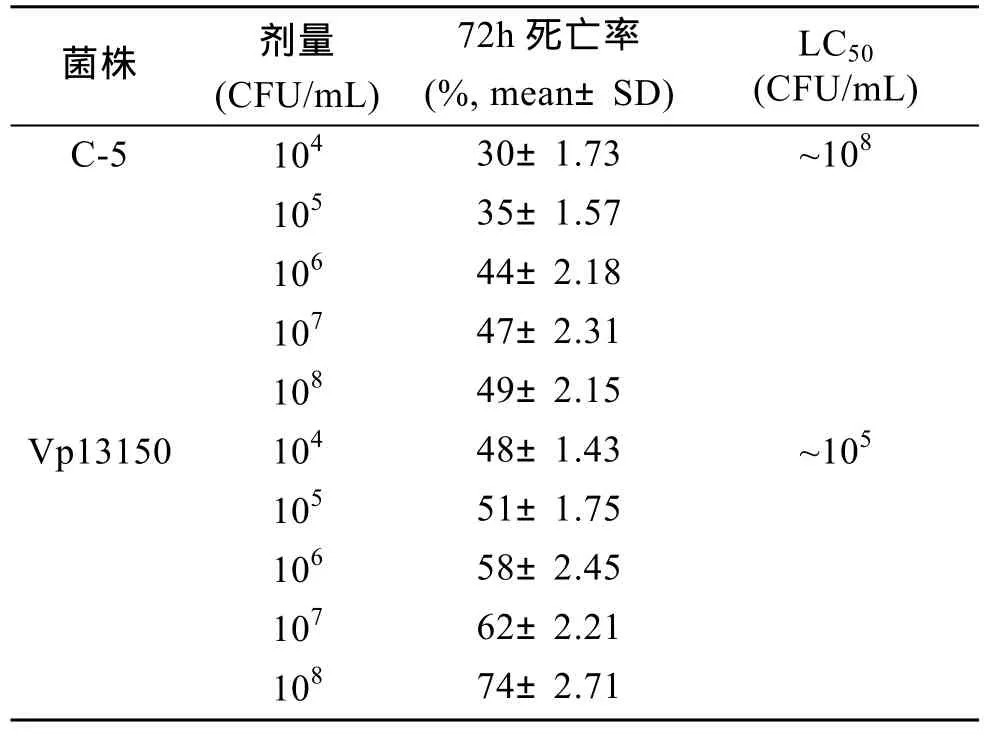
表3 不同浓度C-5和Vp13150条件下卤虫的死亡率Tab.3 Mortalities of Artemia nauplii with different doses of C-5 and Vp13150
2.5 药敏实验
供试的一株潜在益生菌C-5对20种抗生素类药物的敏感性实验结果见表4, 可见菌株C-5对15种抗生素均敏感, 仅对四环素、复方新诺明、诺氟沙星、头孢哌酮、氨苄西林5种抗生素产生耐药。

表4 菌株C-5药敏实验结果Tab.4 Results of antibiotic sensitive test of strain C-5
2.6 初步优化拮抗菌C-5的发酵条件
pH对拮抗菌 C-5生长的影响实验结果表明(图3), 菌株C-5的最适生长初始pH为7。初始pH范围为4~11时, C-5的OD600值随着pH的升高而增加, 当pH为7时, C-5的OD600值达到最大值1.503; pH大于7时, OD600值逐渐降低; 当pH过酸(pH=4、5)或者过碱(pH=10、11), 菌株C-5几乎不能生长。

图3 pH对菌株C-5生长的影响Fig.3 Effect of pH on the growth of strain C-5
温度对拮抗菌C-5生长的影响实验结果表明(图4),菌株C-5在20~40 ℃温度范围内均能生长, 其中C-5的最适生长温度为30 ℃。在20~30 ℃范围内, 随着培养温度的升高, C-5的OD600值逐渐增大, 在30 ℃时达到最大值 1.579; 当温度大于 30 ℃时, C-5的OD600值逐渐降低。当培养温度过低(10 ℃)或过高(45 ℃)时, C-5的OD600值最低, 几乎不生长。

图4 温度对菌株C-5生长的影响Fig.4 Effect of temperature on the growth of strain C-5
盐度对拮抗菌C-5生长的影响实验结果表明(图5),菌株C-5在0~5%盐度范围内均能生长, 其中C-5的最适生长盐度为2% NaCl。在0~5%范围内, 随着盐度的升高, C-5的OD600值逐渐增大, 在2%时达到最大值1.462; 当大于2%时, C-5的OD600值逐渐降低。
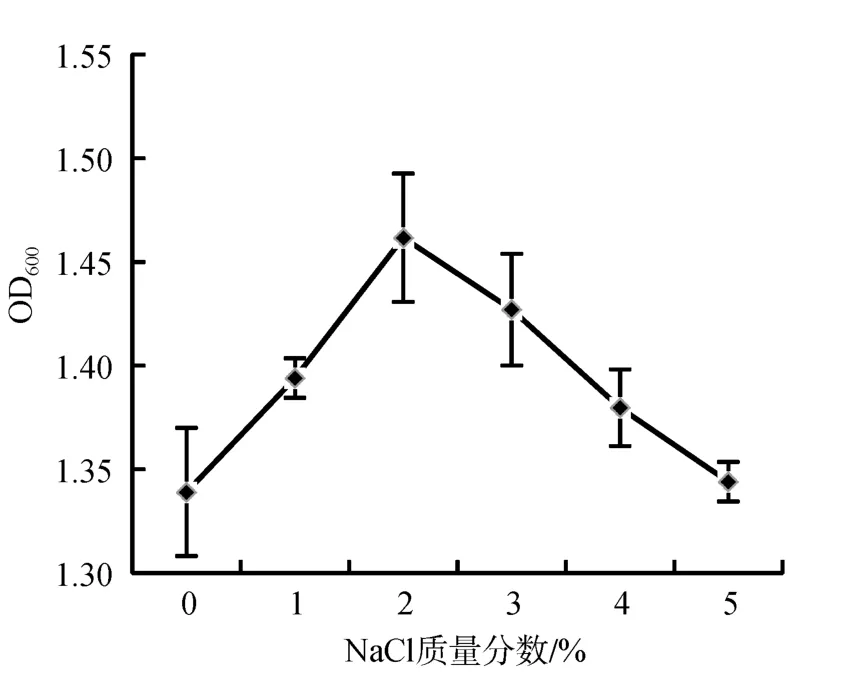
图5 盐度对菌株C-5生长的影响Fig.5 Effect of NaCl on the growth of strain C-5
3 讨论
海参肠道菌群是一个复杂的微生物群落, 其构成不但与海参种类和大小有关, 还受到外界环境因素, 如水体、饲料中微生物等的影响。一般认为, 海参肠道的优势菌群为革兰氏阴性菌, 如弧菌、假单胞菌属等[18]。肠道细菌在长期的进化过程中, 逐渐定植并繁殖, 形成固有菌群, 通过分泌抗菌物质抑制其他细菌的繁殖和生长[19]。作者从地瓜参肠道内分离弧菌拮抗菌, 扩大细菌的来源, 其作为土著微生物对于定植和繁殖并有效抑制病原菌有极大的优势。
目前, 微生态制剂的市场需求非常大, 可是其种类和功能却参差不齐, 在一定程度上影响了其市场前景。以海水养殖动物肠道和养殖环境作为来源的土著微生态制剂的开发和应用发展较为缓慢, 因此, 分离培养并研制土著微生物益生菌制剂意义重大[20]。近年来, 许多研究工作者都把重心放在分离乳酸菌上[21], 而本实验首次从地瓜参肠道分离出一株益生肠杆菌, 并从生理生化、分子生物学方面进行了鉴定, 确定为霍氏肠杆菌, 编号为 C-5, 为今后地瓜参池塘养殖微生态环境调控, 控制病害频发, 提供了优良的土著菌株, 具有广阔的开发应用潜力。
本实验对筛选到的益生菌 C-5做了基础的相关研究, 发现其抑菌谱广, 对副溶血弧菌、溶藻弧菌、杀鲑气单胞菌等有很强的拮抗作用, 表明其体外抑菌效果明显。拮抗菌 C-5发挥抑菌作用主要是其产生的胞外产物, 本实验表明, 在最初的 10 h能抑制部分病原副溶血弧菌, 10 h后病原菌的数量才开始上升, 这种现象可能是由于抑菌物质的活力随着时间和环境的改变而下降, 最终使得病原菌重新繁殖[22]。一般认为, 确保益生菌的安全性是其应用于水产养殖的前提, 而评价安全性一个最直接的方法是确定半致死浓度(LC50)[23]。本研究采用卤虫(Artemia)体外浸浴方法, 证实拮抗菌 C-5对养殖动物的活饵料卤虫是无毒的, 菌株 C-5对卤虫的 72 h LC50为 108cfu/mL。细菌的LC50≤103cfu/mL被认为是高致病性,而 LC50≥107cfu/mL被认为是无致病性的[24]。一般来说, 细菌产生抗菌物质的浓度与其生长条件密切相关, 如pH值、培养温度等[25]。本实验优化了C-5的生长条件, 其最适温度为30℃, 最适初始pH为7,最适生长盐度为 2%NaCl, 说明其发酵条件温和, 适合扩大培养。另外, 其抑菌成分主要分泌到胞外, 分离简单, 这些也为发酵工程奠定基础。
近年来, 养殖业病害频发, 如何更加有效地利用拮抗菌的抗菌作用来抑制病原菌、减少化学药物(抗生素类)的使用、降低水产品体内药物残留、保护生态环境、发展绿色经济产业、形成一个健康稳定的良性循环, 这是生物防治技术未来的发展方向。本实验针对地瓜参病原菌的拮抗微生物进行了较为基础的研究, 如何将筛选到的益生菌 C-5真正应用于水产养殖, 其定植模式、生长动力学、抑菌机理等还有待进一步研究。
[1] 廖玉麟.中国动物志: 棘皮动物门、海参纲[M].北京:科学出版社, 1997: 1-336.
[2] Gatesoupe F.The use of probiotics in aquaculture[J].Aquaculture, 1999, 180(1-2): 147-165.
[3] Balczar J L, Blas I D, Ruiz-Zarzuela I, et al.The role of probiotics in aquaculture[J].Veterinary Microbiology,2006, 114(2): 173-186.
[4] Cai Y, Benno Y, Nakase T, et al.Specific probiotic characterization ofWeissella hellenicaDS-12 isolated fromflounderintestine[J].Journal of General and Applied Microbiology, 1998, 44(5): 311-316.
[5] 刘文斌, 尹君, 方星星, 等.3种益生素配伍对异育银鲫生长、消化及肠道菌群组成的影响[J].海洋与湖沼,2007, 38(1): 29-35.
[6] 沈德中.污染环境的生物修复[M].北京: 化学工业出版社, 2002: 1-356.
[7] Kozasa M.Toyocerin (Bacillus toyoi) as growth promotor for animal feeding[J].Microbiologie Aliments Nutrition, 1986, 4: 121-135.
[8] 潘雷, 郭文, 高凤祥, 等.饵料中添加益生菌对大菱鲆幼鱼肠道菌群及部分免疫指标的影响[J].海洋科学, 2012, 36(2): 34-39.
[9] 张汉华, 李卓佳, 郭志勋, 等.益生菌对海水虾池浮游生物的生态调控效果研究[J].海洋科学, 2009,33(1): 12-20.
[10] 邹文政, 鄢庆枇, 林文雄, 等.大黄鱼病原弧菌拮抗菌筛选[J].海洋科学, 2004, 28(3): 5-9.
[11] 王亚敏, 王印庚.微生态制剂在水产养殖中的作用机理及应用研究进展[J].动物医学进展, 2008, 29(6):72-75.
[12] 马桂珍, 付泓润, 王淑芳, 等.海洋多黏类芽孢杆菌L1-9菌株生产抑菌物质发酵条件及其抑菌谱的研究[J].食品科学, 2012, 33(19): 231-235.
[13] Weisburg W G, Barns S M, Pelletier D A, et al.16s Ribosomal DNA amplification for phylogenetic study[J].Journal of Bacteriology, 1991, 173(2): 697-703.
[14] Sugita H, Hirose Y, Matsue N, et al.Production of antibacterial substance byBacillusspp.Strain NM12,an intestinal bacterium of Japanese coastal fish[J].Aquaculture, 1998, 165(3-4): 269-280.
[15] Goulden E F, Hall M R, Bourne D G, et al.Pathogenicity and infection cycle ofVibrio owensiiin larviculture of the ornate spiny lobster (Panulirus ornatus)[J].Applied and Environmental Microbiology,2012, 78(8): 2841-2849.
[16] 刘春, 李凯彬, 王庆, 等.杂交鳢(斑鳢♀×乌鳢♂)内脏类结节病病原菌的分离、鉴定与特性分析[J].水产学报, 2012, 36(7): 1119-1125.
[17] 曹海鹏, 杨先乐, 王玉洁, 等.鲟源致病性豚鼠气单胞菌的分离及其生长特性[J].动物学杂志, 2007,42(6): 1-6.
[18] 王轶南, 朱世伟, 常亚青.刺参肠道及养殖池塘菌群组成的PCR-DGGE指纹图谱分析[J], 渔业科学进展,2010, 31(3): 119-122.
[19] 陈营, 王福强, 王凡.牙鲆肠道内弧菌拮抗菌的分离与筛选[J].海洋科学, 2003, 27(3): 43-46.
[20] 佟伟, 张劲松, 孟凡义, 等.微生态制剂在池塘海参生态养殖中的应用[J].当代畜牧, 2014, 1(2): 88-90.
[21] Sugita H, Ohta K, Kuruma A, et al.An antibacterial effect ofLactococcus lactisisolated from the intestinal tract of the Amur catfish,Silurus asotusLinnaeus[J].Aquaculture Research, 2007, 38(9): 1002-1004.
[22] Ringo E, Gatesoupe F J.Lactic acid bacteria in fish: a review[J].Aquaculture, 1998, 160(3-4): 177-203.
[23] 曹海鹏, 何珊, 王会聪, 等.我国水产拮抗芽孢杆菌的研究进展[J].食品科学, 2012, 33(9): 314-318.
[24] Vinoj G, Vaseeharan B, DavidJayaseelan B, et al.Inhibitory effects ofBacillus licheniformis(DAB1) andPseudomonas aeruginosa(DAP1) againstVibrio parahaemolyticusisolated fromFenneropenaeus indicus[J].Aquaculture International, 2013, 21(5): 1121-1135.
[25] 莫照兰, 俞勇, 李会荣, 等.弧菌拮抗菌的筛选[J].青岛海洋大学学报, 2001, 31(2): 225-231.

