K 2 SiO3 促进梭梭生长并增强其抗旱性
康建军,赵文智,岳利军,赵 明,郑 颖
(1.中国科学院寒区旱区环境与工程研究所内陆河流域生态水文重点实验室,甘肃 兰州730020;2.甘肃省林业科学研究院,甘肃 兰州730020;3.兰州大学草地农业科技学院 草地农业生态系统国家重点实验室,甘肃 兰州730020)
多浆旱生植物梭梭(Haloxylon ammodendron)和霸王(Zygophyllum xanthoxylum)是广泛分布于我国西北干旱荒漠区的重要资源,集防风固沙、水土保持、牧草及药材等用途于一身,由于经过了长期的自然选择和适生进化,具有了顽强的生命力和对干旱环境的良好适应性[1-2]。
硅(Si)是自然界中仅次于氧(O)的第2 大营养元素,与钠(Na)、铝(Al)、钴(Co)和铯(Se)被称为植物生长发育的五大有益元素,几乎所有的植物体内都含有硅[3-5]。Si 对植物有益作用的研究主要集中在重要的粮食作物如水稻(Oryza sativa)、小麦(Triticum aestivum)、玉米(Zea mays)及高粱(Sorghum bicolor)等和瓜果蔬菜类等经济作物如黄瓜(Cucumis sativus)和甜瓜(C. melo),研究内容包括了Si 在这些作物矿质营养的吸收利用、生长发育、产量品质和生物及非生物胁迫耐受性等方面的作用和影响[6-8]。Si 在增强植物抗旱性方面起着十分重要的作用。起初的研究认为,Si 能积淀在植物叶片细胞壁上并通过参与表皮组织角质-双硅层结构的形成,降低叶片气孔的蒸腾作用,减少叶片水分或水汽的散失,使植物保持较高的水分利用效率来提高植物的抗旱能性[9-10]。随着Si 营养研究的深入,发现进入植物体内的Si 并非只是通过沉积在细胞壁上起支持和保护作用,还通过调节植物的矿质营养、光合、呼吸作用等生理生化活动,增强植物的抗旱能力[11-12]。在干旱条件下,Si 增强植物抗旱作用的生理机制在于施Si 增强了植株体内活性氧的清除能力,调节体内活性氧产生与清除机制的平衡性,减轻干旱胁迫下活性氧对蛋白质、脂类和其他细胞成分等的氧化损伤[9,13]。黄德华和陈佐忠[14]对内蒙古荒漠草原37 种植物N、Si 与灰分含量特征的研究表明,荒漠植物对土壤矿质营养元素的吸收积累能力要大大高于典型草原区,并且植物平均含Si 量(1.02%)比典型草原区(0.619%)高64.8%,但平均含氮量(2.16%)要显著低于典型草原区,这或许说明Si 在增强荒漠植物抗旱性中起着十分重要的作用。
目前关于Si、Na 和Si 互作促进荒漠植物生长及提高其抗旱性的系统研究较少,特别是Si 在多浆旱生植物适应干旱环境的作用机制方面还未见报道。因此,本研究以梭梭为材料,解析Si 在梭梭适应干旱环境中的作用及对其抗旱性的影响,以期为探讨Si 及Na 和Si 互作在荒漠植物适应干旱环境的作用机制及分子基础研究奠定理论依据,并为我国荒漠区的农牧业生产和生态环境的保护和恢复提供理论基础。
1 材料与方法
1.1 材料
梭梭种子于2013 年11 月上旬采自甘肃民勤国家野外科学观测研究站(38°34'28″ N,102 °59'05″E)。该站位于河西走廊东北部,石羊河流域下游,东、西、北三面被腾格里和巴丹吉林大沙漠包围,是我国典型的荒漠绿洲交错区之一。该区域年平均降水量和气温分别为110 mm 和7.6 ℃,年平均蒸发量为2 644 mm,年日照时数为3 073.5 h,无霜期162 d。
1.2 试验设计
1.2.1 适宜梭梭生长的最佳硅(K2SiO3)浓度的确定 梭梭种子于2013 年11 月采自甘肃民勤荒漠生态系统国家野外站,去除杂质后晾干并保存在4 ℃的冰箱中备用。2014 年4 月中旬,挑选籽粒饱满、无缺损的梭梭种子,用75%乙醇溶液浸泡1 min,然后用蒸馏水冲洗3 ~5 次,再在20 ~25 ℃下,用蒸馏水浸种催芽4 h 后移入装满培养基质蛭石的育苗盒中(长5 cm,宽5 cm,高10 cm),并浇灌调整过的1/2 Hoagland 营养液在温室中进行植物材料的培养。温室的昼夜温度为(28 ±2)℃/(23 ±2)℃,光照16 h/d,光强度约为600 μmol·m-2·s-1,相对湿度60% ~80%,幼苗生长4 周后,分别用含有0、5、15、25、50、75、100 和200 mmol·L-1K2SiO3(固体K2SiO3在蒸馏水中高温加热难以溶解,采用化学反应KOH 和H2SiO3高温加热来制取K2SiO3,待溶液冷却后,用1 mol·L-1的柠檬酸调节pH 值为7)的Hoagland 营养液浇灌(0、10、30、50、100、150、200 和400 mmol·L-1KCl 为对照),每天递增50 mmol·L-1,终浓度后每2 d 换一次溶液,以保持K2SiO3和KCl 浓度的相对恒定,11 d 后测定相关指标。每个处理取8 个重复,每个重复两株。
1.2.2 渗透胁迫下硅(K2SiO3)在梭梭适应干旱环境中的作用 梭梭幼苗的培养同1.2.1。待幼苗生长4 周后,进行不同渗透势处理:分别用含有0、15 mmol·L-1K2SiO3(制取和pH 的调节同1.2.1)的1/2 Hoagland 营养液处理(0、30 mmol·L-1KCl 对照)。7 d 后,分别浇灌渗透势为- 0. 5(轻度)、-1.0(中度)和- 1. 5 MPa(重度)的聚乙二醇(PEG6000)溶液及0 和15 mmol·L-1K2SiO3的1/2 Hoagland 营养液(0、30 mmol·L-1KCl 为对照),每天递减-0. 5 MPa,以未进行渗透胁迫作为对照。每2 d 更换一次处理液,7 d 后测定相关指标,每个处理取8 个重复,每个重复两株。
1.3 测定指标
1.3.1 株高、分枝数及死亡数的测定 用直尺量取株高,分枝数从根颈处记录各处理的枝条数,仅记录1 至2 级分枝数。死亡(萎蔫)数采用计数法统计。
1.3.2 鲜重、干重及含水量的测定 挖出整株梭梭幼苗后,用蒸馏水冲洗2 ~3 次后,用吸水纸吸干表面水分,迅速分成根系和地上部分,再把根系放入浓度为0.02 mol·L-1的CaCl2溶液中浸泡交换出根系自由空间中的离子,然后用蒸馏水反复冲洗,吸干表面水分后称鲜重(FW);称重后将鲜材料放置于105 ℃的烘箱中杀青10 ~15 min 后,放置于80 ℃烘箱中烘干至恒重,称其干重(DW)。
含水量=(鲜重-干重)/干重×100%[15]。
1.3.3 Si 和K+含量的测定 梭梭体内K+含量的测定参考Kang 等[16]的方法。分别取梭梭根、地上部干样0.1 g 捣碎后放入20 mL 试管中,加入100 mmol·L-1的冰乙酸10 mL,置于90 ℃沸水中水浴2 h,冷却,过滤,稀释适当倍数后,在火焰光度计(2655-00)上测定K+含量。梭梭体内Si 含量的测定采用比色法,参考康建军等[17]的方法。
1.3.4 丙二醛(MDA)测定 丙二醛是膜质过氧化最重要的产物之一,可以通过测定丙二醛含量的变化来了解膜质过氧化程度,判断膜系统受损程度以及植物的抗逆性。丙二醛在高温或者酸性环境下可与2-硫代巴比妥酸(TBA)反应生成红棕色产物三甲川,该物质在532 nm 处达到吸收高峰,在600 nm处有较小光吸收,从而采用硫代巴比妥酸(TBA)法测定其532 nm 的消光值来计算丙二醛的含量(可见分光光度计UV-2102PCS 测定)。
1.3.5 质膜透性测定 植物在各种逆境环境(干旱、低温、盐渍等)下会使质膜受到不同程度的损伤,导致细胞膜透性增大,细胞内电解质外渗,外液电导率增大。用电导仪率法(DDS-ⅡA 型电导率仪)测定植物质膜透性的变化,可作为植物抗逆性的生理指标之一。质膜透性的测定参考Gibon 等[18]的方法。
1.4 数据分析
试验所得的数据用SPSS 15. 0 (SPSS Inc.,USA)软件分析,用Excel 作图。
2 结果与分析
2.1 不同浓度的K 2SiO3 对梭梭生长的影响
2.1.1 不同浓度的K2SiO3对梭梭株高、分枝数及成活率的影响 不同浓度的K2SiO3处理(KCl 对照)对梭梭株高、分枝数及成活率产生不同的影响。外施一定浓度的K2SiO3对梭梭的生长有促进作用,其中以15 mmol·L-1K2SiO3和150 mmol·L-1KCl对梭梭生长的促进作用最大(图1)。与未施肥和30 mmol·L-1KCl 相比,15 mmol·L-1K2SiO3处理梭梭株高分别增加了20.2%和11.4%(df =15,F =389.29),分枝数分别增加了41.4%和21.6%(df=15,F=219.220)。25 mmol·L-1K2SiO3(50 mmol·L-1KCl 对照)对梭梭的生长有抑制作用,并且50 mmol·L-1以上的K2SiO3处理显著抑制了梭梭的生长。

图1 不同K 2 SiO3(KCl 为对照)对梭梭株高、分枝数及成活率的影响Fig.1 Plant height,branching numbers and survival rate under different K 2SiO3 treatments(KCl as control)

图2 不同K 2 SiO3 对梭梭鲜重、干重和含水量的影响Fig.2 Fresh weight,dry weight and water content under different K 2SiO3 treatments (KCl as control)
2.1.2 不同浓度的K2SiO3对梭梭鲜重、干重及含水量的影响 不同浓度的K2SiO3处理(KCl 对照)对梭梭生长产生不同的影响,其中以15 mmol·L-1K2SiO3和 150 mmol · L-1KCl 对 梭 梭鲜重、干重及含水量的促进作用最大(图2)。与未施肥和30 mmol·L-1KCl 相比,15 mmol·L-1K2SiO3处理梭梭鲜重分别增加了39.1%和14.5%(df=15,F=77.802),干重增加了65.3%和18.5%(df=15,F =1 009.141),含水量增加了35.2%和13.8%(df=15,F=17 936.960)。50 mmol·L-1及以上K2SiO3处理对梭梭鲜重、干重及含水量有明显的抑制作用。
2.2 不同浓度的K 2SiO3 对梭梭地上部、根系K+和Si 含量的影响
不同浓度的K2SiO3对梭梭地上部、根系K+和Si 含量均产生影响。随着K2SiO3浓度的不断增大,梭梭地上部和同化枝中K+和Si 含量呈不断增加的趋势(图3)。除0 处理外,与相对应浓度的KCl 相比,大部分施用K2SiO3的梭梭地上部和同化枝中K+含量均显著降低。与30 mmol·L-1KCl 相比,15 mmol·L-1K2SiO3处理梭梭地上部和同化枝中K+含量分别降低了116%和73.7%(df =20,F =1 171.286),株高和生物量则显著增加,说明适量的硅替代了K+促进了梭梭的生长(图1、2 和3)。尽管K2SiO3的施用使得地上部和同化枝中Si 含量显著增加,但是K2SiO3浓度超过25 mmol·L-1时梭梭的生长还是会受到明显的抑制(图1、2)。
2.3 不同渗透胁迫下,K 2SiO3 对梭梭生长的影响
不同渗透胁迫下,15 mmol·L-1K2SiO3(30 mmol·L-1KCl 对照)显著提高了梭梭的抗旱能力,使株高、鲜重和干重显著增加(P <0.05)(图4)。当渗透势分别为0、-0.5、-1 和-1.5 MPa 时,与未 施 肥 和30 mmol · L-1KCl 处 理 相 比,15 mmol·L-1K2SiO3处理梭梭株高分别增加了25.4%和11.3%,24.7%和10.1%,26.4%和13.8%,24.2%和12.9%(df =11,F =132.041)(图4);鲜重分别增加了41.8%和14.9%,43.6%和15.7%,52.7%和15. 0%,59. 3% 和20. 1% (df =11,F =8 228.874)(图4);干 重 分 别 增 加 了53. 2% 和18.0%,53.5% 和18.7%,46.6%和15.2%,51.9%和15.3%(df=11,F=418.237)(图4C)。
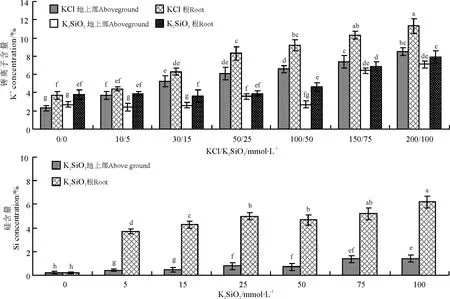
图3 不同K 2SiO3(KCl 为对照)对梭梭地上部、根系Si 和K +含量的影响Fig.3 Si and K concentration under different K 2 SiO3 treatments (KCl as control)

图4 不同渗透胁迫下15 mmol·L -1 K 2 SiO3 对梭梭株高、鲜重和干重的影响Fig.4 Effects of 15 mmol·L -1 K 2 SiO3 on plant height,fresh weight and dry weight under different osmotic stress
2.4 不同渗透胁迫下,K 2 SiO3 对梭梭丙二醛(MDA)和质膜透性的影响
除CK 外,与0 和30 mmol·L-1KCl 相比,15 mmol·L-1K2SiO3显著提高了梭梭的抗旱能力,使植株丙二醛含量和相对电导率大部分显著降低(图5)。当渗透势分别为-0.5、-1 和-1.5 MPa 时,与未 施 肥 和30 mmol·L-1KCl 处 理 相 比,15 mmol·L-1K2SiO3处理梭梭同化枝中丙二醛含量分别降低了26%和12%,32.8%和17.2%,31.3%和17.2%(df=11,F=123.425)(图5),同化枝中相对电导率分别降低了26.7%和13.3%,41.2%和23.5%,47.5%和25%(df=11,F=776.331)(图5)。

图5 不同渗透胁迫下15 mmol·L -1 K 2 SiO3 对梭梭丙二醛含量和质膜透性的影响Fig.5 Effects of 15 mmol·L -1 K 2 SiO3 on MDA and relative penetrability under different osmotic stress
3 讨论与结论
3.1 15 mmol·L-1 K 2 SiO3 显著促进了梭梭的生长
硅是绝大多数植物生长的矿质基质,并以单硅酸(H4SiO4)的形态存在于土壤中,或被吸附在土壤胶体的表面,位居大量营养元素氮、磷、钾、钙等之列,并且大大超过了土壤溶液中有效磷的浓度[3,19]。虽然大部分高等植物能大量吸收并积累硅元素,但硅不是必需元素。然而,硅对禾本科植物如水稻(Oryza sativa)和甘蔗(Saccharum officinarum)的生长具有明显的促进效应,并且已经证实硅是硅藻门、禾本科及木贼科等少部分植物生长的必需矿质元素,目前通常将硅纳为有益元素或者是农艺必需元素之列[3-4]。植物缺硅时生长停滞,叶片萎蔫或下垂,似“垂柳状”,施硅不仅可有效改善这些缺素症状,消除因缺硅而表现出的生长发育异常现象[20],而且可促进植物生殖器官的生长发育,促进作物成熟,增加作物产量[21]。施硅可改变植物叶片细胞壁的物理特性,提高叶片细胞壁的伸展性,促进植物叶片的生长[22]。施硅可以改善和调节植物的新陈代谢作用、促进植物生长发育和增强抗生物和非生物胁迫的能力,提高作物的产量和质量。Winslow等[23]的研究表明,施硅水稻在两年内平均产量几乎翻了一番,并且水稻叶片中的SiO2含量与稻谷的产量呈显著正相关关系。田间试验表明,以硅酸钙为硅肥的试验在增加甘蔗含糖量和产量以及提高雀麦(Bromus secalinus)结实率和种子产量方面也产生了显 著 效 果[6,20]。野 外 试 验 表 明,适 量 的 钠(0. 3 g·kg-1NaCl)或硅(0.2 g·kg-1H2SiO3)均能显著促进荒漠植物梭梭的生长,而且适量的钠硅互作(0.3 g·kg-1NaCl+0.1 g·kg-1H2SiO3)要比单独施用钠(0. 3 g·kg-1NaCl)或硅(0. 2 g·kg-1H2SiO3)能 更 有 效 地 促 进 梭 梭 的 生 长[17];0. 3 g·kg-1NaCl+0.72 g·kg-1Na2SiO3互作施用要比单独施用0.3 g·kg-1NaCl 能更有效地促进白刺(Nitraria sibirica)生长[24]。本研究结果表明,与相应KCl 对照相比,不同浓度的K2SiO3对梭梭的生长产生显著的影响(图1 和2)。外施一定浓度的K2SiO3(KCl 对照)对梭梭的生长有促进作用,并且15 mmol·L-1K2SiO3对梭梭株高、分枝数及生物量的促进作用最大(图1、2)。与未施肥和30 mmol·L-1KCl 相比,15 mmol·L-1K2SiO3处理梭梭株高、分枝数、鲜重、干重和含水量均显著增加。50 mmol·L-1以上K2SiO3浓度会明显抑制梭梭的生长。另外,与相应KCl 对照相比,梭梭生长的最佳KCl 浓度为150 mmol·L-1(图1 和2),从而排除了50 mmol·L-1K2SiO3显著抑制梭梭的生长的原因并非是由K+浓度过高所引起的。造成这种结果的原因可能由于较高浓度的Si 造成梭梭体内养分离子失调、能量平衡被打破以及有害物质积累等一系列的损伤,破坏了梭梭体内正常的生理代谢过程。
3.2 15 mmol·L-1 K 2SiO3 显著增强了梭梭的抗旱性
在干旱逆境下,植物可以通过渗透调节作为主要的生理适应机制来适应各种逆境环境。植物体内的渗透调节物质主要有无机离子(Na+、Ca2+、K+、Mg2+和Cl-等)和植物细胞自身合成的有机物质,如脯氨酸、甜菜碱及可溶性糖等[25-26]。植物在各种逆境环境下遭受损伤(或衰老)与活性氧积累和清除机制失衡而诱发的膜质过氧化作用密切相关,膜质过氧化产物丙二醛(MDA)是膜质过氧化最重要的产物之一,丙二醛的积累和质膜透性增大与植物的抗旱性呈显著负相关关系[27]。干旱胁迫下,植物通过增加渗透调节物质的含量作为有效的渗透调节剂来降低细胞水势,保持细胞的正常膨压,提高原生质的亲水性来维持生理生化过程的正常进行[28-29]。荒漠植物对干早胁迫下的生理反应和适应机制与其他植物不同,荒漠植物能够感应外界胁迫,并且能通过渗透调节、光和调节、抗氧化防御系统调节以及激素调节等一系列的生理生化机制使其在生理和形态上发生适应性反应,以提高植物在逆境胁迫下的抵抗能力[30-34]。Wang 等[31]研究发现,多浆旱生植物梭梭和霸王(Zygophyllum xanthoxylum)具有超强的适应干旱环境的能力,其适应干旱环境的有效策略是能够积累大量的Na+,而不是K+,并将其区域化到液泡中作为重要的渗透调节剂来适应干旱环境。控制试验证实,50 mmol·L-1Na+不仅对霸王生长有明显的促进作用[35],而且显著提高了霸王幼苗的光合活性和水分利用效率,减轻了渗透胁迫对霸王生长造成的损伤,提高了霸王的抗胁迫能力[26,36-37]。盆栽土培试验表明,荒漠植物梭梭和白刺能够吸收并积累大量钠(Na+)储存于液泡中作为有效的渗透调节剂外,还能吸收并积累适量的硅(SiO2)来适应干旱环境,并且适量的钠硅互作要比单独施用钠或硅更有效地促进梭梭和白刺的生长并提高其抗旱性[17,24]。研究表明,施硅使植物地上部表皮细胞形成的“角质-双硅层”结构具有抑制蒸腾的作用,从而减少植物对地上部水分的消耗,协调植物体内水分的平衡,在短期干旱时保证植物的正常生长[6,9-10,13]。本研究结果表明,与30 mmol·L-1KCl 对照相比,15 mmol·L-1K2SiO3对梭梭的生长及抗旱性产生显著的影响(图4 和5)。在-0.5、-1 和-1.5 MPa 下,与未施肥和30 mmol·L-1KCl处理相比,15 mmol·L-1K2SiO3显著提高了梭梭的抗旱能力,使植株株高、鲜重和干重显著增加(图4),植株体内丙二醛含量和相对电导率均显著降低(图5)。这说明,施硅有助于梭梭同化枝中维持较高的相对含水量和水势,降低渗透胁迫下同化枝中相对电导率和MDA 含量,提高了梭梭的抗旱性。该研究结果与宫海军等[38]和崔德杰等[39]在小麦上的研究结果相一致。目前,施硅及钠硅互作对荒漠植物生长及抗旱性的有益作用研究较少,特别是硅及钠硅互作如何增强荒漠植物抗旱性的生理作用和分子机制还有待于进一步的深入。
综上所述,与相应KCl 对照相比,外施一定浓度的K2SiO3对梭梭的生长有促进作用,其中15 mmol·L-1K2SiO3对梭梭的促进作用最大。不同渗透胁迫下,与30 mmol·L-1KCl 对照相比,15 mmol·L-1K2SiO3显著提高了梭梭的抗旱能力,降低了体内丙二醛含量和相对电导率,减轻了渗透胁迫对梭梭生长造成的伤害,进一步证实了硅(Si)在梭梭适应干旱环境中的重要作用。
4 展望
目前,硅在植物生长中的有益作用及其在提高植物抗逆性方面的应用是目前国际上的研究热点,现有的研究主要集中在硅对禾本科作物和某些瓜果类植物生长的有益作用,以及硅减缓植物Al、Mn 等重金属毒害,抗盐渍、干旱胁迫、温度逆境及辐射等方面,以下几个问题尚需探讨:1)大多数高等植物吸收和转运硅的作用机理、硅在植物体内的沉积机制以及能否移动性等问题有待深入研究;2)硅、钠硅互作促进荒漠植物生长及提高其抗旱性的系统研究,特别是硅增强多浆旱生植物抗旱性的作用机制研究很少;3)硅及钠硅互作影响荒漠植物形态结构、代谢及生理生化功能等尚不清楚,如干旱逆境下硅及钠硅互作是通过改变荒漠植物形态结构来增强抗旱性,还是通过调节体内的各种代谢和生理活动,起生理功能抗旱作用以及硅及钠硅互作增强荒漠植物抗旱性的分子机制还不清楚。
[1] 任继周.河西走廊山地-绿洲-荒漠复合系统及耦合[M].北京:科学出版社,2007.
[2] 周向睿,周志宇,吴彩霞.霸王繁殖特性的研究[J].草业科学,2006,23(6):38-42.
[3] Epstein E.The anomaly of silicon in plant biology[J].Proceedings of the National Academy of Sciences of the United States of America,1994,91(1):11-17.
[4] Epstein E.Silicon[J].Annual Review of Plant Physiology and Plant Molecular Biology,1999,50(1):641-664.
[5] Elizabeth A H P S,Colin F Q,Wiebke T,Mario M,Michela S.Physiological functions of beneficial elements[J].Current Opinion in Plant Biology,2009,12(3):267-274
[6] Lux A,Luxova M,Hattori T,Inanaga S,Sugimoto Y.Silicification in sorghum (Sorghum bicolor)cultivars with different drought tolerance[J].Physiologia Plantarum,2002,115(1):87-96.
[7] Ma J F,Yamaji N.Silicon uptake and accumulation in higher plants[J].Trends in Plant Science,2006,11(8):392-397.
[8] Marek V,Alexander L,Miroslava L,Eiichi T,Irene L.Silicon mitigates cadmium inhibitory effects in young maize plants[J].Environment and Experiment Botany,2009,67(1):52-58.
[9] Agarie S,Uchida H,Agata W,Kubota F,Kaufman P B. Effects of silicon on transpiration and leaf conductance in rice plants(Oryza sativa L.)[J].Plant Production Science,1998,1(2):89-95.
[10] 宫海军,陈坤明,陈国仓,王锁民,张承烈.硅对小麦生长及其抗氧化酶系统的影响[J].土壤通报,2003,34(1):55-57.
[11] Cherif M,Asselin A,Belanger R R.Defense responses induced by soluble silicon in cucurnber roots infected by Pythium spp[J].Phytopathology,1994,84(4):236-242.
[12] Watanabe S,Fujiwara T,Yoneyama T.Effect of silicon nutrition on metabolism and translocation of nutrients in rice plants[J].Developments in Plant and Soil Sciences,2001,92:174-175.
[13] Kim S G,Kim K W,Park E W,Choi D.Silicon-induced cell wall fortification of rice leaves:A possible cellular mechanism of enhanced host resistance to blast[J].Phytopathology,2002,92(10):1095-1103.
[14] 黄德华,陈佐忠.内蒙古荒漠草原37 种植物氮、硅与灰分含量的特征[J].植物学通报,1989,6(3):173-177.
[15] 段娇娇,康建军,于健龙,杨自辉,王锁民.钠复合肥培育白刺强旱生植株的研究[J].草业科学,2011,28(6):1019-1024.
[16] Kang J J,Duan J J,Wang S M,Zhao M,Li G Y,Yang Z H.Na compound fertilizer promotes growth and enhances drought resistance of the succulent xerophyte Haloxylon ammodendron[J].Soil Science and Plant Nutrition,2013,59:289-299.
[17] 康建军,王锁民,杨自辉.钠、硅及钠硅互作提高梭梭抗旱性的研究[J].中国沙漠,2012,32(3):793-800.
[18] Gibon Y M,Bessieres A,Larher F.Is glycine betaine a non-compatible solute in higher plants that do not accumulate it[J].Plant,Cell and Environment,1997,20(3):329-340.
[19] 夏石头,萧浪涛,彭克勤.高等植物中硅元素的生理效应及其在农业生产中的应用[J].植物生理学通讯,2001,37(4):356-360.
[20] 徐呈祥,刘兆普,刘友良.硅在植物中的生理功能[J].植物生理学通讯,2004,40(6):753-757.
[21] Inaraga S,Higuehi Y,Chishalei N.Effect of silicon application on reproductive growth of rice plant[J].Soil Science and Plant Nutrition,2002,48(3):341-345.
[22] Hossain M T,Mori R,Soga K,Wakabayashi S,Kamisaka S,Fujii R,Yamamoto T H.Growth promotion and an increase in cell wall extensibility by silicon in rice and some other Poaceae seedlings[J].Journal of Plant Research,2002,115(1):23-27.
[23] Winslow M D,Okada K,Vietoria C. Effect of silicon on deficiency and the adaptation of tropical rice ecotypes[J]. Plant and Soil,1997,188(2):239-248.
[24] 段娇娇,杨自辉,康建军,于建龙,王锁民.钠硅互作提高白刺抗旱性的研究[J].草业学报,2013,22(2):203-210.
[25] 赵可夫.植物对盐渍逆境的适应[J].生物学通报,2002,37(6):7-9.
[26] 蔡建一,马清,周向睿,张金林,王锁民.Na+在霸王适应渗透胁迫中的生理作用[J].草业学报,2011,20(1):89-95.
[27] 朱春云,赵越,刘霞,高崇辉,刘雅琳.锦鸡儿等旱生植物树种抗旱生理的研究[J].干旱区研究,1996,13(1):59-63.
[28] Xu S J,An L Z,Feng H Y,Wang X L,Li X R.The seasonal effects of water stress on Ammopiptanthus mongolicus in a desert environment[J].Journal of Arid Environments,2002,51:437-447.
[29] Morgan J M.Osmoregulation and water stress in higher plants[J].Annual Review of Plant Physiology,1984,35:299-319.
[30] 徐建华,于健龙,伍国强,张金林,王锁民. 钠复合肥增强荒漠区梭梭抗旱性的研究[J]. 草业科学,2011,28(6):1025-1029.
[31] Wang S M,Wan C G,Wang Y R,Chen H,Zhou Z Y,Fu H,Sosebee R E.The Characteristics of Na+,K+and free proline distribution in several drought-resistant plants of the Alxa Desert,China[J].Journal of Arid Environments,2004,56:525-539.
[32] Sergi M B,Lenonor A. Drought-induced changes in the redox state of alpha-tocopherol,ascorbate,and the diterpene carnosic acid in chloroplasts of labiatae species differing in carnosic acid contents[J].Plant Physiology,2003,131(4):1816-1825.
[33] Filella I,Liusia J,Piol J. Leaf gas exchange and the fluorescence of Phillg ralatifolia,Pistacia lentiscus and Quercusilex samplings in severe drought and high temperature conditions[J].Environmental and Experimental Botany,1998,39:213-219.
[34] Wu G Q,Xi J J,Wang Q,Bao A K,Ma Q,Zhang J L,Wang S M.The ZxNHX gene encoding tonoplast Na+/H+antiporter from the xerophyte Zygophyllum xanthoxylum plays important roles in response to salt and drought[J].Journal of Plant Physiology,2011:168(8):758-767.
[35] 李三相,周向睿,王锁民.Na+在植物中的有益作用[J].中国沙漠,2008,28(3):485-490.
[36] Ma Q,Yue L J,Zhang J L,Wu G Q,Bao A K,Wang S M.Sodium chloride improves photosynthesis and water status in the succulent xerophyte Zygophyllum xanthoxylum[J].Tree Physiology,2012,32(1):4-13.
[37] Yue L J,Li S X,Ma Q,Zhou X R,Wu G Q,Bao A K,Zhang J L,Wang S M.NaCl stimulates growth and alleviates water stress in the xerophyte Zygophyllum xanthoxylum[J].Journal of Arid Environments,2012,87:153-160.
[38] 宫海军,陈坤明,王锁民,张程烈.植物硅营养的研究进展[J].西北植物学报,2004,24(12):2385-2392.
[39] 崔德杰,高静,宋宏伟.施用硅钾肥对冬小麦抗旱性的影响[J].土壤肥料,2000(4):27-29.

