7个绵羊和7山羊品种DLX3基因3′非编码区803A>G突变的检测
古丽格娜,艾买提·买买提,於建国,杨会国,郝 耿,储明星,买买提明,潘章源,狄 冉,刘秋月
(1.新疆畜牧科学院畜牧研究所,新疆 乌鲁木齐 830000;2.中国农业科学院北京畜牧兽医研究所,农业部畜禽遗传资源与种质创新重点实验室,北京 100193;3.新疆畜牧厅南山种羊场,新疆 乌鲁木齐 830001)
7个绵羊和7山羊品种DLX3基因3′非编码区803A>G突变的检测
古丽格娜1,艾买提·买买提1,於建国1,杨会国1,郝 耿1,储明星2*,买买提明3,潘章源2,狄 冉2,刘秋月2
(1.新疆畜牧科学院畜牧研究所,新疆 乌鲁木齐 830000;2.中国农业科学院北京畜牧兽医研究所,农业部畜禽遗传资源与种质创新重点实验室,北京 100193;3.新疆畜牧厅南山种羊场,新疆 乌鲁木齐 830001)
DLX3基因3′非编码区803A>G突变与法国Lacaune绵羊高繁殖力密切相关座位FecL高度连锁。本研究采用PCR-SSCP方法在具有不同繁殖力的7个绵羊品种(湖羊、小尾寒羊、洼地绵羊、杜泊、陶赛特、特克塞尔、德国美利奴羊)和7个山羊品种(济宁青山羊、贵州白山羊、金堂黑山羊、成都麻羊、辽宁绒山羊、波尔山羊、安哥拉山羊)中检测DLX3基因803A>G突变,探究该突变与绵羊和山羊高繁殖力的关联性。结果表明这14个绵羊和山羊品种都不存在c.*803A>G突变,提示DLX3基因的c.*803A>G突变对这14个绵羊和山羊的繁殖力没有显著影响。
绵羊;山羊;繁殖力;DLX3基因;PCR-SSCP
同源盒基因(distal-less homeobox gene,DLX3)是同源异型框转录因子DLX家族中的一员,DLX3基因在哺乳动物的上皮组织、骨组织及胎盘发育过程中发挥重要作用。DLX3被定位于人17号染色体q21-22区域,它是Wnt信号通路的下游基因,能通过调控EGFR、蛋白激酶等信号通路影响绒毛滋养层细胞等细胞类型的生长分化(Chui等,2013)。
Bodin等(2002)对Lacaune绵羊后代的排卵数进行统计分析,发现其平均每次排卵6.5枚,其中超过6枚的个体占统计总数的38.4%,研究认为在Lacaune绵羊中存在影响其排卵数的主效基因。Bodin等(2003)将该基因命名为FecL基因,该基因被定位在绵羊第11号染色体的一个2.6cM区间内。Drouilhet等(2009)对绵羊高繁殖力主效基因FecL进行了精细定位,发现FecL位于BM17132和DLX3这两个分子标记之间,在此区间内,FecLL突变与其中一种特殊单倍型紧密连锁,此单倍型可根据DLX3基因3′UTR内的一个SNP(c.*803A>G)进行预测,该SNP能对携带和非携带FecLL突变的绵羊进行分类,准确率高达99.5%,因此这个突变位点可作为绵羊多羔性状的一个分子标记。
目前国内还未见分析绵羊和山羊DLX3基因3′UTR的特殊SNP位点与羊高繁殖力相关联方面的报道。本文以繁殖力存在差异(耿彩霞等,2011;王金鑫等,2013)的14个绵羊和山羊品种为实验材料,采用PCR-SSCP方法检测DLX3基因3′非编码区c.*803A>G突变在7个不同绵羊和7个不同山羊品种中的分布情况,试图寻找与绵、山羊繁殖力相关的遗传标记。
1 材料与方法
1.1 试验材料
选取7个绵羊品种(湖羊、小尾寒羊、洼地绵羊、杜泊、陶赛特、特克塞尔、德国美利奴羊)和7个山羊品种(济宁青山羊、贵州白山羊、金堂黑山羊、成都麻羊、辽宁绒山羊、波尔山羊、安哥拉山羊),每个品种随机抽取选择20只生产母羊,采集颈静脉血样10 mL/只,柠檬酸葡萄糖抗凝,-20℃冻存。用酚-氯仿法提取全基因组DNA,TE缓冲液-20℃保存。
1.2 试验方法
1.2.1 引物设计
根据GenBank公布的绵羊DLX3基因全长序列(FJ654646),利用Premier Primer 5.0和Oligo 7软件,在3′非编码区设计一对引物。引物序列:上游引物5′-CCCATGTACAGGACTTTGCAC-3′;下游引物5′-AGCTTACTGGAGGAGAGGAAG-3′。
1.2.2 PCR扩增
反应体系为20 μL,其中:Taq MIX 10 μL、上下游引物各0.5 μL、DNA模板(50 ng/μL)2.5 μL,去离子水6.5 μL。扩增条件:95℃5 min,95℃30 s,58℃30 s,72℃20 s,共34个循环;72℃延伸10 min;4℃保存。
1.2.3 SSCP分析
取PCR产物2 μL与变性剂7 μL混匀,98℃变性10 min,冰浴7 min。将变性后的PCR产物在12%非变性聚丙烯酰胺凝胶中常温电泳后进行银染,最后用凝胶成像仪拍照和分析。
1.2.4 测序
PCR产物经电泳鉴定后,用胶回收试剂盒(BBI,Canada)回收目标片段,纯化后交由北京华大生物技术有限公司用ABI PRISM 377 DNA自动测序仪进行序列测定。
2 结果与分析
2.1 羊DLX3基因的PCR扩增
DLX3基因片段的PCR产物经1.5%琼脂糖凝胶电泳检测显示扩增条带与预计片段大小 (167 bp)相符(图1),可直接进行SSCP分析。
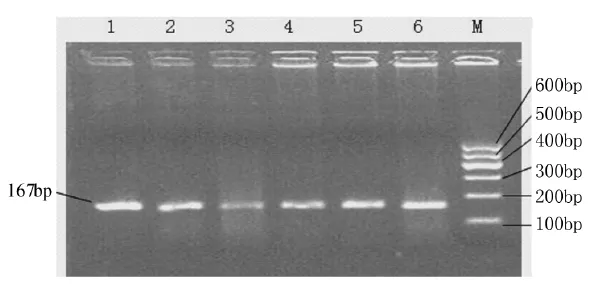
图1 绵羊和山羊DLX3基因的PCR扩增
2.2 扩增片段SSCP分析
对14个绵羊和山羊品种DLX3基因的扩增片段分别进行SSCP分析,发现所扩增片段均不存在多态性,以湖羊为例,聚丙烯酰胺凝胶结果见图2。
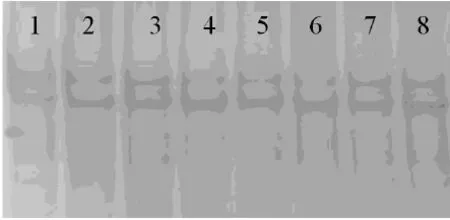
图2 DLX3基因扩增片段的SSCP分析(湖羊)
2.3 绵羊和山羊DLX3基因扩增序列比对分析
仅对小尾寒羊和济宁青山羊扩增区域进行了测序,获得序列片段大小均为167 bp;对测序序列进行比对分析后发现,小尾寒羊和济宁青山羊扩增区域均没有c.*803A>G多态突变。
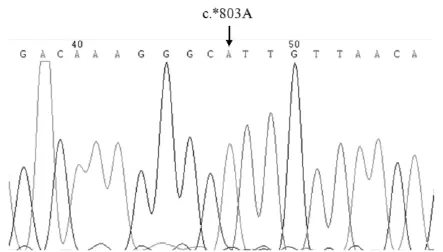
图3 DLX3基因3′非编码区c.*803处位点碱基
3 讨论
试验所选择的7个绵羊品种和7个山羊品种中,主要涵盖了国内外较高产羔率的绵羊品种:湖羊、小尾寒羊、洼地绵羊,较低产羔率的绵羊品种:杜泊、陶赛特、特克塞尔、德国美利奴羊;以及较高产羔率的山羊品种:济宁青山羊、贵州白山羊、金堂黑山羊,较低产羔率的山羊品种:辽宁绒山羊、安哥拉山羊、成都麻羊、波尔山羊。关于这些在繁殖力性状上存在差异的绵、山羊品种,已广泛地被研究者视为探究羊繁殖力分子机制的重要材料;目前,BMPR1B、BMP15和GDF9等基因的遗传多态性已多次在绵、山羊品种中被探索,且均未达到区分各品种羊繁殖力水平差异的研究目的。
FecL是Bodin等研究者在法国Lacaune绵羊群体中发现的多羔主效基因座位,FecL是遗传方式已知的多羔主效基因Lacaune的突变体(Bodin等,1998),FecL提高排卵数的效应与BMPR-IB相似,具有加性效应,杂合子增加排卵数1.0枚,纯合子增加排卵数2.0枚。Lecerf等(2002)通过基因扫描将Lacaune定位在绵羊11号常染色体上。Drouilhet等(2009)利用全基因组扫描对FecL进行精细定位,将区间缩小到BM17132和FAM117A两个标记之间,通过与人的同源区域比对,发现在这两个标记之间的20个同源基因没有任何一个属于BMP信号通路系统,而目前已发现确认的所有多羔基因都属于BMP家族,因此对FecLL突变进行基因定位有助于发现调控排卵数的新通路。Drouilhet等(2009)并没有将FecLL定位到特定基因,但他们却发现了一个非常有用的SNP,通过这个SNP可以将Lacaune绵羊分成L/L、L/+及+/+三种基因型。在精细定位获得的区间内,FecLL突变与其中一种特殊单倍型紧密连锁,此单倍型可以根据位于此区间边缘的DLX3基因的3’UTR内的一个SNP(c.*803A>G,终止密码子后第803个碱基)进行预测。它与FecLL突变高度连锁不平衡,这个突变以99.5%的准确性能够预测动物是否携带FecLL高产基因。同时研究者还发现在175只未携带FecLL突变的绵羊中有106只绵羊DLX3基因3′非编码区803 bp处为AA基因型,65只为AG基因型,4只为GG基因型,三种基因型产羔数的估计育种值分别为+1.25± 11.5、+19±11.7和+32.3±5.25。这一结果表明DLX3基因3′非编码区803G等位基因与高产羔数高度相关。Drouilhet等(2013)通过高通量测序技术,将FecLL进一步定位在胰岛素样生长因子ⅡmRNA结合蛋白(IGF2BP1)和β1,4-N-乙酰氨基半乳糖转移酶2(B4GALNT2)两个基因上,通过后续验证表明FecLL位于B4GALNT2基因上,B4GALNT2基因导致卵巢特异蛋白糖基化是调控绵羊排卵数的全新机制。而先前的结果表明FecL基因的突变以不同方式影响卵巢功能,与+/+型母羊相比,L/L型母羊颗粒细胞中FSHR和STAR mRNA水平较高,卵泡期有LH峰值出现,雌激素显著增加,黄体期孕酮的水平较高,而外周循环中FSH浓度在两基因型间差异不显著,垂体中L/L型母羊ESR2 mRNA的表达量显著低于+/+母羊(Drouilhet等,2010)。
本研究在小尾寒羊、济宁青山羊等14个绵羊和山羊品种中都未检测到DLX3基因3′非编码区c. *803A>G突变。究其原因,一方面可能此突变在绵羊和山羊品种中的频率较低,本研究分析的样本数过少导致未能检出该突变;另一方面,该突变可能不是影响本研究所选绵、山羊的繁殖力差异主要因素。本研究只是对DLX3部分序列多态性进行了初步分析,下一步还需要扩大样本数或对DLX3全基因序列开展多态筛查。
[1]耿彩霞,冯涛,储明星,等.绵羊GDF9基因FecTT突变检测[J].安徽农业大学学报,2011,38(3):341~345.
[2]王金鑫,冯涛,储明星,等.山羊生长分化因子9基因FecTT突变检测[J].中国畜牧兽医,2013,40(3): 123~126.
[3]Bodin L,Elsen J M,Poivey J P,et al.Hyper-prolificacy in the French Lacaune sheep breed:a possible major gene[C].In:Proceedings of the 6th World Congress on Genetics Applied to Livestock Production, Armidale,Australia.1998,(27):11~14.
[4]Bodin L,San Cristobal M,Lecerf F,et al.Segregation of a major gene influencing ovulation in progeny of Lacaune meat sheep[J].Genet Sel Evol,2002,34(4):447~464.
[5]Bodin L,Lecerf F,Pisselet C,et al.How many mutations are associated with increased ovulation rate and litter size in progeny of Lacaune meat sheep?[C].In:Proceedings of the International Workshop on Major Genes and QTL in Sheep and Goat,Toulouse,INRA,France.2003:2~11.
[6]Chui A,Kalionis B,Abumaree M,et al.Downstream targets of the homeobox gene DLX3 are differentially expressed in the placentae of pregnancies affected by human idiopathic fetal growth restriction[J].Mol Cell Endocrinol,2013,377(1-2):75~83.
[7]Drouilhet L,Lecerf F,Bodin L,et al.Fine mapping of the FecL locus influencing prolificacy in Lacaune sheep[J].Anim Genet,2009,40(6):804~812.
[8]Drouilhet L,Mansanet C,Sarry J,et al.The highly prolific phenotype of Lacaune sheep is associated with an ectopic expression of the B4GALNT2 gene within the ovary[J].PLoS Genetics,2013,9(9):e1003809.
[9]Drouilhet L,Taragnat C,Fontaine J,et al.Endocrine characterization of the reproductive axis in highly prolific Lacaune sheep homozygous for the FecLL mutation[J].Biol Reprod,2010,82(5):815~824.
[10]Lecerf F,Mulsant P,Elsen JM,et al.Localisation and mapping of a major gene controlling ovulation rate in Lacaune sheep[C].In:Procee dings of the 7th World Congress on Genetics Applied to Livestock Production.Montpellier:INRA,Castanet-Tolosan,France.2002,(30):753~756.
Detection on 803A>G Mutation in 3′Untranslated Region of DLX3 Gene in Sheep and Goats
Guligena1,AIMAITI·Maiti1,YU Jian-guo1,YANG Hui-guo1,HAO Geng1,CHU Ming-xing2*,Maimaitiming3, PAN Zhang-yuan2,DI Ran2,LIU Qiu-yue2
(1.Institute of Animal Science,Xinjiang Academy of Animal Sciences,Urumqi 830000,China;2.Key Laboratory of Farm Animal Genetic Resources and Germplasm Innovation of Ministry of Agriculture, Institute of Animal Science,Chinese Academy of Agricultural Sciences,Beijing 100193,China; 3.Nanshan Sheep Breeding Farm of Livestock Bureau of Xinjiang,Urumqi 830001,China)
Previous studies had shown that there was a strong linkage disequilibrium between DLX3 gene 3' noncoding region 803A>G mutation and FecL which was closely related with high fecundity of French Lacaune sheep.The 803A>G mutation of DLX3 gene was detected in seven sheep breeds (Small Tail Han, Hu,Wadi,Dorset,Texel,Dorper,Germany Mutton Merino sheep)and seven goat breeds(Jining Grey,Guizhou White,Jintang Black,Chengdu Ma,Liaoning Cashmere,Boer,Angora goats)using PCR-SSCP.The results indicated that the 803A>G mutation did not exist in the fourteen breeds tested.The 3′untranslated region of DLX3 gene was highly conserved among sheep and goats.The 803A>G mutation had no significant effect on prolificacy in the above fourteen breeds.
sheep;goat;prolificacy;DLX3 gene;PCR-SSCP
S818.9
:A
:1003-6377(2015)04-0015-05
新疆维吾尔自治区科技支疆项目(2013911056)、中国农业科学院科技创新工程(ASTIP-IAS13)和国家肉羊产业技术体系专项(CARS-39)资助
古丽格娜(1970-),女,副研究员,长期从事动物遗传育种与繁殖工作。E-mail:1289112072@qq.com
储明星(1968-),男,博士,研究员,博士生导师。从事动物遗传育种与繁殖工作。E-mail:mxchu@263.net
2015-04-16,
2015-05-03

