纳米氧化锌对小鼠B16黑素瘤细胞生长和分化的影响
周霞 许维岸 韩宏岩

摘要:为评价纳米氧化锌(nO NPs 在皮肤病治疗和化妆品应用方面的生理毒性,以小鼠B16黑素瘤细胞为细胞模型,研究15、30、90 nm下nO NPs对B16细胞的体外生长和分化的影响及其作用机制。以不加纳米氧化锌和加体相氧化锌的处理分别作阴性、阳性对照。结果表明,15、30 nm,体相nO NPs处理与B16 细胞共培养作用 3 d,当nO NPs 为 4 μg/mL以下时,nO NPs并未明显抑制细胞生长,引起细胞死亡;当nO NPs浓度大于8 μg/mL时,明显抑制细胞生长。随着nO NPs浓度增加,细胞体积变小,细胞间隙变大,黏附性降低,细胞变圆,从培养瓶底脱落死亡。nO NPs诱导细胞中酪氨酸酶(TYR、酪氨酸酶相关蛋白1(TYRP-1、酪氨酸相关酶相关蛋白2(TYRP-2的 mRNA 表达量升高,导致细胞内酪氨酸酶活性和黑色素生成水平增高,促进了B16黑素瘤细胞的分化。相同nO NPs浓度下,15 nm nO NPs比30、90 nm nO NPs作用明显。
关键词:纳米氧化锌;小鼠黑素瘤(B16细胞;酪氨酸酶;分化
中图分类号: R3292+5文献标志码: A
文章编号:1002-1302(201412-0322-04[HS][HT9SS]
收稿日期:2014-02-10
基金项目:国家自然科学基金(编号:81071306)。
作者简介:周霞( 1986—,女,安徽安庆人,硕士研究生, 研究方向为动物生化及分子生物学。E-mail:464354529@qqcom。
通信作者:许维岸。E-mail:xuweian1964@foxmailcom。
纳米氧化锌(nO NPs由于其独特性质,在化妆品和医药等领域被广泛应用,其安全性研究是纳米材料应用的前提和基础[1-2]。常规尺度的氧化锌毒性很低,研究表明,nO NPs 有较强的细胞毒性和体内毒性,如nO NPs 对上皮细饱和成纤维细胞有明显毒性,可对其造成活力丧失、膜损伤、氧化损伤、DNA损伤、炎症反应等[3-10]。nO NPs 对神经细胞的毒性也已得到证实[11-12],许多学者研究了nO NPs 对微生物的影响[13-17]。有研究发现,nO NPs 对多种细胞都有一定的毒性,但nO NPs 对细胞代谢影响的研究很少,尤其是对黑素瘤细胞的代谢影响的研究几乎没有。黑色素瘤是一种恶性皮肤肿瘤,近年来发病率逐年增加,尤其是35岁以下人群更易发病[18]。肿瘤分子生物学研究结果表明,恶性肿瘤的发生是一种细胞分化的紊乱,而B16黑色素瘤细胞是一种研究肿瘤细胞分化的良好模型。本研究探讨了nO NPs 对小鼠B16黑色素瘤细胞的体外细胞生长和分化的影响,初步探讨其作用机制,以期评价nO NPs 在皮肤疾病治疗和化妆品方面应用的安全性。
1材料与方法
11材料与试剂
nO NPs颗粒(15、30、90 nm nO购自安徽宣城晶瑞新材料有限公司。nO NPs 纯度均大于999%,为红锌矿晶型结构,广角X射线仪测定证实纳米粒径与产品说明书一致。Hepes、青霉素、链霉素、DMEM(上海生工生物工程有限公司、胎牛血清、胰蛋白酶、多巴和蘑菇酪氨酸酶(上海宝曼生物科技有限公司、实时荧光定量PCR试剂盒SYBR Premix Ex TaqTM(Perfect Real Time(TaaRa公司;其他试剂均为国产分析纯。
12方法
121nO NPs悬液的制备根据文献[19]中的方法略作改进。分别配制粒径15、30、90 nm、浓度1 g/L的nO NPs 悬液,搅拌均匀。进行超声处理,振幅80 mm/s,间隔时间2 s,每个样品超声时间15 min,之后用高压灭菌30 min。在加入细胞前,nO NPs 悬液还要在密封情况下用超声波清洗机超声15 min,用细胞培养液DMEM(不含血清配制所需浓度的nO NPs悬液。
122细胞培养将小鼠B16黑色素瘤细胞用含10%胎牛血清、025 mmol/L Hepes、100 U/mL青霉素、100 μg/mL链霉素的DMEM培养液于37 ℃、5%CO2培养箱中培养,待细胞长到70%~80%时,以025%胰蛋白酶消化传代或制成单细胞悬液计数分别接种于6、96孔孔板,放在CO2恒温培养箱培养。
123细胞形态观察将细胞计数调整到30 万个 /mL加入6孔的培养板中,每孔1 mL,外加1 mL完全培养液DMEM(含10%胎牛血清,待细胞贴壁12 h后弃原培养基加nO NPs,分别用含药物终浓度2、4、8、16 μg/mL的nO NPs 和不同尺寸的nO(15、30、90 nm,体相nO浓度为8 μg/mL与小鼠B16黑色素瘤细胞共培养2d后,以培养液为空白对照,在20倍倒置显微镜下观察并拍照。
124细胞活力对数生长期的小鼠B16黑色素瘤细胞,消化、计数,将细胞接种于96孔细胞培养板200 μL/孔,接种密度为1万 /mL。待细胞贴壁12 h后弃原培养基加待测药物,分别加入纳米或体相氧化锌,继续培养3 d,对照组不加药物。将细胞置于CO2孵箱继续培养3 d。药物处理结束4 h前,加5 g/L MTT 20μL/孔,继续置CO2孵箱培养4 h。吸去培养液,加入150 μL/孔 DMSO,充分振摇培养板,用酶标仪测定每孔吸光度(D490 nm,细胞抑制率=(1-药物处理组吸光度/空白对照组吸光度×100%。
125细胞内酪氨酸酶活性测定[20]将细胞计数调整到30万 /mL,加入到6孔培养板中,1 mL/孔,外加1 mL完全培养液DMEM(含10%胎牛血清,设3个复孔。待细胞贴壁 12 h 后弃原培养基加待测药物,以培养液为空白对照,培养 2 d。弃培养基,用1×PBS溶液润洗2次,加入1% TritonX-100 溶液100 μL/孔,迅速放入-80 ℃低温冰箱冻存 30 min。室温下融化,反复几次使细胞完全破裂。4 ℃、12 000 r/min 离心30 min,分别取上清液80 μL和L-DOPA溶液 20 μL 置于96孔板中,37 ℃反应1 h,在492 nm波长处用酶标仪测定吸光度。酪氨酸酶活性=药物处理组吸光度/空白对照组吸光度×100%。endprint
126黑素含量测定[21] 细胞培养和药物添加同“125”节,添加药物后,将培养板置于培养箱培养3 d后倾去培养基,用1×PBS润洗2次后加入1 mol/L NaOH 1 mL,置于 60 ℃ 水槽中温育1h。405 nm波长处用酶标仪测吸光度。黑色素含量=药物处理组吸光度/空白对照组吸光度×100%。
127Real-time PCR 测定酪氨酸酶及相关蛋白表达量[22] 细胞培养和药物添加同“125”节,药物添加后,37 ℃温育 2 d,弃上清培养液,用DEPC水处理的冷PBS清洗细胞2次。加入1 mL/孔 Total RNA Extractor(Trizol裂解液处理细胞,用TRIzol法提取总RNA,并通过逆转录试剂盒M-MuLV First Strand cDNA Synthesis it将mRNA转录为cDNA,按照 Real-time PCR试剂盒操作步骤进行荧光定量PCR。以GAPDH作为内参,酪氨酸酶(TYR、酪氨酸相关酶相关蛋白1(TYRP-1、酪氨酸相关酶相关蛋白2(TYRP-2水平依据CT值用2-ΔΔCT法进行计算。
128数据分析与处理用SPSS115软件进行数据分析与处理。
2结果与分析
21纳米氧化锌对B16细胞生长的影响
不同尺寸的8 μg/mL nO NPs对B16细胞的作用效果见图1。细胞抑制率大小顺序为15 nm nO NPs>30 nm nO NPs>90 nm nO NPs,表明在培养基中加入 8 μg/mL 纳米氧化锌,抑制了B16细胞的生长,其尺寸越小,对B16细胞生长的抑制作用越强,纳米氧化锌的抑制作用均大于相同浓度的体相氧化锌。
22纳米氧化锌对B16细胞形态的影响
由图2可以看出,nO NPs 粒径越小,其对B16 细胞生长的抑制作用越大,该抑制作用随纳米浓度的增加而增加。16 μg/mL 的 30 nm nO 作用细胞2 d后,大量细胞形态变圆,细胞死亡。[FL]
[FL(22]23纳米氧化锌对细胞内酪氨酸酶活性的影响
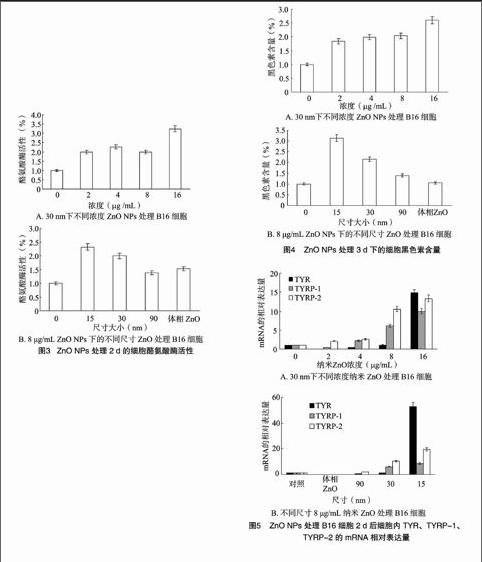
由图3-A可知,在30 nm尺寸下,随着纳米nO浓度逐渐增大,酪氨酸酶活性逐渐增强,nO NPs处理与对照差异极显著(P<001。由图3-B可知,在8 μg/mLnO NPs 下,随着纳米尺寸增大,酪氨酸酶活性逐渐减弱,不同纳米尺寸处理与对照差异极显著(P<001。说明nO NPs 作用B16 细胞时,其浓度越大或纳米尺寸越小,酪氨酸酶活性越强,促进B16 的分化作用越强。
24纳米氧化锌对细胞黑色素含量的影响
由图4-A可知,在30 nm尺寸下,随着nO NPs 浓度逐渐增大,黑色素含量逐渐增加,nO NPs处理与对照差异极显著(P<001。由图4-B可知,在8 μg/mLnO NPs 下,随着纳米尺寸增大,黑色素含量逐渐减少,不同纳米尺寸处理与对照差异极显著(P<001。说明nO NPs 作用B16 细胞时,nO浓度越大或纳米尺寸越小,都会刺激细胞产生更多的黑色素,促进B16 分化。该结果与酪氨酸酶活性变化一致。
25纳米氧化锌对TYR、TYRP-1、TYRP-2的mRNA表达量的影响
由图5可知,与对照相比,30 nm nO NPs 浓度高于 8 μg/mL 时,TYR、TYRP-1、TYRP-2的mRNA 表达量极显著增高 (P<001 。该结果与酪氨酸酶活性和黑色素含量的测定结果一致,说明纳米nO NPs 通过增加B16 细胞中TYR、TYRP-1、TYRP-2的mRNA 表达水平,引起细胞内酪氨酸酶活性增加,黑色素合成增加,B16黑素瘤细胞分化。
3结论与讨论
随着全球范围内纳米科技的发展,人造纳米颗粒的生物学效应越来越引起科学家的关注。 黑色素细胞是皮肤里的一种特殊细胞,它产生黑色素,传递给周围的角质形成细胞,皮肤颜色来自于角质形成细胞内存储的黑色素。与正常黑色素细[CM(25]胞相比,黑色素瘤细胞的黑色素合成能力低下。当诱导分[CM]
化时,黑色素生成能力明显增加。酪氨酸酶具有多巴氧化酶和酪氨酸羟化酶功能,是黑色素合成的限速酶。因此,B16细胞内的酪氨酸酶活性和黑色素含量是判断B16细胞能否分化的重要指标。本研究结果表明,当nO NPs浓度大于 8 μg/mL 时,抑制B16黑色瘤细胞生长,其浓度越大或纳米尺寸越小,对B16细胞生长的抑制作用越强。nO NPs 主要通过增加B16细胞中TYR、TYRP-1、 TYRP-2的mRNA 表达量来增加细胞内酪氨酸酶活性,影响黑色素形成,诱导细胞分化。该结论与细胞毒性效应与纳米尺寸和粒径大小密切相关的理论相一致,但有关纳米氧化锌的毒性机制仍须进一步研究。本研究结果可为纳米氧化锌在医药和化妆品行业的应用提供参考。
[HS2][HT85H]参考文献:[HT8SS]
[1][(#]Yang S T,Liu J H,Wang J,et al Cytotoxicity of zinc oxide nanoparticles:importance of microenvironment[J] Journal of Nanoscience and Nanotechnology,2010,10(12:8638-8645
[2]Lin W S,Xu Y,Huang C C,et al Toxicity of nano-and micro-sized nO particles in human lung epithelial cells[J] Journal of Nanoparticle Research,2009,11(1:25-39
[3]arlsson H L,Cronholm P,Gustafsson J,et al Copper oxide nanoparticles are highly toxic:a comparison between metal oxide nanoparticles and carbon nanotubes[J] Chemical Research in Toxicology,2008,21(9:1726-1732endprint
[4]Sharma V,Shukla R ,Saxena N,et al DNA damaging potential of zinc oxide nanoparticles in human epidermal cells[J] Toxicology Letters,2009,185(3:211-218
[5]Yang H,Liu C,Yang D F,et al Comparative study of cytotoxicity,oxidative stress and genotoxicity induced by four typical nanomaterials:the role of particle size,shape and composition[J] Journal of Applied Toxicology,2009,29(1:69-78
[6]Gojova A,Guo B,ota R S,et al Induction of inflammation in vascular endothelial cells by metal oxide nanoparticles:effect of particle composition[J] Environmental Health Perspectives,2007,115(3:403-409
[7]Brunner T J,Wick P,Manser P,et al In vitro cytotoxicity of oxide nanoparticles:comparison to asbestos,silica,and the effect of particle solubility[J] Environmental Science & Technology,2006,40(14:4374-4381
[8]Jia G,heng Y X Pay attention to the research on safety and health applications of nanomaterial[J] Chinese Journal of Preventive Medicine,2007,41(2:83-84
[9]Lai J C,Lai M B,Jandhyam S,et al Exposure to titanium dioxide and other metallic oxide nanoparticles induces cytotoxicity on human neural cells and fibroblasts[J] International Journal of Nanomedicine,2008,3(4:533-545
[10][(#]Jeng H A,Swanson J Toxicity of metal oxide nanoparticles in mammalian cells[J] Journal of Environmental Science and Health,2006,41(12:2699-2711
[11]Xia T,ovochich M,Liong M,et al Comparison of the mechanism of toxicity of zinc oxide and cerium oxide nanoparticles based on dissolution and oxidative stress properties[J] ACS Nano,2008,2(10:2121-2134
[12]Liu Y,Gao Y X,Wu G,et al The research progress of biological effect and toxicology of typical nanomaterials[J] Chinese Journal of Preventive Medicine,2007,41(2:,130-133
[13]Adams L ,Lyon D Y,Alvarez P J Comparative eco-toxicity of nanoscale TiO2,SiO2,and nO water suspensions[J] Water Research,2006,40(19:3527-3532[HJ175mm]
[14]Brayner R,Ferrari-Iliou R,Brivois N,et al Toxicological impact studies based on Escherichia coli bacteria in ultrafine nO nanoparticles colloidal medium[J] Nano Letters,2006,6(4:866-870
[15]hang L L,Jiang Y H,Ding Y L,et al Investigation into the antibacterial behaviour of suspensions of nO nanoparticles (nO nanofluids[J] Journal of Nanoparticle Research,2007,9(3:479-489
[16]Roselli M,Finamore A,Garaguso I,et al inc oxide protects cultured enterocytes from the damage induced by Escherichia coli[J] Journal of Nutrition,2003,133(12:4077-4082endprint
[17]Huang B,heng X,Yan D H,et al Toxicological effect of nO nanoparticles based on bacteria[J] Langmuir,2008,24(8:4140-4144
[18]Huang D,Ding Y,Li Y,et al Anti-tumor activity of a 3-oxo derivative of oleanolic acid[J] Cancer Letters,2006,233(2:289-296
[19]Carlson C,Hussain S M,Schrand A M,et al Unique cellular interaction of silver nanoparticles:size-dependent generation of reactive oxygen species[J] Journal of Physical Chemistry B,2008,112(43:13608-13619
[20]Chung S Y,Seo Y ,Park J M,et al Fermented rice bran downregulates MITF expression and leads to inhibition of alpha-MSH-induced melanogenesis in B16F1 melanoma[J] Bioscience Biotechnology and Biochemistry,2009,73(8:1704-1710
[21]Fujii T,Saito M Inhibitory effect of quercetin isolated from rose hip (Rosa canina L against melanogenesis by mouse melanoma cells[J] Journal of Dermatological Science,2009,73(9:1989-1993
[22]Matsuyama ,Villareal M O,el Omri A,et al Effect of tunisian Capparis spinosa L extract on melanogenesis in B16 murine melanoma cells[J] Journal of Natural Medicines,2009,63(4:468-472[HJ][FL]endprint

