肝硬化患者血清载脂蛋白A1 含量变化及意义
陈春刚
(贵州省瓮安县中医院检验科 贵州 瓮安 550400)
肝脏是脂类代谢的重要器官,其中血清载脂蛋白即脂蛋白中的蛋白部分,在脂蛋白代谢中发挥重要的生理意义。肝硬化会对肝脏功能造成损害,从而引发血清载脂蛋白的合成代谢混乱。近年来检测肝硬化患者血清A1 作为判断肝硬化病理是临床业界广泛研究的课题[1-2]对此,我院特选取部分肝硬化患者为研究对象,通过分析其血清载脂蛋白A1 含量变化对后续判断病情和治疗的意义,现报告如下:
1.资料和方法
1.1 一般资料
选取我院2013 年9 月~2014 年9 月收治的84 例肝硬化患者,将其分为肝硬化组(42 例)和对照组(42 例),其中肝硬化组有男性患者37例,女性患者47 例,年龄25 ~52 岁,平均年龄(36.0 ±2.2)岁。对照组男性34 例,女性患者50 例,年龄25 ~52 岁,平均年龄(32.0 ±2.6)岁。其中观察组所有患者均符合2000 年《病毒性肝炎防治方案》诊断标准。42例患者根据Child-Pugh 分级,A 级14 例,B 级13 例,C 级15 例。排除标准:肾功能不全、上消化道出血、冠心病、高血压、糖尿病、近期无服用调脂类药物和激素类药物及甲状腺疾病,两组患者年龄、性别等一般资料对比无意义(P >0.05),具有可比性。
1.2 方法
抽取患者清晨空腹静脉血5ml,采用自动生化分析仪(日本,CL -7200 型)测定肝硬化患者血清载脂蛋白A1 及肝功能等指标。
1.3 观察指标
观察血清载脂蛋白A1 和载脂蛋白B 与其他相关指标。
1.4 统计学分析
2.结果
2.1 肝硬化组和对照组血清生化指标检验结果比较
经测定,肝硬化A1 为0.81 ±0.54,对照组为1.36 ±0.61。观察组载脂蛋白B 为0.55 ±0.23,对照组为0.82 ±0.13。观察组Chol 为0.30 ±0.21,对照组为4.42 ±0.63。观察组TG 为0.94 ±0.41,对照组1.16 ±0.26,观察组胆红素为36.71 ±29.08,对照组为8.84 ±5.86,观察组清蛋白为31.08 ±5.73,对照组为42.77 ±5.22.,组间对比有意义(P <0.05),具体数据见表1.
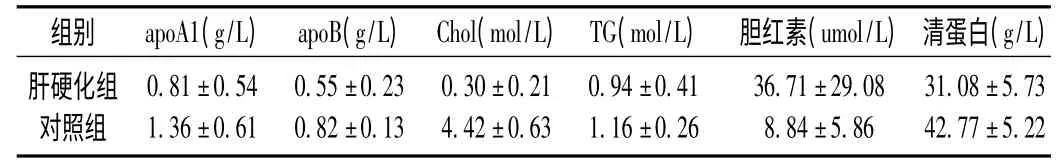
表1 肝硬化组和对照组血清生化指标检验结果比较
A1 水平与血清胆红素的浓度呈正相关(P <0.05),与清蛋白浓度降低呈正相关(P <0.05),但Chol、apoB、TG 与清蛋白、胆红素之间无任何关联(P >0.05),具体数据见表2.

表2 血清apoA1、apoB、Chol、TG 与清蛋白、胆红素比较
2.2 血清apoA1、apoB、Chol、TG 与清蛋白、胆红素比较
3.讨论
肝硬化临床表现多集中在以下方面:①消化道症状:食欲减退、肝源性糖尿病、腹胀、胃肠功能絮等。②全身症状:乏力、面色晦暗、下肢水肿、消瘦、尿少等。③内分泌障碍:男性乳房发育、女性月经失调、皮肤色素沉着、蜘蛛痣、腮腺重大等。④门脉高压:脾功能亢进、腹腔积液、腹壁静脉血张、食管-胃底静脉曲张、胸腔积液、门脉侧支循环建立等。⑤低蛋白血症:腹腔积液、双下肢水肿、肝源性胸腔积液、尿少。⑥贫血及出血倾向:贫血、鼻衄、紫癜、齿龈出血。而肝硬化的病理组织为肝细胞坏死,有广泛的残存细胞结节性再生,形成纤维隔和结缔组织,从而形成假小叶,破坏肝小叶结构,肝脏在此过程中逐渐变形和变硬,最后发展为肝硬化。部分肝硬化患者早期无明显症状和较强的肝脏代偿功能有关,后期的主要表现则为门脉高压和肝功能损害并累及多系统,晚期则开始出现癌变、肝性脑病、脾功能亢进、上消化道出血等并发症。引起肝硬化的病因分为酒精性肝硬化、病毒性肝硬化、胆汁淤积性肝硬化、代谢性肝硬化、毒物和药物性肝硬化、肝静脉回流受阻性肝硬化、隐源性肝硬化、代谢性肝硬化、自身免疫性肝硬化等[3]和酒精中毒、营养障碍、循环障碍、工业毒物或药物、代谢障碍、胆汁淤积、血吸虫病等有关,例如胆汁淤积,指肝外胆管阻塞时高浓度的丹红素会损害肝细胞,长期以往发展为肝硬化,肝内胆汁淤积称为原发胆汁肝硬化。
肝脏是脂肪与脂蛋白合成代谢的重要场所,该功能损害后会引起载脂蛋白的合成代谢絮乱。载脂蛋白主要位于脂蛋白表面,具体为氨基酸会将载脂蛋白以前后顺序的方式组合,把不同功能载脂蛋白输送人体中并发挥相应的生理功能作用。白A1 和和B100 是目前以发现将近20 多种载脂蛋白中临床应用测定最多的两类。目前以发现将近20 多种载脂蛋白,其中白A1 和B100 是临床应用测定最多的,这两种载脂蛋白合成的主要场所则为肝脏,由于肝硬化患者有不同程度的损害,一定程度上会减少载脂蛋白的合成。其中白A1 是高密度脂蛋白的主要组成部分,在肝脏内和肠内合成,主要功能未将机多于的胆固醇输送肝内并降解,之后活化卵磷脂胆固醇酰基转酶后使胆固醇转化成胆固醇脂。B100 主要由肝脏合成,当发生肝脏疾病时会减少合成,血清中的B100 水平明显降低。甲状腺素在肝功能正常时会刺激肝脏合成载脂蛋白,但在该阶段胰岛素和胰高血糖素会影响肝脏合成载脂蛋白。再加上大部分肝硬化患者有高胰岛素、高胰岛血糖素血症和低T3、T4 血症等,一定程度上会阻碍脂蛋白代谢连接载脂蛋白,再次影响肝脏合成载脂蛋白。此外,本文研究结果显示A1 水平与血清胆红素的浓度呈正相关,与清蛋白浓度降低呈正相关,但Chol、apoB、TG 与清蛋白、胆红素之间无任何关联。而肝硬化时肝细胞表面脂蛋白受体功能受损,对载脂蛋白APOB100 的作用除上述影响外尚有降解减少。我们推测,在肝硬化肝功能受损早期,以合成障碍为主,所以血清载脂蛋白A1 会显著下降。研究结果还显示,肝硬化组患者血清A1、B100、Chol、TC 水平明显在肝脏出现疾病时低于对照组,由此可提示当肝实质细胞发生病变时,上述指标都会有不同程度的下降[4]-降机制主要有以下几点:①肝功能降低时会使A1 前体转化为A1 的转移酶合成减少,进而降低血清A1 水平。②由于A1 只有在和肝脏蛋白结合后才转运到外周血,但对于肝硬化患者来说,其自身粘蛋白细胞合成已经相对于于正常状态时有所减少,自然不可避免的会降低血清A1 水平。③在脂质代谢中共有四方面作用,分别为摄取、结合、转运和降解,上述四种作用和甲状腺素、胰岛素、雌激素、生长激素和胰高血糖素等调节功能作用有紧密联系。对于肝硬化患者来说,其疾病机制会进一步改变上述激素的代谢变化,影响脂质代谢。由此可说明血清载脂蛋白A1 除了可以监测肝功能的敏感性,同时还可随时反映和动态监测肝功能的变化情况,为早期诊断、指导治疗及评估肝硬化预后都起着重要的参考作用。
综上所述,血清载脂蛋白A1 含量变化可作为评断肝硬化患者病情严重程度的重要指标,同时还可作为评价肝脏合成功能的关键指标,对后续治疗和预后有一定的临床意义。
[1] 李英,黄华,李未华等.血清载脂蛋白A1 的含量与肝硬化的关系[J].中国医药导报,2010,7(7):40.
[2] Carstensen EL,Parker KJ,Lerner RM et al.Elastography in the management of liver disease.[J].Ultrasound in Medicine and Biology,2008,34(10):1535 -1546.
[3] Lee IJ,Seong J,Shim SJ et al.Radiotherapeutic parameters predictive of liver complications induced by liver tumor radiotherapy.[J].International Journal of Radiation Oncology,Biology,Physics,2009,73(1):154 -158.
[4] 叶吉云,张新俊.血清载脂蛋白测定对评价肝病的临床价值[J].昆明医学院学报,2010,31(7):66 -68.
[5] 卞祥虎.检测血清载脂蛋白在肝硬化中的意义[J].中国误诊学杂志,2011,11(16):3871 -3871.

