十产地人参双向固体发酵前后皂苷成分变化研究
徐瑶 朱莹莹 李军鸽 李佳美 朱凯 王书凯
【摘 要】 目的:取十个不同产地的人参药材,分别进行双向固体发酵,比较发酵前后主要皂苷成分变化。方法:用高效液相色谱法测定发酵前后人参皂苷Rg1、Re、Rb1、Rh1、Rd、Rg3的含量,找出发酵前后所测皂苷的变化情况。结果:十产地人参药材主要皂苷含量虽有差异,但发酵后成分变化规律相同。在双向固体发酵30天后,Rg1、Re、Rb1含量均大幅度下降,Rh1、Rd、Rg3含量均有明显升高。结论:双向固体发酵可将普通人参皂苷转化为Rd及稀有皂苷Rh1和Rg3。
【关键词】 人参皂苷 双向固体发酵 成分变化
人参(Panax ginseng C.A.Mey)是五加科植物,一般指的人参药材为其干燥根和根茎。人参的主要有效成分为人参皂苷,根据苷元的不同分为三类[1]:齐墩果烷型五环三萜皂苷、人参二醇类四环三萜皂苷、人参三醇类四环三萜皂苷。人参皂苷Re、Rb1等在人参中含量很高,而有些人参皂苷在人工栽培的人参中极微量或根本不存在,如人参皂苷Rh1、Rg3、CK等,被称为稀有皂苷,却拥有更好的活性,在抗肿瘤、抗衰老、抗炎和保肝等[2]方面表现出了极大的潜力。本实验对十产地人参通过前期选育得到的灵芝菌进行双向固体发酵,比较发酵前后人参皂苷Rg1、Re、Rb1、Rh1、Rd、Rg3的含量变化,为利用该生物转化手段将主要人参皂苷转化为稀有皂苷提供有力的佐证。
1 材料与方法
1.1 材料
来源为靖宇县、抚松县露水河镇、抚松县松江河镇、抚松县、长白山、抚松县泉阳镇、抚松县东岗镇、抚松县漫江镇、抚松县兴参镇和抚松县万良镇已按2010版《中国药典》方法检测达标的吉林省十产地人参药材。
1.2 试剂和仪器
色谱纯甲醇、乙腈购自Fisher Scientific;分析纯甲醇、磷酸购自北京化工厂;水为杭州娃哈哈集团有限公司产娃哈哈饮用纯净水;人参皂苷Rg1、Re、Rb1、Rh1、Rd、Rg3对照品购自中国药品生物制品鉴定所;AB-135S十万分之一天平;KQ-250B型超声波清洗器;SORVALL Evolution RC高速离心机;Agilent 1260高效液相色谱仪;YXQ-LS-50A立式压力蒸汽灭菌锅;恒温培养振荡器(天津市欧若仪表有限公司);BIC-250型人工气候箱;DHG7-9240A型电热恒温鼓风干燥箱。
1.3 人参双向固体发酵
十产地人参分别粉碎,过1号筛,加入适量的水和生长因子,混匀制成固体培养基,平均分装于三角瓶中,121℃灭菌60min,放入接种室冷却至室温。将已经培养好的灵芝种子液以一定的比例接入瓶装固体培养基中,放入人工气候箱中28℃避光培养30天。待菌丝已长满瓶底,取出,放入55℃烘箱,干燥后即为人参药性菌质。
1.4 人参皂苷Rg1、Re、Rb1、Rd、Rg3、Rh1含量测定
1.4.1 人参皂苷Rg1、Re、Rb1、Rd、Rg3含量测定色谱条件
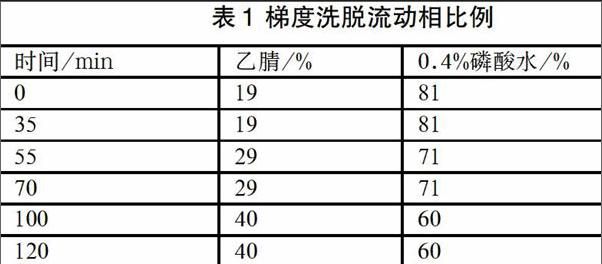
色谱柱Agilent-SB(4.6×250mm,5μm),流动相:乙腈-0.4%磷酸水梯度洗脱(见表1),柱温:30℃,流速:1ml/min,检测波长:203nm。
1.4.2 人参皂苷Rh1含量测定的色谱条件
色谱柱GL Sciences-ODS(4.6×250mm,5μm),流动相:乙腈-水(26.5:73.5),柱温:30℃,流速:1ml/min,检测波长:203nm。
1.4.3 对照品溶液的制备
将6种人参皂苷对照品分别以甲醇为溶剂精密配置成0.2mg/ml的溶液。
1.4.4 供试品溶液的制备
取十产地人参及发酵后药材粉碎,过4号筛,分别精密称定1.25g,置于锥形瓶中,并精密加入25ml甲醇,密塞称重后,超声处理30min,超声后冷却补重,离心(8000r/min,20min),取上清液,用0.45μm微孔滤膜过滤,即得[3]。
1.4.5 含量测定
精密吸取上述制备液各20μl,用高效液相色谱仪进行分析, 每个供试品平行进2针,通过计算得出6种人参皂苷的含量,并对十产地人参双向固体发酵前后以上成分含量变化进行比较。
2 结果
2.1 十产地人参药材6种皂苷含量比较
实验中可知十产地人参药材中,人参皂苷Rg1、Re、Rb1、Rh1、Rd含量差异较大。其中,Rh1含量极微,人参皂苷Rg3几乎检测不到。结果分析表明,从靖宇县人参药材含二醇类和三醇类四环三萜皂苷量最高,三醇类皂苷(以Rg1、Re作参考)含量可达到其它产地的1.6~2.6倍,二醇类皂苷(以Rb1作参考)含量可达到其它产地的1.6~5.9倍,可见,不同产地人参药材各成分差异之大。
2.2 十产地人参发酵前后6种皂苷含量变化规律
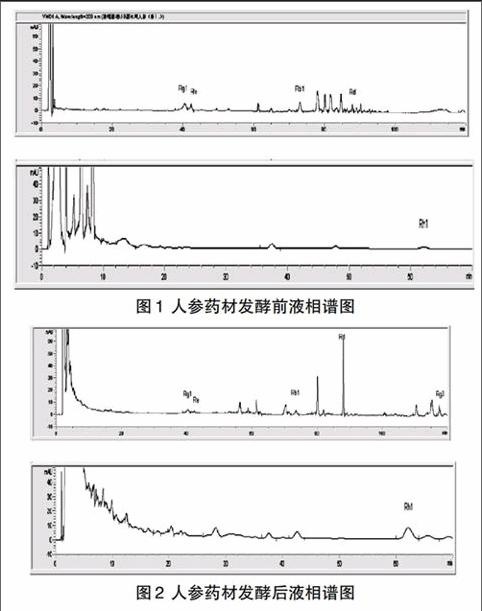
发酵前后皂苷含量变化各不相同,但呈现出相同的转化规律:Rg1、Re、Rb1含量均大幅度下降,Rd、Rg3、Rh1含量均有明显升高(可参考图1~图2)。
3 讨论
十产地人参虽都产自吉林,但测定结果表明,不同皂苷含量差异甚大。比较十产地人参发酵前后6种皂苷的含量变化发现,Rg1、Re、Rb1含量下降明显,Rh1、Rd、Rg3含量明显升高,可以推测原人参药材中的主要皂苷Rg1、Re、Rb1通过双向固体发酵的手段发生了转化。而Rh1、Rd、Rg3含量的增加是与Rg1、Re、Rb1含量的减少有直接或间接关系的,Rg1可直接转化为Rh1(Rg1C20葡萄糖苷键断裂)[4],Re可通过Rg1直接或间接转化为Rh1(ReC6末端的鼠李糖糖苷键断裂转化为Rg1,Rg1C20上葡萄糖苷键断裂转化为Rh1)[5,6],Rb1可通过Rd直接或间接转化为Rg3(直接水解或相继水解Rb1C20上的两个葡萄糖)[7]。稀有皂苷明显增加,给灵芝菌种对人参药材的双向固体发酵研究带来了更大的研究意义,稀有人参皂苷Rh1和Rg3均为抗癌活性较强的成分。而对于转化的机理,需要进一步研究。
参考文献
[1]杨金玲,高丽丽,朱平.人参皂苷生物合成研究进展[J].药学学报,2013,48(2):170-178.
[2]Jong-Jin Lee, Ho-Kyun Kwon, In-Ho Jung,et al.Anti-cancer Activities of Ginseng Extract Fermented with Phellinus linteus[J].Mycobiology,2009,37(1):21-27.
[3]游元元.人参总皂苷的指纹图谱分析[J].西南军医,2006,8(6):37-38.
[4]张怡轩,陈晓莹,赵文倩.人参皂苷生物转化的研究进展[J].沈阳药科大学学报,2008,25(5):419-422.
[5]弓晓杰.人参皂苷酶代谢产物化学修饰及其抗癌活性研究[D].长春:吉林农业大学,2004.
[6]吕永俊,徐绥绪.人参皂苷的化学研究方法[J].沈阳药学院学报,1985,2(1):63-82.
[7]Le-Qin Cheng,Ju Ryun Na,Myun Ho Bang,et al.Conversion of major ginsenoside Rb1 to 20(S)-ginsenoside Rg3 by Microbacterium sp.GS514[J].Phytochemistry,2008,69:218-224.

