局部晚期乳腺癌经内乳动脉置管新辅助化疗47例临床研究
陈金辉,焦喜林,王振全,吴劲松,苗玲玲,蒋志斌
·论著·
局部晚期乳腺癌经内乳动脉置管新辅助化疗47例临床研究
陈金辉,焦喜林,王振全,吴劲松,苗玲玲,蒋志斌
目的 探讨内乳动脉置管给药新辅助化疗对局部晚期乳腺癌的临床疗效及安全性。方法 选择不宜一期手术、临床分期Ⅲa~Ⅲc期的局部晚期乳腺癌患者92例为研究对象,随机分为研究组(n=47)和对照组(n=45),研究组采取患侧内乳动脉置管、微量泵给药,对照组采取周围静脉给药,进行新辅助化疗,化疗方案为FEC方案:环磷酰胺500 mg/m2,D1;表柔比星100 mg/m2,D1;氟尿嘧啶500 mg/m2,D1、4。21 d为1个周期。2~4个周期后视情况行乳腺癌根治术。术后对两组新辅助化疗疗效、毒性反应及预后进行分级评估。结果 研究组部分缓解率和总有效率均高于对照组(P<0.05),经2个周期治疗即可接受手术者比例研究组明显高于对照组(P<0.05)。2组毒性反应发生率比较差异无统计学意义(P>0.05)。随访1年,研究组远处转移率低于对照组、无瘤生存率高于对照组(P<0.05)。结论 与静脉给药相比,局部晚期乳腺癌经内乳动脉置管新辅助化疗效果更好,待手术时间短,且不增加药物毒性反应,是临床优选的给药途径。
局部晚期乳腺癌;内乳动脉;置管;新辅助化疗
随着临床对乳腺癌是一种全身性疾病的认识的转变,其治疗模式亦从以往的单纯注重手术治疗转向全身综合治疗,其中新辅助化疗(neo-adjuvant chemotherapy, NCT)的治疗方式越来越被临床广泛接受[1]。该方法基本被认可应用于以往认为无法手术或者有保乳期望但因肿瘤太大无法行保乳手术的患者[2],尤其对于局部晚期乳腺癌(locally advanced breast cancer, LABC)即局部肿瘤大而未发现远处转移者意义重大:可能使原本不可手术的患者重新争取到手术切除的机会,提高生存率,甚至可能得到保乳治疗的机会。因此近年来临床已将NCT列为LABC的标准治疗方案之一[3]。既往NCT的治疗手段多数为静脉给药化疗。10余年来,笔者所在医院针对LABC采取内乳动脉置管、微量泵给药的途径进行区域性NCT,取得了较好的临床效果[4]。本文通过与常规周围静脉给药途径对比回顾分析经内乳动脉置管给药NCT对LABC的临床疗效及安全性。
1 对象与方法
1.1 对象与分组 选择2002年5月—2014年6月解放军白求恩国际和平医院收治的92例临床认为不宜一期手术、临床分期Ⅲa~Ⅲc期的LABC为研究对象,均为女性;年龄42~63(50.8±9.2)岁;未绝经53例,绝经后39例。所有患者经空芯针穿刺活检病理检查确诊为乳腺癌,其中浸润性导管癌69例,浸润性小叶癌10例,浸润性导管癌伴浸润性小叶癌8例,其他类型5例;TNM分期为T3~4N0~3M0;ER阳性69例,ER阴性23例。排除标准:①合并严重心脑血管疾病、肝肾功能不全、精神疾病和造血系统疾病等不能耐受治疗者;②接受过放、化疗及内分泌治疗者;③肿瘤患者生存质量(Karnofsky)评分[5]<70分者。将92例按治疗方法不同随机分为内乳动脉置管NCT组(研究组)47例和周围静脉NCT组(对照组)45例。研究组年龄43~63(49.3±8.9)岁;浸润性导管癌36例,浸润性小叶癌5例,浸润性导管癌伴小叶癌4例,其他类型2例;对照组年龄42~63(51.2±9.1)岁;浸润性导管癌36例,浸润性小叶癌4例,浸润性导管癌伴小叶癌3例,其他类型2例。两组年龄、病理类型等比较差异无统计学意义(P>0.05),具有可比性。
1.2 方法
1.2.1 内乳动脉置管:研究组在局麻或硬膜外麻醉下,于患侧剑突旁2 cm肋弓下做纵向切口,长4 cm,打开腹直肌前鞘,由中线向外侧翻开腹直肌,在腹直肌与后鞘之间寻找腹壁上动脉,结扎远端,向近心端插入硬膜外导管10~15 cm,注入亚甲蓝溶液观察体表染色区域,调整并确定置管深度,以患侧乳腺区及腋窝染色为宜。固定导管,缝合切口。以肝素封管防止导管堵塞。
1.2.2 新辅助化疗方案 两组均采用FEC方案:环磷酰胺500 mg/m2,D1;表柔比星100 mg/m2,D1;氟尿嘧啶500 mg/m2,D1、4。21 d为1个周期。研究组为经内乳动脉置管微量泵持续泵入,对照组为静脉滴注。其间适当给予保肝、对症治疗并监测血常规及肝肾功能。2~4个周期后行手术治疗,手术方式包括乳腺癌改良根治术或标准根治术,根据肿物侵犯深度及患者意愿决定。化疗后、术后对NCT疗效、毒性反应进行分级评估,并按照浸润性乳腺癌继续完成辅助放、化疗及内分泌治疗。随访1年对预后进行评估。
1.3 疗效判定标准 化疗后原发病灶的疗效根据国际抗癌联盟(UICC)实体瘤通用疗效评定标准[6]进行评估,其中肿瘤病灶体积通过临床查体及B超进行双径测量。完全缓解(CR):化疗后肿瘤病灶完全消失;部分缓解(PR):肿块体积缩小>50%;疾病稳定(SD):化疗后肿瘤体积缩小≤50%或增大<25%;疾病进展(PD):肿瘤体积增大>25%或出现新病灶。总有效(OR)率=CR率+PR率。病理完全缓解(pCR)为手术标本中无肿瘤病灶残留或仅有原位癌残留。
1.4 毒性反应评估 按照WHO抗癌药急性及亚急性毒性反应分度标准分为0~Ⅳ度[7]。分别观察记录两组毒性反应如胃肠道反应、白细胞下降、外周静脉炎、过敏性皮疹、脱发及心脏毒性等发生情况,计算发生率。
1.5 预后评估 随访1年评价两组复发率及生存率。
1.6 统计学分析 应用SPSS 16.0软件进行统计学处理,计数资料以率(%)表示,组间比较采用χ2检验,α=0.05为检验水准。
2 结果
2.1 临床疗效 研究组PR率、OR率较对照组高,差异有统计学意义(P<0.05),而CR率、pCR率与对照组比较差异无统计学意义(P>0.05),见表1。研究组、对照组经2个周期治疗即可接受手术的患者比例为48.94%(23/47)、24.44%(11/45),研究组明显高于对照组(P<0.05)。研究组有1例、对照组有2例因病情进展未能如期行改良根治术,改行以紫杉类药物为主的全身化疗。
2.2 毒性反应评估 两组主要毒性反应为骨髓抑制、消化道反应及脱发,均以Ⅰ、Ⅱ度为主,无Ⅳ度患者,骨髓抑制以白细胞减少为主,消化道反应以恶心、呕吐为主,未出现严重的过敏反应及肝肾功能损害。两组均未出现明显心脏毒性病例,均未出现因严重毒性反应而中断治疗情况。两组毒性反应发生率比较差异无统计学意义(P>0.05),见表2。
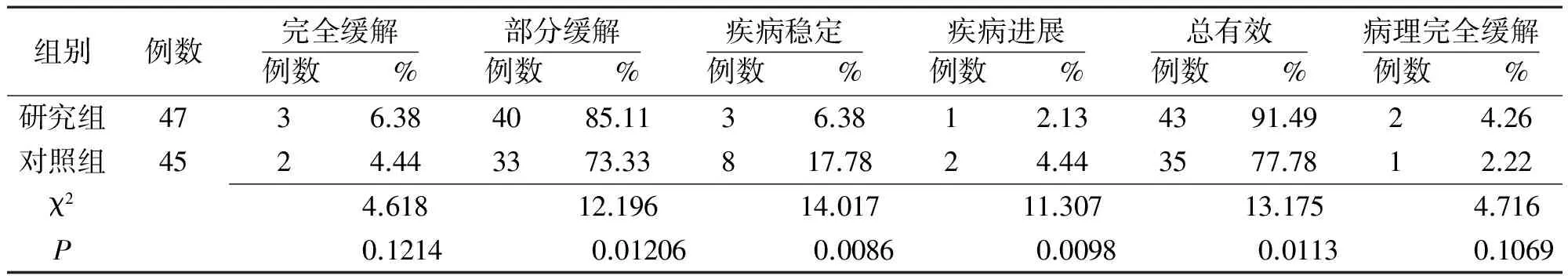
表1 两组局部晚期乳腺癌患者行新辅助化疗后临床效果比较
注:研究组采用经内乳动脉置管给药,对照组采用周围静脉滴注给药

表2 两组局部晚期乳腺癌患者行新辅助化疗后毒性反应发生情况比较
注:研究组采用经内乳动脉置管给药,对照组采用周围静脉滴注给药
2.3 预后评估 随访1年,两组均未发生胸壁局部复发。远处转移(主要为骨和肺)率研究组为10.64%(5/47)、对照组为17.78%(8/45),差异有统计学意义(χ2=9.584,P=0.0325);无瘤生存率研究组为89.36%(42/47)、对照组为82.22%(37/45),差异有统计学意义(χ2=10.176,P=0.0147)。
3 讨论
LABC是浸润性乳腺癌的特殊阶段,其定义至目前为止尚未有明确的标准,一般是指临床和影像学初步评估显示疾病进展仅限于乳腺和区域淋巴结内,主要是指原发病灶直径大于5 cm(T3)或有皮肤和胸壁粘连固定(T4)和(或)区域的腋窝淋巴结互相融合(N2)或同侧锁骨上淋巴结转移(N3)的乳腺癌。根据以上标准,临床分期上主要是指IIIa期和IIIb期的乳腺癌[8]。与早期乳腺癌相比,LABC患者局部复发和发生远处转移的危险性均显著增高。治疗困难及预后不良仍是LABC临床亟待解决的棘手问题。
Frei于1982年提出NCT概念后,NCT已被广泛用于临床实践,并已成为乳腺癌全身治疗的一个重要组成部分。对于局部晚期乳腺癌的病变来说,NCT使局部肿瘤缩小易于切除,使不可切除的病变成为可切除的病变,不仅显著提高了肿瘤局部治疗的效果,而且通过全身化疗使已存在的周身亚临床转移灶得以控制,使患者的生存状况有所改善,因而备受乳腺肿瘤学界的关注。
恶性肿瘤行化疗的最终目的是杀灭或抑制肿瘤细胞,这是通过在癌灶内达到和维持一定的有效药物浓度所产生的化学作用来实现的。临床影响化疗效果的因素很多,肿瘤的异质性、化疗药物的选择及使用是否得当、化疗药物的耐药性以及患者的个体差异等。其中,药物的选择及正确使用是保证治疗效果的重要环节。要达到较好的化疗效果,不仅需要肿瘤细胞对所选的药物敏感,化疗药物在癌灶或靶组织器官中的浓度也要足够高、作用时间要足够长。因此,如何使现有的治疗方法发挥更大的治疗效应,除了剂量强度是当前肿瘤临床研究的热点外,给药途径也是一个值得探讨的问题。乳腺癌NCT的给药途径多以周围静脉给药的全身化疗为主。这就存在一个问题,抗肿瘤药物经过体循环及首过消除后到达相对较大的LABC肿瘤内部,浓度将会大打折扣,长时间低效的化疗又可能导致肿瘤产生耐药甚或出现转移,可能会直接影响NCT的效果。
为此笔者所在科室设计了内乳动脉置管的给药方式,进行区域性NCT,取得了较周围静脉给药更好的临床效果。本研究结果显示,此种给药方式的有效率更高,术前需要的化疗周期更短,毒性反应与周围静脉给药基本相当,分析可能的机制有以下几点:①内乳动脉是乳腺癌瘤体主要的供血血管之一,是一个既能直接给药又便于置管操作的血管。内乳动脉通常单独发自锁骨下动脉,偶尔与甲状颈干、肩胛动脉、甲状腺动脉或肋颈动脉干共同发自锁骨下动脉。沿着胸锁关节及各肋骨、肋软骨背面下行,大约在第6肋间隙与第7肋软骨头后延续为腹壁上动脉,其前穿支供应并营养胸壁和部分乳腺。有研究发现,乳腺癌瘤体的供血有67%(20%~95%)来自内乳动脉[9]。但也有研究认为,乳腺癌的供血主要由胸外侧动脉完成,其次才是内乳动脉和肩胛下动脉[10]。尽管乳腺癌血供复杂,不能一概而论,但内乳动脉肯定是乳腺肿瘤主要供血血管之一。此外,乳腺癌为富血供肿瘤,特别是LABC的供血尤为丰富,各供血分支广泛吻合,最终形成供应瘤体的血管网。因此无论从哪个主要血管给药,均可在此血管网覆盖范围的组织内形成相当高的血药浓度及组织药物浓度。而且在上段腹直肌后找到腹壁上动脉后很容易向内乳动脉内置入给药导管,因此能够为区域性化疗提供一个直接的给药途径。②内乳动脉置管NCT在肿瘤局部提供了更高的组织药物浓度。在进行化疗过程中,对肿瘤细胞能有效杀伤的化学药物透过肿瘤中毛细血管进入其内部,在达到该药物的最小有效浓度后才能产生药效。而细胞周期非特异性细胞毒药物对癌细胞的杀伤力在一定范围内呈浓度依赖性。比如现行一线治疗方案中应用最为广泛的蒽环类药物表柔比星,具有抗肿瘤谱广、疗效高的特点,其局部药物浓度增加1倍杀灭细胞数可增加10倍左右[11]。但用药总量累加到一定数量后将会出现心脏毒性,甚至导致严重后果,因而限制了该类药物在临床的使用[12]。此时通过周围静脉给药以提高剂量的方式增加疗效将承担巨大风险。但对于血供丰富的LABC瘤体,采取供血血管直接给药方式,即使不增加剂量也能大大提高靶器官药物浓度,而且不增加化疗的毒性反应,比常规的静脉化疗有明显的优势。③内乳动脉置管后药物的持续泵入增加了化疗药物进入肿瘤的动力和作用时间。如果肿瘤组织能够维持足够长时间有效药物浓度水平,则化学药物就有充分的时间来对肿瘤细胞进行杀伤。在肿瘤中由于流体间质压较高,肿瘤间质中的对流效应可以忽略,药物主要是通过扩散来进行输运[13]。生物力学研究表明,实体肿瘤组织中缺乏功能性淋巴管吸收从毛细血管渗出的流体,渗出的流体在间质内大量积聚,导致肿瘤内部间质压整体上升,而在肿瘤边缘与正常组织相连处间质压则急剧下降,这种间质压分布是药物传递屏障的主要原因[14]。但是当药物持续注入引起的血管内压强阶跃升高时,可形成较大的跨壁压差推动药物从血管内渗出向肿瘤内部扩散,也延缓了药物的回吸收。而大部分细胞周期特异性抗肿瘤药物的作用为时间依赖型,如氟尿嘧啶特异性作用于细胞S期[15],半衰期仅10~15 min,常规静脉给药后很快降解,难以维持长久的血药浓度和组织药物浓度,单纯增加浓度的效果不明显。本研究采取在内乳动脉置管后采用微量注射泵将药物持续泵入,在肿瘤周围形成了较长时间的血管高压,增大了药物入瘤的动力,也延长了其在肿瘤内部停留的时间,这一点对提高疗效非常重要。④提高了杀灭肿瘤的效率。虽然有少部分患者NCT治疗过程中取得了pCR,但是LABC前期治疗的目的绝非追求pCR,而是短期内迅速控制肿瘤进展并降期,争取早日采取根治性外科手术,毕竟外科手术治疗是减少肿瘤复发转移最重要的手段,因此NCT的效率很重要。肿瘤干细胞的理论认为,它们是肿瘤组织内数量较少的一群细胞[16],多处于G0期,而大多数细胞毒药物治疗癌症的靶点都是处于S、M或G2期的细胞,因此干细胞可以逃避药物的杀伤作用,在化学药物的作用之后存活下来,继续生长、繁殖,产生下一代肿瘤细胞,而成为肿瘤复发和转移的根源[17]。因此,在肿瘤耐药细胞成为主体而失去控制之前能够得到根治性切除至关重要。本研究中采用经内乳动脉置管给药NCT的研究组能够明显加快肿瘤降期的速度,缩短待手术时间,比采用周围静脉滴注给药NCT的对照组更有效,从而使LABC患者生存受益。
综上所述,对于LABC,经内乳动脉置管NCT比传统的静脉给药NCT疗效更好,待手术时间较短,且不增加药物毒性反应,是临床优选的治疗途径。
[1] 石秀换,刘明法.紫杉类联合蒽环类方案新辅助化疗在乳腺癌治疗中的近期疗效观察[J].中国医药,2015,10(3):386-389.
[2] 周林平.乳腺癌治疗中TE方案新辅助化疗的应用效果及机制[J].中国医药科学,2012,2(22):187-188.
[3] Arowolo O A, Njiaju U O, Ogundiran T O,etal. Neoadjuvant capecitabine chemotherapy in women with newly diagnosed locally advanced breast cancer in a resource-poor setting (Nigeria):efficacy and safety in a phase II feasibility study[J].Breast J, 2013,19(5):470-477.
[4] 陈金辉,赵增顺,焦喜林,等.内乳动脉置管新辅助化疗对乳腺癌细胞增殖和凋亡的影响[J].华北国防医药,2007,19(5):11-12.
[5] 于世英.肿瘤科常见病用药处方分析[M].北京:人民卫生出版社,2010:505-506.
[6] 孙燕.内科肿瘤学[M].北京:人民卫生出版社,2001:994-995.
[7] 孙燕,周际昌.临床肿瘤内科手册[M].北京:人民卫生出版社,2003:102-104.
[8] 赵晶,尉承泽.乳腺癌新辅助化疗前后前哨淋巴结活检的应用现状[J].临床误诊误治,2012,25(9): 94-97.
[9] Doughty J C, McCarter D H, Kane E,etal. Anatomical basis of intra-arterial chemotherapy for patients with locally advanced breast cancer[J].Br J Surg, 1996,83(8):1128-1130.
[10]张淼,宋敏,屈淑贤,等.多西他赛联合卡培他滨方案在新辅助化疗三阴乳腺癌与非三阴乳腺癌中的近期疗效观察[J].解放军医药杂志,2015,27(3):55-57,62.
[11]程昱,庄茜,杨菁,等.体外肿瘤药敏试验与临床疗效不符原因分析[J].海峡药学,2013,25(11):180-181.
[12]Gianni L, Herman E H, Lipshultz S E,etal. Anthracycline cardiotoxicity: from bench to bedside[J].J Clin Oncol, 2008,26(22):3777-3784.
[13]Pluen A, Boucher Y, Ramanujan S,etal. Role of tumor-host interaction in interstitial diffusion of macromolecules:cranial vs. subcutaneous tumors[J].Proc Natl Acad Sci USA, 2001,98(8):4628-4633.
[14]吴洁,许世雄,赵改平,等.实体肿瘤内毛细血管-跨毛细血管壁-组织间质相耦合的不定常流动及对药物传递的影响[J].医用生物力学,2005,20(4):204-211.
[15]汤钊猷.现代肿瘤学[M].上海:上海医科大学出版社,1993:545.
[16]王怀志,赵国强,石献洲,等.肿瘤干细胞在人结肠癌细胞株HT29耐奥沙利铂中的作用探讨[J].中国医药导报,2013,10(20):7-9 ,13.
[17]陈元文,乔正荣,吴诚义,等.新辅助化疗后乳腺导管癌干/祖细胞克隆形成观察[J].检验医学与临床,2014,11(1):8-10.
Clinical Research of Neoadjuvant Chemotherapy with the Internal Mammary Artery Catheter in Treatment of 47 Patients with Locally Advanced Breast Cancer
CHEN Jin-hui, JIAO Xi-lin, WANG Zhen-quan, WU Jin-song, MIAO Ling-ling, JIANG Zhi-bin
(The Second Department of General Surgery, Bethune International Peace Hospital of PLA, Shijiazhuang 050082, China)
Objective To study the curative effect and safety of neoadjuvant chemotherapy with the internal mammary artery catheter in treatment of locally advanced breast cancer patients. Methods A total of 92 locally advanced breast cancer patients with Ⅲa-Ⅲc phase, who were not suitable for one-stage operation, were randomly divided into treatment group (n=47) and control group (n=45). The treatment group was given neoadjuvant chemotherapy with internal mammary artery catheter in the affected side by micro pump injection, while the control group was given neoadjuvant chemotherapy through peripheral vein administration. FEC chemotherapy plan was Cyclophosphamide 500 mg/m2, D1, Epirubicin 100 mg/m2, D1 and Fluorouracil 500 mg/m2, D1, 4. A Cycle was 21 d. Whether the radical mastectomy could be performed or not depended on the patient's condition after chemotherapy for 2-4 cycles. The curative effect, toxic reaction and prognosis of neoadjuvant chemotherapy after the surgery in the two groups were given grading evaluation. Results The partial remission and total effective rates in treatment group were higher than those in control group (P<0.05). The ratio of operation ability after 2 cycles of treatment in the treatment group was significantly higher than that in the control group (P<0.05). There was no significant difference in incidence rate of toxic reaction in the two groups (P>0.05). In the treatment group, the rate of distant metastasis was lower, and tumor free survival rate was higher than those the control group with one year of follow-up (P<0.05). Conclusion Compared with those by peripheral vein administration, the neoadjuvant chemotherapy with internal mammary artery catheter has better curative effect, shorter waiting time for operation without increasing the toxic reaction of drugs, and therefore it is the preferred method for locally advanced breast cancer patients in clinical practice.
Locally advanced breast cancer; Internal mammary artery; Catheter; Neoadjuvant chemotherapy
050082 石家庄,解放军白求恩国际和平医院普外二科
R737.9
A
2095-140X(2015)08-0029-04
10.3969/j.issn.2095-140X.2015.08.008
2015-03-06 修回时间:2015-04-10)

