不同肤色山羊皮肤组织形态学及黑色素生成相关基因的表达分析
任航行,王高富,陆 健,李 杰,蒋 婧,刘良佳,周 鹏*
(1.重庆市畜牧科学院,荣昌 402460;2.重庆市山羊工程技术研究中心,荣昌 402460;3.全国畜牧总站畜禽遗传资源保存利用中心,北京 100193;4.甘肃农业大学动物科学技术学院,兰州 730070)
不同肤色山羊皮肤组织形态学及黑色素生成相关基因的表达分析
任航行1,2,王高富1,2,陆 健3,李 杰1,4,蒋 婧1,2,刘良佳1,2,周 鹏1,2*
(1.重庆市畜牧科学院,荣昌 402460;2.重庆市山羊工程技术研究中心,荣昌 402460;3.全国畜牧总站畜禽遗传资源保存利用中心,北京 100193;4.甘肃农业大学动物科学技术学院,兰州 730070)
旨在阐明酉州乌羊皮肤发育的组织形态学特点以及黑色素高度沉积的可能分子机制,本研究选取渝东白山羊(白色皮肤)为对照,对100日龄酉州乌羊和渝东白山羊胎儿皮肤组织进行了组织形态学分析;并检测了成年酉州乌羊和渝东白山羊皮肤组织以及B16黑色素细胞增殖、分化阶段Pax3、Mitf与Tyr的表达变化。结果表明,在山羊胎儿皮肤快速发育阶段,两品种间皮肤黑色素沉积差异明显;Pax3与Tyr在酉州乌羊皮肤中表达量显著高于渝东白山羊(P<0.001),而Mitf则无明显差异(P>0.05);相对于细胞增殖阶段,B16细胞在分化时Pax3表达显著下调(P<0.001),Tyr的表达显著上调(P<0.01),而Mitf无明显差异(P>0.05)。研究结果提示,在皮肤发育分化的早期阶段,酉州乌羊与渝东白山羊黑色素细胞的迁移路线可能不同;Pax3下调与Tyr上调是色素细胞分化并生成黑色素的必要条件;酉州乌羊皮肤黑色素高度沉积与Pax3、Tyr的大量表达有关。
酉州乌羊;皮肤着色;组织形态;基因表达
酉州乌羊是迄今为止人们发现的唯一一种具乌皮特征的山羊品种,是我国珍贵的特色地方山羊遗传资源。目前,酉州乌羊仅分布于重庆市酉阳地区。酉州乌羊全身皮肤为乌色,眼、鼻、嘴、肛门、阴门等处可视黏膜为乌色,骨骼关节带乌色。该羊属中小体型,全身被毛白色,一条黑色背脊线,两黑色眼圈。我们前期已经对酉州乌羊的生长发育性能、屠宰性能和肉品质理化特性进行了初步研究[1-3],还分析了酉州乌羊的血液生理生化指标[4]。这些研究表明,酉州乌羊的确与其他品种山羊存在较大差异。尽管可以确定,乌皮羊与非乌皮羊之间这种皮肤颜色差异是由于黑色素沉积差异造成的,但对于山羊皮肤着色差异的分子基础研究还未见报道。
黑色素是由黑色素细胞产生的一种能在染料下显色的醌类化合物,而胚胎期间色素细胞的迁移路线、增殖速率及分化结果决定了机体组织的颜色。Pax3不但在神经干细胞分化为黑色素干细胞的发育过程中起着重要作用[5],而且还调控着色素合成代谢过程[6-8]。Mitf是Pax3的下游靶基因,在色素干细胞的存活与维持方面起关键作用[9]。此外,Mitf还是启动其下游黑色素合成相关基因(如Tyr、Tyrp1与Dct)的上游调控子[10-11]。Tyr为Mitf的靶基因,也是编码黑色素合成过程中的关键酶基因。那么,这3个影响色素沉积的重要基因在乌羊与非乌羊皮肤的表达是否有差异?他们是否与两品种山羊皮肤的色素沉积有关?本研究以酉州乌羊和渝东白山羊(白色皮肤)为研究对象,初步分析了酉州乌羊和渝东白山羊皮肤的组织形态学差异,检测了两品种山羊皮肤Pax3、Mitf、Tyr基因的表达,同时还分析了B16黑色素细胞增殖、分化阶段这3个关键基因的表达。为将来进一步阐明乌皮羊与非乌皮羊表型背后的分子机制奠定基础。
1 材料与方法
1.1 样本
试验用酉州乌羊(乌色皮肤)与渝东白山羊(白色皮肤)在同一饲养管理条件下分圈全舍饲饲养,自由采食(青贮玉米、甘草、混合精料)、饮水。 收集妊娠阶段100 d酉州乌羊和渝东白山羊胎儿各3只,采集背腹部皮肤组织,甲醛固定,用于组织形态学分析(H.E.染色);另外采集6月龄雄性酉州乌羊(n=3)与渝东白山羊(n=3)皮肤样本,液氮保存用于基因表达检测。
1.2 主要试剂
DMEM、1640培养基、胎牛血清(FBS)、青链霉素双抗、0.25%胰酶(0.05% EDTA)、D-PBS均购自Gibco;96孔板、T25细胞培养瓶、15 mL离心管购自Corning;Power SYBR-Green PCR Master Mix Kit购自美国ABI公司;M-MLV反转录酶购自美国Promega公司;反转录试剂盒购自美国Life公司; RNA酶抑制剂购自TaKaRa公司;Trizol试剂购自美国Invitrogen公司。
1.3 组织形态学分析
皮肤组织H.E.染色依据文献[12]的方法进行。
1.4 B16黑色素细胞继代培养
具体操作步骤:(1)吸去培养瓶中的培养基,加入3 mL预热的D-PBS清洗2~3次,吸去D-PBS;(2)加入预热的0.25%胰酶(0.05% EDTA)1 mL,37 ℃消化3~5 min;(3)显微镜下观察,当细胞胞质回缩,细胞大片从培养瓶上脱落时,加入2~3 mL含10% FBS的DMEM完全培养基终止消化;(4)轻轻吹打均匀,吸入到15 mL离心管中,500 g离心5 min;(5)弃上清,加入1 mL含10% FBS的DMEM完全培养基,吹打均匀;(6)细胞计数,部分细胞按照2×105个·mL-1密度接种到T25细胞培养瓶中继续培养。
1.5 MTT法测定细胞生长曲线
接种细胞,用含10%胎牛血清的培养液配成单个细胞悬液,以每孔1 000~10 000个细胞接种到96孔板,每孔体积200 μL。细胞在1640培养基 + 10%胎牛血清条件下培养4 d,分别在0、24、48、72、96 h时间点取样。每孔加MTT溶液(5 mg·mL-1用PBS 配) 20 μL,继续孵育4 h,终止培养,小心吸弃孔内培养上清液,对于悬浮细胞需要离心后再吸弃孔内培养上清液。每孔加150 μL DMSO,振荡10 min,使结晶物充分融解。选择490 nm波长,在酶联免疫监测仪上测定各孔光吸收值,每个时间点至少5个生物学重复。记录结果以时间为横坐标,吸光值为纵坐标绘制细胞生长曲线。
1.6 Real-time PCR
分别从两品种山羊皮肤组织与B16细胞中提取总RNA,应用反转录试剂盒生成cDNA,再分别进行定量PCR分析。反应条件:95 ℃预变性10 min; 95 ℃变性 30 s,退火温度退火30 s,40个循环;72 ℃延伸10 min;4 ℃保存。每个基因做4次重复。GAPDH为内参基因。Pax3、Mitf、Tyr的相对定量表达应用ΔΔCt法计算。
1.7 统计方法
应用SAS 8.0软件中的t-test方法分别检验乌皮与白皮山羊间,及B16细胞增殖与分化条件下Pax3、Mitf、Tyr基因的表达差异。
2 结 果
2.1 酉州乌羊与渝东白山羊皮肤组织学分析
据观察,酉州乌羊皮肤颜色随着年龄增加而加深,为了探究乌质表型发生早期皮肤组织形态学特征,对胎儿期100日龄的乌皮与非乌皮山羊的皮肤组织进行了H.E.染色。分析发现,胎儿期100日龄酉州乌羊表皮与真皮组织均含有较多的黑色素颗粒,而在对照样本(渝东白山羊)皮肤组织中未检测到明显的黑色素沉积(图1)。进一步分析发现,酉州乌羊皮肤除毛囊周围有黑色素颗粒外,皮肤的其他部位也广泛分布着黑色素颗粒(图1)。这些结果暗示,在皮肤发育分化的早期阶段,乌皮羊与非乌皮羊黑色素细胞的迁移路线可能存在差异。
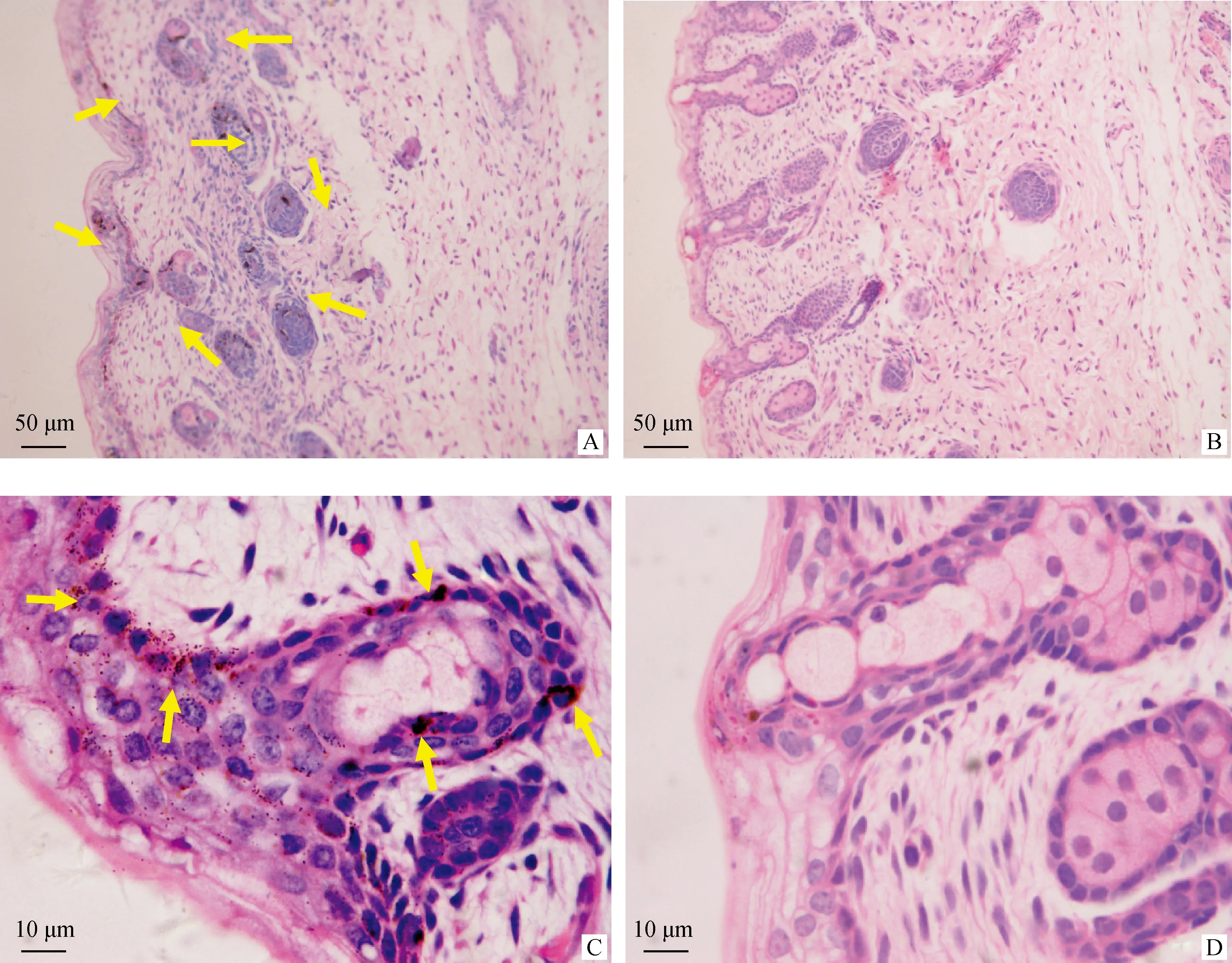
A、C分别为酉州乌羊100 d胎儿皮肤的不同放大倍数H.E.染色图片; B、D分别为渝东白山羊100 d胎儿皮肤的相应H.E.染色图片;图A和B比例尺为50 μm,图C和D比例尺为10 μm.黑色素颗粒(棕褐色)用黄色箭头标注A,C indicate the dark-skin sections by H.E.staining at various resolutions,while B and D are images of the normal skin.The scale bar for A and B is 50 μm,and 10 μm for C and D.The melanin is indicated by the yellow arrow图1 酉州乌羊与渝东白山羊100 d胎儿皮肤组织切片 H.E.染色Fig.1 H.E staining of the 100 d-fetal dermal sections in Youzhou Dark-skin goat and Yudong White goat
2.2 酉州乌羊与渝东白山羊皮肤组织Pax3、Mitf、Tyr的表达
对不同肤色的成年山羊皮肤组织Pax3、Mitf、Tyr基因qPCR检测发现,Pax3与Tyr在酉州乌羊皮肤中表达量显著高于渝东白山羊(P<0.001),而Mitf则无明显差异(图2)。初步说明Pax3和Tyr的高表达与酉州乌羊的皮肤色素沉积高度相关。

皮肤总RNA用于定量PCR分析,GAPDH为内参,应用2-△△Ct方法分别计算两种肤色山羊皮肤组织mRNA的相对表达量。目的基因的相对含量表示为“平均值±标准差”(n=3).***.P<0.001Skin total RNA was used for qPCR analysis.Expression was quantified relative to GAPDH expression in each group using the 2-△△Ct method.The data are shown as the “mean±SD”(n=3).***.P<0.001图2 Pax3、Tyr、Mitf mRNA在不同肤色山羊皮肤组织中的表达Fig.2 The mRNA expression of Pax3,Tyr and Mitf in skin with different colors in goats
2.3 B16细胞增殖与分化过程中Pax3、Mitf与Tyr的表达
为了进一步从细胞学层面研究Pax3、Tyr、Mitf表达与黑色素生成的关系,首先应用MTT法绘制了B16细胞增殖曲线,发现细胞数在1640培养基 + 10% FBS 条件下培养72 h增殖达到顶峰(图3)。 随着B16细胞进一步分化,开始分泌黑色素颗粒。基因表达分析发现,相对于增殖阶段,Pax3的表达在分化时显著下调(P<0.001),而Tyr的表达显著上调(P<0.01),Mitf的表达在分化与增殖阶段无明显变化(图4)。这表明Pax3下调与Tyr上调是B16色素细胞分化并合成黑色素的重要前提条件。
由于Tyr是细胞内黑色素合成通路中的关键调控酶,Tyr的表达量直接决定了黑色素合成的速率。酉州乌羊皮肤组织TyrmRNA表达显著高于渝东白山羊,暗示必定存在着调控Tyr高表达的信号通路,而Pax3可能是此通路上的调节分子之一。

B16细胞在1640培养基 + 10%胎牛血清条件下分别培养0、24、48、72、96 h,经MTT 孵育后在酶联免疫监测仪上测定490 nm光吸收值(OD值)。细胞数量与OD490 nm值成正比B16 cells were cultured in 1640 medium+10% FBS for 0,24,48,72 and 96 h.The OD(optical density) values at 490 nm were examined in Enzyme immunoassay instrument after incubation with MTT at each time point.The cell counts are indicated by the OD value at 490 nm at each time point图3 B16细胞增殖曲线Fig.3 The proliferation curve of the B16 cell line by MTT method

细胞抽提物用于定量PCR检测,GAPDH为内参基因,应用2-△△Ct 法计算增殖与分化条件下B16细胞的基因相对表达。目的基因的相对含量表示为“均值±标准差”(n=3).** .P<0.01;***.P<0.001Cell lysates were used for gene expression by qPCR.Gene expression was quantified relative to GAPDH expression using the 2-△△Ct method.The data are shown as the “mean±SD”(n=3).**.P<0.01;***.P<0.001图4 Pax3、Mitf、Tyr mRNA在增殖与分化的B16细胞中的表达分析Fig.4 The mRNA levels of Pax3,Mitf and Tyr in the proliferating and differentiating B16 cells
3 讨 论
动物的毛发、皮肤和眼睛的颜色均由黑色素的相对数量、性质和分布所决定。黑色素细胞不仅负责在膜限制的细胞器(黑素体)内合成黑色素,而且负责把黑素体运输到周围的表皮细胞(角质细胞)。哺乳动物和鸟类存在着显著不同的两种黑色素:即真黑色素(Eumelanin)和伪黑色素(Pheomelanin),而酪氨酸激酶(Tyr)是色素合成过程中的限速酶。杨舒黎等研究发现,乌骨绵羊肌肉、血浆Tyr酶活性显著高于非乌质表型的绵羊,表明Tyr基因与绵羊乌质性状有关[13-14]。高莉等研究发现,棕色羊驼皮肤TyrmRNA的表达量是白色羊驼的13.669倍[15]。对禽类的研究也发现,黑色羽衣鹌鹑Tyr基因表达量要显著高于浅色羽衣鹌鹑[16]。S.Makpol等研究表明,抗氧化剂维生素E处理显著下调了人皮肤色素细胞Tyr、Tyrp1 与Tyrp2基因的表达,进而抑制色素生成[17]。而己烯雌酚可通过cAMP-PKA上调Tyr,增加了B16细胞的黑色素生成[18]。此外,人胚胎肾细胞(HEK293)过表达Tyr也会出现着色加深[19]。这些研究充分暗示,Tyr高表达是动物机体组织黑色素沉积的重要前提条件。本研究发现,酉州乌羊(乌黑色皮肤)皮肤Tyr表达量显著高于野生型(白色皮肤),进一步佐证了以上推论。但究竟是哪些因子影响了绵羊和山羊黑色素生成通路导致Tyr表达升高,促进了黑色素的合成与沉积?还有待于进一步研究。
尽管Mitf是黑色素细胞发育和黑素色生成通路中的重要调节因子[20],其突变可导致人[20-21]、小鼠[21-23]以及水貂[24]的听觉、皮肤或毛发组织的色素沉积异常。然而,本研究从体内和体外分析中均未检测到MitfmRNA表达量的显著变化。本研究发现,Mitf的上游调控基因Pax3 mRNA在乌羊皮肤组织中高丰度表达(图2),Pax3不但是黑色素细胞保持干细胞状态的关键基因[5],而且还调控着细胞的迁移行为[8,25-26]。近年来研究发现,Pax3不仅在黑色素肿瘤中表达,而且也在人类正常皮肤组织的黑色素细胞中广泛表达[27-28],说明正常皮肤组织中也存在着部分处于未分化状态或增殖状态的黑色素细胞。此外,本研究的体外试验(图3)也显示,Pax3表达显著下调是B16细胞分化并产生黑色素的重要前提条件。这些结果表明,与非乌皮羊相比,酉州乌羊皮肤组织存在着更多的未分化或者正处于增殖状态的黑色素细胞。这种黑色素细胞数量上的差异可能与乌羊皮肤组织Pax3与Tyr高表达有关。C.D.Faraco 等的研究发现,胚胎期成黑素细胞迁移路线的不同导致了乌骨鸡与白来航鸡多个组织间黑色素沉积的巨大差异[29]。朱芷葳等研究发现,Pax3在有色被毛羊驼皮肤中表达量要显著高于白色被毛羊驼[30],暗示着Pax3可能参与了黑色素细胞的迁移、增殖和分化。本研究的组织形态学与基因表达分析结果也暗示,酉州乌羊与渝东白山羊皮肤黑色素细胞迁移路线可能存在差异,但其具体的分子机制有待于进一步深入研究。
4 结 论
在皮肤发育分化的早期阶段,酉州乌羊与渝东白山羊黑色素细胞的迁移路线可能存在差异;Pax3下调与Tyr上调是B16细胞分化生成黑色素的必要条件;酉州乌羊皮肤黑色素高度沉积与Pax3、Tyr的大量表达有关。
[1] 蒋 婧,黄勇富,周 鹏,等.6月龄酉州乌羊公羔的屠宰性能及肉质理化特性研究[J].中国草食动物科学,2014(z1):306-308.
JIANG J,HUANG Y F,ZHOU P,et al.Carcass performance and meat physicochemical properties of 6-month old male lamb in Youzhou dark-skin goat[J].ChinaHerbivoreScience,2014(z1):306-308.(in Chinese)
[2] 刘良佳,周 鹏,王高富,等.酉州乌羊生产性能研究[J]. 畜禽业,2014(6):32-34. LIU L J,ZHOU P,WANG G F,et al.Study on growth performance in Youzhou dark-skin goat[J].LivestockandPoultryIndutry,2014(6):32-34.(in Chinese)
[3] 王高富,黄勇富,罗 艺,等.重庆三个地方品种山羊生长发育和肉用性能的比较研究[J].中国草食动物,2008,28(4):45-47. WANG G F,HUANG Y F,LUO Y,et al.The study on the performance of the growth and carcass quality in the three native goat breeds in chongqing[J].ChinaHerbivores,2008,28(4):45-47.(in Chinese)
[4] 王高富,黄勇富,周 鹏,等.酉州乌羊生理生化指标测定[J]. 中国草食动物科学,2012(z1):384-386. WANG G F,HUANG Y F,ZHOU P,et al.Assay of the physiological and biochemical index in blood of Youzhou dark-skin goat[J].ChinaHerbivoreScience,2012(z1):384-386.(in Chinese)
[5] LANG D,LU M M,HUANG L,et al.Pax3 functions at a nodal point in melanocyte stem cell differentiation[J].Nature,2005,433(7028):884-887.
[6] DJIAN-ZAOUCHE J,CAMPAGNE C,REYES-GOMEZ E,et al.Pax3(GFP),a new reporter for the melanocyte lineage,highlights novel aspects of PAX3 expression in the skin[J].PigmentCellMelanomaRes,2012,25(5):545-554.
[7] KUBIC J D,YOUNG K P,PLUMMER R S,et al.Pigmentation PAX-ways:the role of Pax3 in melanogenesis,melanocyte stem cell maintenance,and disease[J].PigmentCellMelanomaRes,2008,21(6):627-645.
[8] MEDIC S,ZIMAN M.PAX3 across the spectrum:from melanoblast to melanoma[J].CritRevBiochemMolBiol,2009,44(2-3):85-97.
[9] HORNYAK T J,HAYES D J,CHIU L Y,et al.Transcription factors in melanocyte development:distinct roles for Pax-3 and Mitf[J].MechDev,2001,101(1-2):47-59.
[10] YASUMOTO K,YOKOYAMA K,SHIBATA K,et al.Microphthalmia-associated transcription factor as a regulator for melanocyte-specific transcription of the human tyrosinase gene[J].MolCellBiol,1994,14(12):8058-8070.
[11] YASUMOTO K,YOKOYAMA K,TAKAHASHI K,et al.Functional analysis of microphthalmia-associated transcription factor in pigment cell-specific transcription of the human tyrosinase family genes[J].JBiolChem,1997,272(1):503-509.
[12] 任航行.Texel与乌珠穆沁绵羊妊娠中、后期胎儿骨骼肌基因表达谱及组织学分析[D].北京:中国农业科学院,2010. REN H X.Profiles of gene expression and histological analysis in fetal skeletal muscle between Texel and Ujumqin sheep(Ovisaries) during The second half of gestation[D].Beijing:Chinese Academy of Agricultural Sciences,2010.(in Chinese)
[13] 杨舒黎,毛华明,舒 文,等.云南乌骨绵羊乌质性状与TYR基因多态性的相关分析[J]. 遗传,2006,28(3):291-298. YANG S L,MAO H M,SHU W,et al.Melanin traits of Yunnan black bone sheep andTYRgene polymorphism[J].Hereditas(Beijing),2006,28(3):291-298.(in Chinese)
[14] DENG W D,XI D M,GOU X,et al.Pigmentation in Black-boned sheep(Ovis aries):association with polymorphism of the Tyrosinase gene[J].MolBiolRep,2008,35(3):379-385.
[15] 高 莉,董常生,赫晓燕,等.羊驼酪氨酸酶基因家族在不同毛色个体中的基因表达水平[J]. 畜牧兽医学报,2008,39(7):895-899. GAO L,DONG C S,HE X Y,et al.Gene expression levels of alpaca tyrosinase gene family in individuals of different colors[J].ActaVeterinariaetZootechnicaSinica,2008,39(7):895-899.(in Chinese)
[16] XU Y,ZHANG X H,PANG Y Z.Association of Tyrosinase(TYR) and Tyrosinase-related protein 1(TYRP1) with melanic plumage color in Korean quails(Coturnixcoturnix)[J].Asian-AustraJAnimSci,2013,26(11):1518-1522.
[17] MAKPOL S,JAM F A,RAHIM N A,et al.Comparable down-regulation of TYR,TYRP1 and TYRP2 genes and inhibition of melanogenesis by tyrostat,tocotrienol-rich fraction and tocopherol in human skin melanocytes improves skin pigmentation[J].ClinTer,2014,165(1):e39-45.
[18] JIAN D,JIANG D,SU J,et al.Diethylstilbestrol enhances melanogenesis via cAMP-PKA-mediating up-regulation of tyrosinase and MITF in mouse B16 melanoma cells[J].Steroids,2011,76(12):1297-1304.
[19] LU Z R,SEO E,YAN L,et al.High-throughput integrated analyses for the tyrosinase-induced melanogenesis:microarray,proteomics and interactomics studies[J].JBiomolStructDyn,2010,28(2):259-276.
[20] LEVY C,KHALED M,FISHER D E.MITF:master regulator of melanocyte development and melanoma oncogene[J].TrendsMolMed,2006,12(9):406-414.
[21] NISHIMURA E K,GRANTER S R,FISHER D E.Mechanisms of hair graying:incomplete melanocyte stem cell maintenance in the niche[J].Science,2005,307(5710):720-724.
[22] LERNER A B,SHIOHARA T,BOISSY R E,et al.A mouse model for vitiligo[J].JInvestDermatol,1986,87(3):299-304.
[23] STEINGRIMSSON E,MOORE K J,LAMOREUX M L,et al.Molecular basis of mouse microphthalmia(mi) mutations helps explain their developmental and phenotypic consequences[J].NatGenet,1994,8(3):256-263.
[24] MARKAKIS M N,SOEDRING V E,DANTZER V,et al.Association of MITF gene with hearing and pigmentation phenotype in Hedlund white American mink(Neovisonvison)[J].JGenet,2014,93(2):477-481.
[25] BERLIN I,DENAT L,STEUNOU A L,et al.Phosphorylation of BRN2 modulates its interaction with the Pax3 promoter to control melanocyte migration and proliferation[J].MolCellBiol,2012,32(7):1237-1247.
[26] CONWAY S J,HENDERSON D J,COPP A J.Pax3 is required for cardiac neural crest migration in the mouse:evidence from the splotch(Sp2H) mutant[J].Development,1997,124(2):505-514.
[27] HE S,YOON H S,SUH B J,et al.PAX3 Is extensively expressed in benign and malignant tissues of the melanocytic lineage in humans[J].JInvestDermatol,2010,130(5):1465-1468.
[28] MEDIC S,ZIMAN M.PAX3 expression in normal skin melanocytes and melanocytic lesions(naevi and melanomas)[J].PLoSONE,2010,5(4):e9977.
[29] FARACO C D,VAZ S A,PASTOR M V,et al.Hyperpigmentation in the Silkie fowl correlates with abnormal migration of fate-restricted melanoblasts and loss of environmental barrier molecules[J].DevDyn,2001,220(3):212-225.
[30] 朱芷葳,贺俊平,于秀菊,等.PAX3转录因子在羊驼皮肤组织中的表达和定位分析[J]. 畜牧兽医学报,2012,43(5):729-734. ZHU Z W,HE J P,YU X J,et al.Expression and location analysis of PAX3 transcription factor in alpaca skin[J].ActaVeterinariaetZootechnicaSinica,2012,43(5):729-734.(in Chinese)
(编辑 郭云雁)
The Characteristic Histomorphology of Various Skin Colors and Expression of Genes Involved in Melanogenesis in Goats
REN Hang-xing1,2,WANG Gao-fu1,2,LU Jian3,LI Jie1,4, JIANG Jing1,2,LIU Liang-jia1,2,ZHOU Peng1,2*
(1.ChongqingAcademyofAnimalSciences,Rongchang402460,China;2.ChongqingEngineeringResearchCenterforGoat,Rongchang402460,China;3.NationalCenterforPreservationandUtilizationofAnimalGeneticResources,NationalAnimalHusbandryService,Beijing100193,China; 4.CollegeofAnimalScienceandTechnology,GansuAgriculturalUniversity,Lanzhou730070,China)
The objective of this study was to elucidate the characteristics in histomorphology and the potential molecular mechanisms underlying the dermal hyperpigmentation in Youzhou Dark-skin goat.First,we analyzed the characteristics of histomorphology in 100 d-fetal skin in Youzhou Dark-skin goat(dark skin) and Yudong White goat(normal skin).Then we examined the mRNA expression ofPax3,MitfandTyrin skin and B16 cells in the 2 breeds.The results showed that:1) There were significant differences in the skin pigmentation between breeds at fetus skin rapid development stage;2) The skin mRNA levels ofPax3 andTyrwere significantly higher in Youzhou Dark-skin goat than that in Yudong White goat(P<0.001),whereas no significant difference was observed inMitfexpression between the 2 breeds(P>0.05);3) The expression ofPax3 was decreased(P<0.001),Tyrwas increased(P<0.01) during the B16 cell differentiation,as compared with the proliferating B16 cells.The results indicate that:1) There might be diversity in migration pathway of the dermal melanocytes between the dark-skin and normal skin goats during the early stage of skin development differentiation;2) Downregulation ofPax3 and upregulation ofTyrare indispensible for melanogenesis in melanocytes;3) The high expression ofPax3 andTyrare associated with the dermal hyperpigmentation in Youzhou Dark-skin goat.
Youzhou Dark-skin goat;dermal pigmentation;histomorphology;gene expression
10.11843/j.issn.0366-6964.2015.09.006
2015-03-04
重庆市基本科研业务费项目(2012cstc-jbky-00907;2014cstc-jbky-00106);重庆市农发资金项目(14412)
任航行(1974-),男,陕西户县人,副研究员,博士,主要从事羊遗传育种研究,E-mail:rhxe@163.com
*通信作者:周 鹏,副研究员,E-mail:cqzp2006@163.com
S827;S813.3
A
0366-6964(2015)09-1525-07

