不同浓度蜜炙紫菀水煎剂对大肠癌LOVO细胞增殖和周期的影响
杨映映 秦甜甜 钱树树 彭 林 刘莉嘉 白松棉 王如峰 蒋 燕 胡秀华
(北京中医药大学,北京,100029)
不同浓度蜜炙紫菀水煎剂对大肠癌LOVO细胞增殖和周期的影响
杨映映 秦甜甜 钱树树 彭 林 刘莉嘉 白松棉 王如峰 蒋 燕 胡秀华
(北京中医药大学,北京,100029)
目的:探讨不同浓度蜜炙紫菀水煎剂对大肠癌LOVO细胞增殖、周期的影响。方法:光学显微镜下观察蜜炙紫菀水煎剂对LOVO细胞形态的影响;利用MTT观察药物处理后对LOVO细胞的生长增殖情况的影响;采用流式细胞术检测蜜炙紫菀水煎剂对大肠癌LOVO细胞增殖周期的影响。结果:光学显微镜和MTT结果发现,低浓度的蜜炙紫菀水煎剂(≤20 mg·mL-1)对大肠癌LOVO细胞的增殖具有明显的促进作用,增殖率可达到99.7%;光学显微镜下可见细胞生长状态良好,细胞死亡少。高浓度的蜜炙紫菀水煎剂(>20 mg·mL-1)对大肠癌LOVO细胞的增殖具有明显的抑制作用,抑制率达到80.34%以上;光学显微镜下可见细胞的形态改变,细胞大量死亡。流式细胞术结果显示,蜜炙紫菀水煎剂可以使大肠癌LOVO细胞周期各个时相(G1期、S期和G2期)的细胞所占百分数发生改变。10 mg·mL-1和20 mg·mL-1的蜜炙紫菀水煎剂使S期中细胞所占的百分数增加;30 mg·mL-1蜜炙紫菀水煎剂使S期细胞所占的百分数明显减少,G2期细胞百分数明显增加。结论:蜜炙紫菀水煎剂对大肠癌LOVO细胞增殖的作用是双向的,低浓度(≤20 mg·mL-1)的蜜炙紫菀水煎剂具有明显的促进LOVO细胞增殖作用;高浓度(>20 mg·mL-1)的蜜炙紫菀水煎剂对大肠癌LOVO细胞的增殖具有明显的抑制作用,且可能是通过G2期阻滞来抑制大肠癌LOVO细胞增殖的,这为大肠癌的临床治疗提供了新的思路。
大肠癌LOVO细胞;蜜炙紫菀水煎剂;细胞增殖;细胞周期
大肠癌包括结肠癌和直肠癌,是常见的消化道恶性肿瘤之一,严重威胁着人类的健康。目前,在全世界范围内大肠癌的发病率男女均处于恶性肿瘤第3位,其中西方发达国家大肠癌的发病率处于第2位。且随着生活水平的提高,饮食结构的变化,大肠癌的发病率呈上升的趋势。手术治疗作为大肠癌治疗的首选方法,5年生存率仅在50%左右。近年来随着吻合器的广泛应用及各种新式化疗药物的出现,国际上很多学者建议采用在手术的基础上辅助以化疗、放疗、同步放化疗、生物治疗和中医药治疗等在内的一系列综合治疗手段[1]。紫菀为菊科植物,味苦、辛、甘,性微温,归肺经。功效润肺、化痰、止咳,可用于咳嗽有痰诸证。在中医学中将大肠癌分为气滞血瘀、痰浊阻滞、湿热蕴毒等类型,说明大肠癌的发生与痰浊关系密切,紫菀或可通过其化痰功效对大肠癌的发生产生抑制作用。现代研究[2-7]显示,紫菀中的一些化学成分,如表木栓醇、环状五肽(AstinA、B、C)、卤代环状五肽Asterin(2)、紫菀多糖、槲皮素、大黄素、微量元素(Ca、Mn、Se、Fe、Cu、Mn、Mo)均具有抗肿瘤活性。本实验基于中医“肺与大肠相表里”的理论,依据紫菀的化痰功效及其现代研究,采用细胞培养、MTT法以及流式细胞术来探讨入肺经的中药蜜炙紫菀对大肠癌LOVO细胞增殖和周期的影响,为深入研究蜜炙紫菀治疗大肠癌提供实验基础。
1 资料
1.1 药品及试剂 胎牛血清(Gibco,美国),F-12K培养基(Gibco),0.25%胰蛋白酶(Hyclone公司),生理盐水,碘化丙啶(PI,Sigma公司),RNA酶(Sigma公司),3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐噻唑蓝(MTT,Sigma公司),二甲基亚砜(DMSO,Sigma公司)。蜜炙紫菀(同仁堂)购自北京中医药大学国医堂门诊部;LOVO细胞购自北京协和医学院基础学院细胞中心。
1.2 仪器 倒置显微镜(OLYMPUS日本),酶标仪(Bio-Tek美国),流式细胞仪(BD美国),CO2培养箱(BINDER德国),96孔细胞培养板、细胞培养瓶(Corning公司)。
2 方法
2.1 药物制备 将同仁堂生产的蜜炙紫菀用精密电子天平秤取60 g,按照常规中药煎煮方法煎煮。待煎至约100 mL时将煎剂倒入150 mL的烧杯中,用培养皿盖住烧杯口(此烧杯和培养皿均经无离子水浸泡、高压灭菌),进行浓缩,直至30 mL。然后将其转移至超净工作台,转移至无菌离心管进行1 000 r/min离心,取上清液。取少许上清液加入培养基,置37 ℃,5% CO2的培养箱内静置培养以检菌。24 h后观察培养基,结果显示无菌后,密闭保存上清液备用。制取的蜜炙紫菀水煎剂浓度为2 g·mL-1,作为原液。
2.2 细胞培养及光学显微镜下观察 结肠癌LOVO细胞株由北京协和医学院基础学院细胞中心提供,用含10%胎牛血清的F-12K培养基,置37 ℃,5%CO2的培养箱内静置培养,取对数生长期的LOVO细胞以每孔1.3×105·mL-1接种于96孔细胞培养板中,每孔100 μL,置37 ℃,5%CO2的培养箱内培养24 h后换液,加入含不同质量浓度蜜炙紫苑水煎剂的培养基(终浓度分别为5、10、20、40、50、60、70、80 mg·mL-1),同时设置阴性对照孔,每个组设6个平行孔,继培养48 h后,光学显微镜下观察细胞的形态和密度。
2.3 MTT法测定蜜炙紫菀水煎剂对LOVO细胞的增殖和抑制作用 取对数生长期的LOVO细胞以每孔1.3×105·mL-1接种于96孔细胞培养板中,每孔100 μL,置37 ℃,5%CO2的培养箱内培养24 h后换液,加入含不同质量浓度蜜炙紫苑水煎剂的培养基(终浓度分别为0.2、0.8、3.2、5、6.4、10、20、40、50、60、70、80 mg·mL-1),同时设置阴性对照孔,每个组设6个平行孔,继续培养48 h后每孔加入质量浓度为5 g·mL-1的MTT溶液100 μL,继续培养4 h,弃上清,每孔加入150 μL DMSO,摇床震荡10 min,放入酶标仪上测定570 nm处的光吸收值,计算细胞生长增殖率和抑制率,细胞增殖率(%)=(实验组平均吸光度值-对照组平均吸光度值)/对照组平均吸光度值×100%;抑制率(%)=(1-实验组平均吸光度值/对照组平均吸光度值)×100%。
2.4 流式细胞仪检测细胞增殖周期 将对数生长期的LOVO细胞以2×105个·mL-1接种于25 cm2培养瓶中,待80%细胞汇合成片后,弃培养瓶中液体,实验组加入不同浓度的蜜炙紫菀水煎剂,终浓度分别为10、20、30 mg·mL-1,并设立对照组,置于37 ℃,5%CO2培养箱中培养48 h后,收集细胞;用冷生理盐水洗涤细胞(1 000 r/min,5 min),弃上清液,加入4 ℃预冷的75%乙醇,于4 ℃固定过夜。取固定好的细胞,用4 ℃生理盐水洗两次,分别加入50 μg·mL-1的PI和50 μg·mL-1的RNA酶1∶1混合液1 mL,避光10 min后上机检测分析细胞的增殖周期。
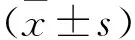
3 结果
3.1 光学显微镜下不同浓度的蜜炙紫菀水煎剂对LOVO细胞生长状态的影响 实验结果如图1所示,对照组LOVO细胞大小均匀,形态完好,细胞膜舒展,未见细胞核固缩,死亡细胞较少,细胞生长状态良好;不同质量浓度的蜜炙紫菀水煎剂处理LOVO细胞48 h后,LOVO细胞的形态与对照组相比,5 mg·mL-1、10 mg·mL-1、20 mg·mL-1蜜炙紫菀水煎剂组细胞大小均匀,密度较大,形态完好,细胞膜舒展,生长状态良好;其他质量浓度处理组(40 mg·mL-1、50 mg·mL-1、60 mg·mL-1、70 mg·mL-1、80 mg·mL-1)发现LOVO细胞有不同程度的细胞形态改变,细胞中空泡增加,细胞体积变小,细胞间隙变大,细胞变圆透亮,细胞膜皱缩,可见不同程度的细胞脱落,同时发现随着蜜炙紫菀水煎剂的质量浓度的增高,LOVO细胞生长状态越差,细胞死亡越多。

图1 不同质量浓度紫菀水煎剂作用大肠癌LOVO细胞48 h后对其形态的影响
3.2 低浓度蜜炙紫菀水煎剂对大肠癌LOVO细胞的生长具有促进作用 分别用不同浓度的蜜炙紫菀水煎剂处理细胞(终浓度分别为0.2 mg·mL-1、0.8 mg·mL-1、3.2 mg·mL-1、5 mg·mL-1、6.4 mg·mL-1、10 mg·mL-1、20 mg·mL-1),同时设立对照组。MTT结果如表1所示,与对照组相比,在质量浓度为0.2~10 mg·mL-1之间的蜜炙紫菀水煎剂处理细胞48 h后,发现对LOVO细胞的增殖具有明显的促进作用,且随着质量浓度的增加,促进增殖的能力越强,增值率分别是5.45%,10.82%,19.40%,23.96%,40.88%,99.70%,在10 mg·mL-1时增值率达到最高99.70%,统计学分析显示P<0.01,差异具有统计学意义。蜜炙紫菀水煎剂浓度达到20 mg·mL-1时增值率由10 mg·mL-1的99.70%降低到36.56%,但和对照组相比P<0.01,差异具有统计学意义。MTT结果和我们在倒置显微镜下观察到的细胞生长状态相符。
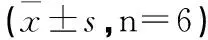
表1 MTT测定蜜炙紫菀水煎剂对大肠癌LOVO细胞的增殖的影响
注:与空白对照组相比,*P<0.05;**P<0.01。
3.3 高浓度蜜炙紫菀水煎剂对LOVO细胞增殖的影响 如3.2结果中表1所示,与对照组相比,在质量浓度20 mg·mL-1之前,蜜炙紫菀水煎剂对LOVO的增殖有明显的促进作用,并且在10 mg·mL-1时达到峰值。然后利用终浓度分别为40 mg·mL-1、50 mg·mL-1、60 mg·mL-1、70 mg·mL-1、80 mg·mL-1的蜜炙紫菀水煎剂处理细胞48 h后,MTT结果显示如表2所示,与对照组相比,不同浓度实验组均对LOVO细胞的生长增殖有不同程度的抑制,抑制率分别为80.34%、89.50%、90.76%、90.80%、94.90%,统计学分析显示P<0.01,与对照组相比差异具有统计学意义。MTT结果和我们在倒置显微镜下观察到的细胞生长状态相符。
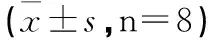
表2 MTT法测定蜜炙紫菀水煎剂对LOVO细胞的抑制情况
注:与空白对照组相比,*P<0.05;**P<0.01。
3.4 流式细胞术检测蜜炙紫菀水煎剂对LOVO细胞周期的影响 流式细胞术分析结果如表3与图2所示,0、10、20、30 mg·mL-1蜜炙紫菀水煎剂作用48 h后,随着质量浓度的增加细胞增殖周期中的三个时期G1期、S期和G2期的细胞所占百分数有不同的改变,其中G1期细胞所占的百分数平均值分别为74.50%、73.84%、58.91%、56.12%,经T检验发现与对照组差异有统计学意义(P<0.05)。S期中细胞所占百分数平均值分别为14.04%、23.86%、18.98%、11.82%。经T检验后发现与对照组相比差异具有统计学意义(P<0.01);G2期中细胞所占百分数平均值分别是10.46%、5.64%、23.78%、32.26%,与对照组相比P<0.01,具有统计学意义。

表3 流式细胞术检测LOVO细胞周期中各时相所占百分数
注:与空白对照组相比,*P<0.05;**P<0.01。

图2 不同质量浓度的蜜炙紫菀水煎剂对LOVO细胞周期中各期细胞百分数的影响
4 讨论
研究发现多种祛湿化痰药物可以用于肺癌的治疗,其中,紫菀水提物能选择性地抑制荷S180小鼠肿瘤生长[8-9];紫菀多糖能抑制胃癌细胞SGC-7901的增殖和生长,诱导SCG-7901细胞株的凋亡[10];Du L等[11]从紫菀提取物中分离纯化得到一种多聚糖类物质,命名为ATP-2,该物质能抑制神经胶质瘤C6的增殖。
本实验基于紫菀的化痰功效和抗肿瘤活性,探讨蜜炙紫菀水煎剂对大肠癌LOVO细胞增殖的影响。实验结果表明蜜炙紫菀水煎剂对大肠癌LOVO细胞增殖的作用是双向的,低浓度的蜜炙紫菀水煎剂(≤20 mg·mL-1)对大肠癌LOVO细胞的增殖具有明显的促进作用,并在10 mg·mL-1时促进作用最明显,达到了99.70%;高浓度的蜜炙紫菀水煎剂(>20 mg·mL-1)对大肠癌LOVO细胞的增殖有明显的抑制作用,在40 mg·mL-1时抑制率即可以达到80.34%,光学显微镜下可见细胞的形态改变,细胞大量死亡。50~80 mg·mL-1的蜜炙紫菀水煎剂和40 mg·mL-1蜜炙紫菀水煎剂对大肠癌细胞的抑制率差异没有统计学意义(P>0.05)。由此确定蜜炙紫菀水煎剂在质量浓度20~40 mg·mL-1的范围内对大肠癌细胞具有细胞毒性,可以抑制大肠癌细胞的增殖。
从中草药中提取的抗肿瘤药物,其细胞毒性作用的主要机制是诱导细胞周期阻滞和细胞凋亡。抗肿瘤药物可以通过诱导细胞周期阻滞而抑制细胞增殖[12]。一个完整的细胞周期包括间期(G1期、S期和G2期)和分裂期(M期),药物可使细胞周期阻滞在不同时期,包括G1期阻滞、G1/S期阻滞、G2期阻滞和G2/M期阻滞等。研究发现抗肿瘤药物常通过引起肿瘤细胞DNA损伤而导致细胞周期阻滞。有DNA损伤的细胞常被阻滞在G1期,防止受损的DNA进入S期复制;或被阻滞在G2期,以防止在M期进行异常分裂[13]。p53基因与G1期阻滞关系密切,缺失p53的肿瘤细胞不能启动G1期关卡,因而在抗肿瘤药物使肿瘤细胞DNA受损后主要表现为G2期阻滞[14]。而在所有肿瘤细胞中,50%以上有p53基因功能缺陷[15]。这种情况下,G2期阻滞就成了抗肿瘤药物使肿瘤细胞发生周期阻滞的重要途径。本实验研究发现蜜炙紫菀水煎剂可以使大肠癌LOVO细胞周期各个时相(G1期、S期和G2期)的细胞所占百分数发生改变。与对照组相比,10 mg·mL-1和20 mg·mL-1蜜炙紫菀水煎剂实验组细胞周期中S期中细胞所占百分数增加,具有统计学意义,说明细胞增殖处于旺盛时期,这与光学显微镜结果及MTT结果相一致。但是30 mg·mL-1蜜炙紫菀水煎剂实验组细胞周期中S期细胞所占百分数较对照组明显减少,G2期细胞百分数明显增加,细胞增殖周期可能停滞在G2期,这表明蜜炙紫菀水煎剂对大肠癌LOVO细胞的增殖的抑制作用,可能是通过G2期阻滞来完成的,由此我们推断G2期可能是蜜炙紫菀水煎剂作用于大肠癌LOVO细胞的治疗靶点。蜜炙紫菀水煎剂导致大肠癌细胞G2期阻滞是否和p53的表达相关,是我们进一步的研究重点。
由上可知,中药紫菀在剂量范围20~40 mg·mL-1内对大肠癌LOVO细胞的增殖具有抑制作用。在低浓度时(≤20 mg·mL-1)对大肠癌具有明显的促进增殖作用,在高浓度(>20 mg·mL-1)时对抑制大肠癌LOVO细胞的增殖具有明显的抑制作用,并且很可能将其阻滞在G2期。这为中医临床用药剂量的选择提供了生物学基础,但其作用于大肠癌LOVO细胞的分子机制仍有待深入探讨。
[1]江陈,常家聪.大肠癌的治疗方法研究进展[J].安徽医药,2012,16(2):247.
[2]房慧勇,单高威,秦桂芳,等.紫菀的化学成分及其药理活性研究进展[J].医学研究与教育,2012,29(5):73-74.
[3]王惠丽,胡子有,苑召虎,等.槲皮素抗肿瘤机制的研究进展[J].热带医学杂志,2013,13(1):126-128.
[4]孙桂斌,张萌,严方,等.大黄素抗肿瘤活性及相关机制研究进展[J].药学进展,2013,37(6):248.
[5]G.Bibi,Ihsan-ul-Haq,N.Ullah,A.Mannan and B.Mirza,Antitumor,cytotoxic and antioxidant potential of Aster thomsonii extracts[J].African Journal of Pharmacy and Pharmacology,2011,5(2):252-258.
[6]Xavier CP,Lima CF,Preto A,et al.lutelin,Quercetin and ursolic acid are potent inhibitor of proliferation and inducers of apoptosis in both KRAS and BRAF mutated human colorectal cancer cells[J].Cancer Letter,2009(281):62-70.
[7]彭文静,辛蕊华,任丽花,等.紫菀化学成分及药理作用研究进展[J].动物医学进展,2015,36(3):102-107.
[8]阮广欣,周蕾.调理气机法在肺癌治疗中的应用[J].辽宁中医杂志,2010,37(3):442-443.
[9]贺志安,马兴科,白素平.紫菀水提取物体内抗肿瘤作用[J].新乡医学院学报,2006,23(4):332-334.
[10]Zhang Yunxin,Wang Qiusheng,WANG Tie,et al.Inhibition of human gastric carcinoma cell growth in vitro by a polysaccharide from Aster tataricus[J].Int J Biol Macromol,2012,51(4):509-513.
[11]Du L,Mei H F,Yin X,et al.Delayed growth of glioma by a polssaccharide from Aster tataricus involve upregulaition of Bax/Bcl-2 ratio,activation of caspase-3/8/9,ang downregulation of the Akt[J].Tumor Biol,2014,27(6):1308-1310.
[12]李梅影.蟾毒灵通过诱导细胞凋亡和细胞周期阻滞在胰腺癌细胞中发挥抗肿瘤作用[D].山东:山东大学医学院,2014.
[13]王洪鹏,叶琳,王驰.粉防己碱与抗肿瘤药物相互作用对HNE-1细胞周期的影响[J].中国中医急症,2010,19(3):482.
[14]惠周光,李晔雄,杨伟志,等.UCN-01去除放射后肿瘤细胞G2期阻滞及其相关机制[J].癌症,2005,24(1):5.
[15]王宏梅,陈龙华.不同辐射敏感性鼻咽癌细胞株间G2期阻滞的比较[J].实用医学杂志,2010,26(22):410.
(2015-01-16收稿 责任编辑:张文婷)
Effects of Honey-fried Radix Asteris Decoction(HFRAD) on Cell Proliferation and Cell Cycle of Colorectal Cancer LOVO Cells
Yang Yingying, Qin Tiantian,Qian Shushu, Peng Lin, Liu Lijia, Bai Songmian, Wang Rufeng, Jiang Yan, Hu Xiuhua
(BeijingUniversityofChineseMedicine,Beijing100029,China)
Objective:To explore the efficacy honey-fried Radix asteris decoction (HFRAD) of different concentration on cell cycle and proliferation of colorectal cancer LOVO cells.Methods:The changes of cellular morphology of LOVO cells treated with different concentration HFRAD were observed by optical microscopy. MTT colorimetric assay was applied to observe proliferation of LOVO cells; flow cytometry was used to analyze cell cycle of LOVO cells. Results:MTT results indicated that proliferation of LOVO cells treated with low concentration HFRAD(≤20mg·mL-1)has been obviously promoted, and the cell proliferation rate could be up to 99.7%. Moreover, normal cellular morphology and membrane structure were observed by optical microscopy. Compared with the low concentration groups, it was found that cell proliferation of LOVO cells treated with high concentration HFRAD (>20mg·mL-1) was obviously inhibited, the cell inhibitor rate can be up to above 80.34%. Optical microscopy results indicated that LOVO cells treated with high concentration HFRAD had lowest cell viability and the number of normal morphology cells can be significantly reduced. Flow cytometry results showed that the proportions of G1, S and G2 phase cells vary from different concentration HFARD and were significantly different from the control group. The proportion of S phase LOVO cells increased when treated with 10 and 20mg·mL-1HFRAD. However, it was also found that the proportion of S phase LOVO cells decreased and the proportion of G2 phase increased with 30mg·mL-1HFRAD. Conclusion:Different concentrate HFRAD has distinct efficacy on cell proliferation and cell cycle of LOVO cells. Cell proliferation of LOVO cells can be significantly promoted in concentration of HFRAD(≤20mg·mL-1). However, high concentration HFRAD(>20mg·mL-1) can inhibit cell proliferation. Moreover, inhibition of G2 phase might be due to high concentration HFRAD. Our findings can provide experimental evidences for HFRAD in clinical therapy of Colorectal cancer.
Colorectal cancer LOVO cells; Honey-fried Radix asteris decoction (HFRAD); Cell proliferation; Cell cycle
国家级大学生创新创业训练计划课题——基于“肺与大肠相表里”理论研究紫菀及其提取物对大肠癌细胞增殖和迁移的影响(编号:20131002602);国家自然基金面上项目(编号:81274044)
胡秀华(1975.05—),女,博士后,副教授,研究方向:中西医结合基础,Tel:(010)64286976,E-mail:xiuhuahu@126.com;蒋燕,女,博士,教授,研究方向:中医基础理论
R285.5
A
10.3969/j.issn.1673-7202.2015.11.032

