enJSRV囊膜蛋白及其受体的瞬时表达与绵羊绒毛膜滋养层细胞融合的诱导研究
张宇飞,石 晶,刘淑英,2*
(1.内蒙古农业大学兽医学院,呼和浩特 010018;2.农业部动物临床诊疗技术重点实验室,呼和浩特 010018)
enJSRV囊膜蛋白及其受体的瞬时表达与绵羊绒毛膜滋养层细胞融合的诱导研究
张宇飞1,石 晶1,刘淑英1,2*
(1.内蒙古农业大学兽医学院,呼和浩特 010018;2.农业部动物临床诊疗技术重点实验室,呼和浩特 010018)
旨在深入研究内源性绵羊肺腺瘤病毒(enJSRV)囊膜蛋白在绵羊胎盘形成过程中的作用,本研究体外培养了蒙古绵羊绒毛膜滋养层细胞,采用RT-PCR技术扩增出enJSRV-env基因及其受体Hyal2基因全长序列,定向克隆于真核表达载体pEGFP-C1上。优化绒毛膜滋养层细胞电转染条件和测定电转效率。将构建好的真核表达质粒分别电转染到绒毛膜滋养层细胞中,在荧光显微镜下观察enJSRV囊膜蛋白及其受体Hyal2的瞬时表达情况。并研究高表达enJSRV-env基因及通过RNA干扰沉默enJSRV-env基因对绒毛膜滋养层细胞的细胞融合活性的影响。结果显示,真核表达质粒构建成功,分别命名为pEGFP-C1/enJSRV-env及pEGFP-C1/Hyal2。研究表明,绵羊绒毛膜滋养层细胞最佳电转染条件为脉冲电压150 V,脉冲时间5.0 ms,电击2次,间隔50 ms。转染pEGFP-C1/enJSRV-env质粒及pEGFP-C1/enJSRV-env与pEGFP-C1/Hyal2共转染的绵羊绒毛膜滋养层细胞中多核细胞数目明显增加,平均每个视野分别可以观察到1.8和2.3个多核细胞。说明enJSRV-env对绒毛膜滋养层细胞的细胞融合有一定的促进作用。本研究为进一步探究enJSRV囊膜蛋白的结构和功能及绒毛膜滋养层细胞融合机理提供试验基础。
内源性绵羊肺腺瘤病毒;内源性逆转录病毒;囊膜蛋白;绒毛膜滋养层细胞;细胞融合
内源性逆转录病毒(Endogenous retrovirus,ERVs)在数百万年前整合到哺乳动物基因组中[1-2],并遵照孟德尔法则遗传给下一代[2]。ERVs被认为是古代的外源性逆转录病毒感染宿主进化后形成的[2-3]。ERVs已经大量地侵入到所有动物的基因组中。在人类基因组中约占8%[4],牛的基因组约占18%[5]。完整的ERV与外源性逆转录病毒共享基因组结构,包含4个基因,分别为gag、pro、pol和env,两侧是长末端重复序列(LTR)[2,6]。在绵羊的基因组中至少包含有27个拷贝的ERVs,且与外源性绵羊肺腺瘤病毒(Exogenous jaagsiekte sheep retrovirus,exJSRV)高度相似,将其命名为内源性绵羊肺腺瘤病毒(enJSRVs)[2,7]。exJSRV是绵羊传染性肺肿瘤性疾病的病原[8],属β-逆转录病毒。exJSRV与其它致癌逆转录病毒不同之处:它的囊膜糖蛋白(ENV)是体内和体外诱导细胞发生转化的主要因素[9]。有研究发现,enJSRV在母羊生殖道上皮细胞内大量且特异性表达,对生殖发育及抵御外源性逆转录病毒的侵入可能发挥重要作用[10-11]。目前众多学者认为,绵羊单核滋养外胚层细胞(Mononuclear trophoblastic cell,MTC)在enJSRV囊膜蛋白及其受体透明质酸酶2(Hyaluronidases 2,Hyal2)的相互作用下分化、移行,之后通过核内复制或融合作用形成滋养外胚层巨型双核细胞,继续融合形成多核合胞体,最终形成胎盘的子叶[2,11-14]。这也说明绵羊内源性反转录病毒enJSRV囊膜蛋白在妊娠过程中可能发挥了重要作用。
本研究采用RT-PCR技术从蒙古绵羊绒毛膜滋养层细胞中扩增出enJSRV-env及Hyal2基因全长,同时定向克隆于真核表达载体pEGFP-C1上。由于前期研究发现原代培养的绒毛膜滋养层细胞利用脂质体进行转染的转染效率较低[11],所以笔者优化了绒毛膜滋养层细胞电转染条件,并测定了电转效率。将构建好的融合蛋白真核表达质粒分别电转染到绒毛膜滋养层细胞中瞬时表达。同时在荧光显微镜下观察高表达enJSRV-env基因及通过RNA干扰沉默enJSRV-env基因的绒毛膜滋养层细胞的细胞融合情况,通过统计学方法分析细胞核数量变化情况。为进一步探讨enJSRV囊膜蛋白的结构和功能及其细胞融合机理提供研究基础。
1 材料与方法
1.1 试验动物与样品的采集
妊娠中期蒙古羊的胎盘绒毛膜组织由内蒙古呼和浩特市屠宰场提供。
1.2 主要试剂
DMEM高糖培养基、胰蛋白酶从HyClone公司购买;胎牛血清(Gibco公司);PrimeScript One Script RT-PCR Kit Ver.2试剂盒(大连宝生物工程有限公司);Phusion高保真DNA聚合酶(Thermo公司);质粒小提、凝胶回收及RNA提取试剂盒(天根生化科技(北京)有限责任公司);pEGFP-C1真核表达载体(Invitrogen公司);E.coliDH5α感受态细胞(天根生化科技(北京)有限责任公司)[11,15]。
1.3 绵羊绒毛膜滋养层细胞培养
取妊娠44~50 d、正常的新鲜子宫体,快速送到实验室。用70%酒精清洗整个子宫,用镊子将6~7个与母体肉阜相连的胚胎子叶分开并剪下,用含双抗的D-PBS清洗6~8遍。用眼科剪充分剪碎绒毛组织成糊状。以0.25%胰蛋白酶液与0.1%胶原酶Ⅰ液(含0.1 g胶原酶Ⅰ的100 mL PBS用0.22 μm的过滤器除菌),于37 ℃恒温水浴锅内消化30 min,200目筛网过滤后,将滤液800 r·min-1离心10 min,用完全培养基(80 mL高糖DMEM培养基中加入20 mL FBS和1 mL双抗)重悬,将终浓度为1×105mL-1细胞接种于培养瓶内[2,16-17]。
1.4 引物设计
根据enJSRV的全基因组序列(No.:AF153615),利用Primer Primer 5.0软件,在囊膜基因区域设计1对enJSRV-env的引物(预期扩增产物大小1 836 bp)。上下游引物分别加入酶切位点KpnⅠ和BamH Ⅰ。引物:上游引物(env-GFPU):5′-AAGGTACCATGCCGAAGCGCCG-3′,下游引物(env-GFPL):5′-AAGGATCCTCACGGGTCG-TCCC-3′。根据Hyal2的mRNA序列(No.:NM_001009754.1),利用Primer Primer 5.0软件,在Hyal2基因区域设计1对引物(预期扩增产物大小1 443 bp)。上下游引物分别加入酶切位点HindⅢ和BamHI。引物:上游引物(Hyal2-GFPU):5′-TTAAGCTTCGATGTGGACAGG-3′,下游引物(Hyal2-GFPL):5′-AAGGATCCTTACGAAGTCCAGGTG-3′。引物在Invitrogen公司合成。
1.5 总RNA的提取与处理
当绵羊绒毛膜滋养层细胞汇合度为70%~80%时,按照微量RNA提取试剂盒说明书,提取细胞总RNA,利用分光光度计和1.0%变性琼脂糖凝胶电泳检测RNA的纯度及完整性。利用TaKaRa公司的PrimeScript One Script RT-PCR Kit Ver.2试剂盒将总RNA反转录为cDNA,-20 ℃保存备用[2,11]。
1.6 enJSRV-env及Hyal2基因的扩增
以cDNA为模板,使用引物env-GFPU、env-GFPL、Hyal2-GFPU、Hyal2-GFPL和Phusion高保真DNA聚合酶,按常规方法进行PCR扩增。反应条件:98 ℃ 5 min;98 ℃ 30 s,63 ℃ 30 s,72 ℃ 2 min,35个循环;72 ℃ 10 min。PCR扩增产物经琼脂糖凝胶电泳鉴定[15]。
1.7 pEGFP-C1/enJSRV-env及pEGFP-C1/Hyal2真核表达质粒的构建
上述PCR产物分别经1.0%的琼脂糖凝胶电泳鉴定并回收。利用限制性内切酶KpnⅠ和BamH Ⅰ对纯化后的enJSRV-env基因与真核表达载体pEGFP-C1同时进行双酶切,琼脂糖凝胶电泳鉴定并回收。同时利用限制性内切酶HindⅢ和BamH Ⅰ对纯化后的Hyal2基因与真核表达载体pEGFP-C1同时进行双酶切并回收。回收后的目的基因片段和经同样双酶切的真核表达载体pEGFP-C1进行连接并转化。提取重组质粒后,用PCR、单双酶切鉴定,连接成功后将阳性菌液送到Invitrogen公司测序。测序鉴定正确后用去内毒素质粒中提试剂盒提取质粒[15]。所得到的重组真核表达质粒分别命名为pEGFP-C1/enJSRV-env和pEGFP-C1/Hyal2。
1.8 绵羊绒毛膜滋养层细胞电转染效率的测定
将培养第7天的原代绵羊绒毛膜滋养层细胞,采用0.25%的胰酶消化得到单个细胞。用预热的Opti-MEM培养液清洗细胞两次,将密度调整为1×107mL-1。取100 μL细胞悬液(约1×106个细胞)并加入10 μg pEGFP-C1质粒DNA轻轻混匀,转移到0.1 cm的电击杯中。按照NEPA21高效基因转染系统说明书设置电转参数,电转完成后将细胞悬液接种到含有预热的完全培养基的6孔板内,48 h后观察绿色荧光蛋白表达情况。为筛选原代绵羊绒毛膜滋养层细胞的最优电转染条件,先按照NEPA21高效基因转染系统说明书内12套电转参数(表1),进行电转染,通过荧光显微镜下计数法来确定不同电转条件下细胞转染率。细胞转染率=(发绿色荧光的细胞数/存活细胞数)×100%。筛选出最优条件后,用于后续试验。
1.9 pEGFP-C1/enJSRV-env及pEGFP-C1/Hyal2在绵羊绒毛膜滋养层细胞中的瞬时表达
待原代绵羊绒毛膜滋养层细胞生长至70%~80%时,按照最优电转染条件分别转染真核表达质粒pEGFP-C1/enJSRV-env及pEGFP-C1/Hyal2。同时设立空质粒pEGFP-C1转染的细胞作为阴性对照。转染48 h后,4%的多聚甲醛固定,DAPI染细胞核,在荧光显微镜下观察enJSRV 囊膜蛋白及受体透明质酸酶2(Hyal2)在原代绵羊绒毛膜滋养层细胞的表达情况[15]。
1.10 enJSRV-env基因在绵羊绒毛膜滋养层细胞中表达上调及下调后细胞融合情况
按照最优电转染条件,将真核表达质粒pEGFP-C1/enJSRV-env、pEGFP-C1/Hyal2、pcDNA6.2-GW/EmGFP-miR/enJRSV-env-shRNA分别转入对数生长期的原代绵羊绒毛膜滋养层细胞中[11]。同时将pEGFP-C1/enJSRV-env与pEGFP-C1/Hyal2共转染到对数生长期的原代绵羊绒毛膜滋养层细胞中。将空质粒pEGFP-C1转染的原代绵羊绒毛膜滋养层细胞作为阴性对照。电转染后将细胞接种到含有盖玻片的6孔板内。48 h后,利用4%的多聚甲醛固定细胞,DAPI染细胞核,在荧光显微镜下观察并记录绵羊绒毛膜滋养层双核及多核细胞的数目[15]。随机取5个视野进行计数,采用算术均值进行统计。
表1 12套电转参数
Table 1 Twelve sets of electroporation parameters used in the experiment
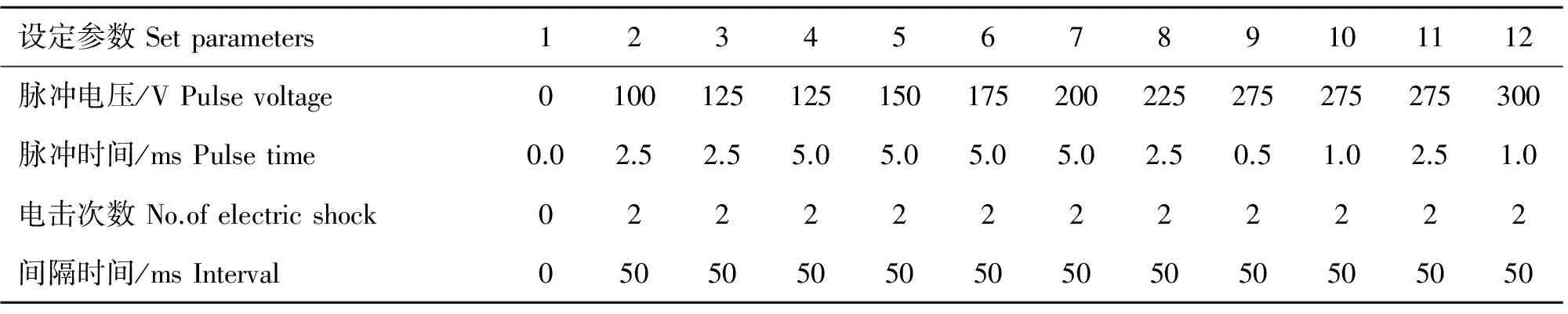
设定参数Setparameters123456789101112脉冲电压/VPulsevoltage0100125125150175200225275275275300脉冲时间/msPulsetime0.02.52.55.05.05.05.02.50.51.02.51.0电击次数No.ofelectricshock022222222222间隔时间/msInterval05050505050505050505050
2 结 果
2.1 enJSRV-env及Hyal2基因的扩增
RT-PCR扩增的产物分别经1%琼脂糖凝胶电泳显示,在约1 836与1 443 bp处分别有一明显扩增条带,与预期的目的基因enJSRV-env及Hyal2大小一致(图1)。
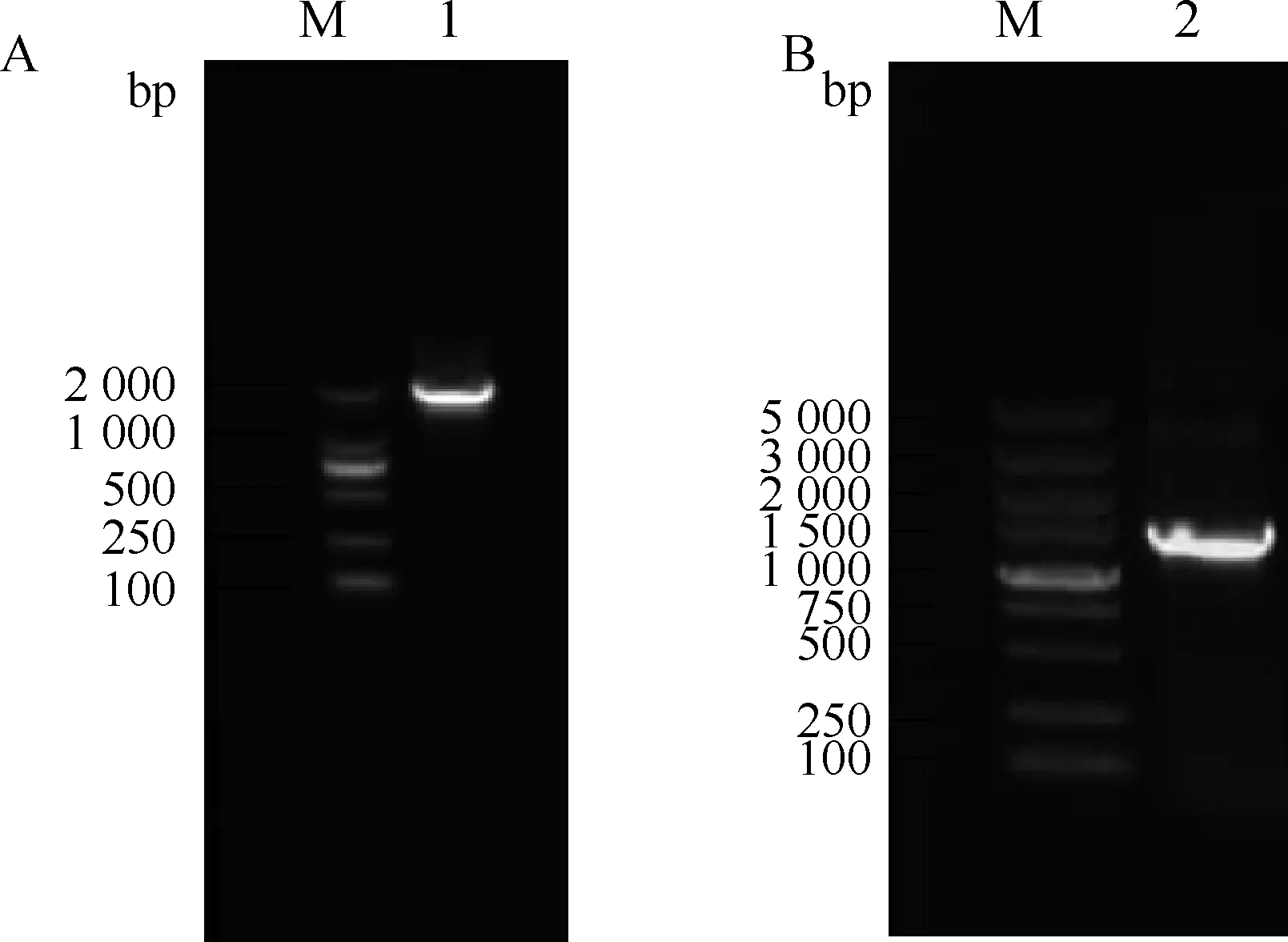
M.DNA相对分子质量标准;1.enJSRV-env基因扩增产物;2.Hyal2基因扩增产物M.DNA marker;1.PCR product of enJSRV-env;2.PCR product of Hyal2图1 enJSRV-env和Hyal2基因的扩增Fig.1 Amplification of enJSRV-env and Hyal2 genes
2.2 真核表达质粒pEGFP-C1/enJSRV-env及pEGFP-C1/Hyal2的构建与鉴定
将经PCR扩增的目的基因enJSRV-env与真核细胞表达载体pEGFP-C1分别利用限制性内切酶KpnⅠ和BamH Ⅰ进行双酶切。利用T4 DNA连接酶过夜连接,构建重组质粒pEGFP-C1/enJSRV-env。经PCR、BamH Ⅰ单酶切、KpnⅠ和BamH Ⅰ双酶切鉴定结果(图2)显示pEGFP-C1/enJSRV-env质粒构建初步成功,然后进一步进行核苷酸序列测定,结果显示插入pEGFP-C1的enJSRV-env基因的读码框架和插入方向均正确。
将PCR扩增的目的基因Hyal2与真核细胞表达载体pEGFP-C1分别用限制性内切酶HindⅢ和BamH Ⅰ进行双酶切。利用T4 DNA连接酶过夜连接,构建重组质粒pEGFP-C1/Hyal2。经PCR、BamH Ⅰ单酶切、Hind Ⅲ和BamH Ⅰ双酶切鉴定结果(图3),表明pEGFP-C1/Hyal2质粒构建初步成功,然后进一步进行核苷酸序列测定,结果显示插入pEGFP-C1的Hyal2基因的读码框架和插入方向均正确。
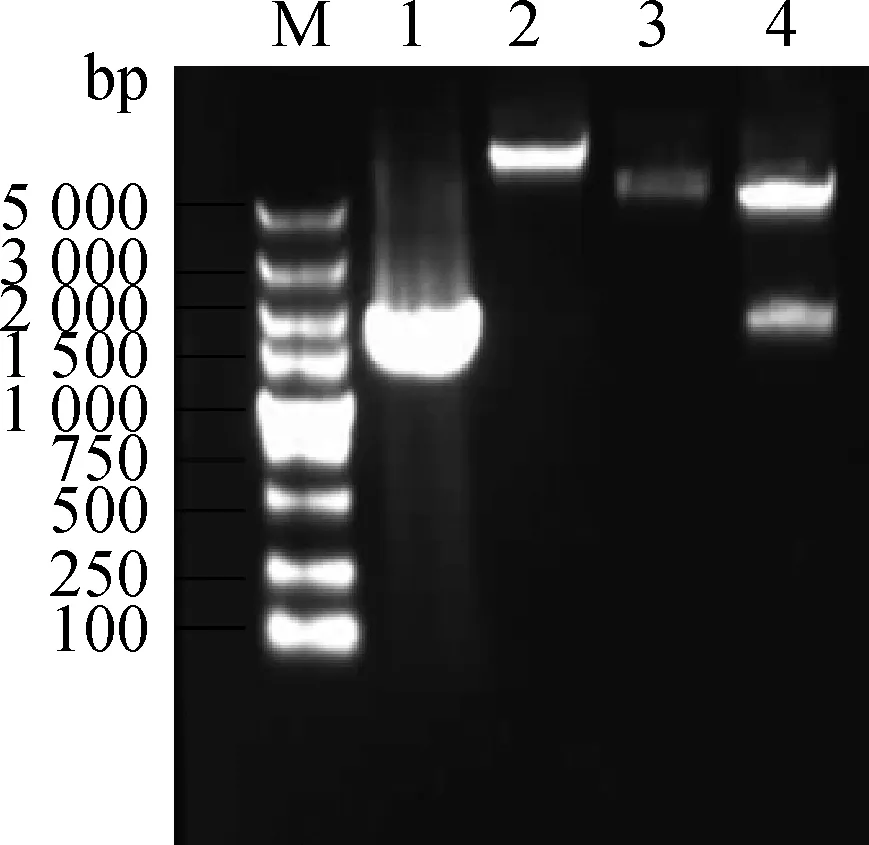
M.DNA相对分子质量标准(DL5000);1.enJSRV-env基因扩增产物;2.BamH Ⅰ单酶切pEGFP-C1/enJSRV-env重组质粒;3.BamH Ⅰ单酶切pEGFP-C1空质粒;4.BamH Ⅰ和Kpn Ⅰ双酶切pEGFP-C1/enJSRV-env重组质粒M.DNA marker(DL5000);1.PCR product of enJSRV-env;2.Digested product of pEGFP-C1/enJSRV-env with BamH Ⅰ;3.Digested product of pEGFP-C1 with BamH Ⅰ;4.Digested product of pEGFP-C1/enJSRV-env with BamH Ⅰ and Kpn Ⅰ图2 重组质粒pEGFP-C1/enJSRV-env单双酶切鉴定Fig.2 Identification of recombinant plasmid pEGFP-C1/enJSRV-env by single and double restriction endonuclease digestion
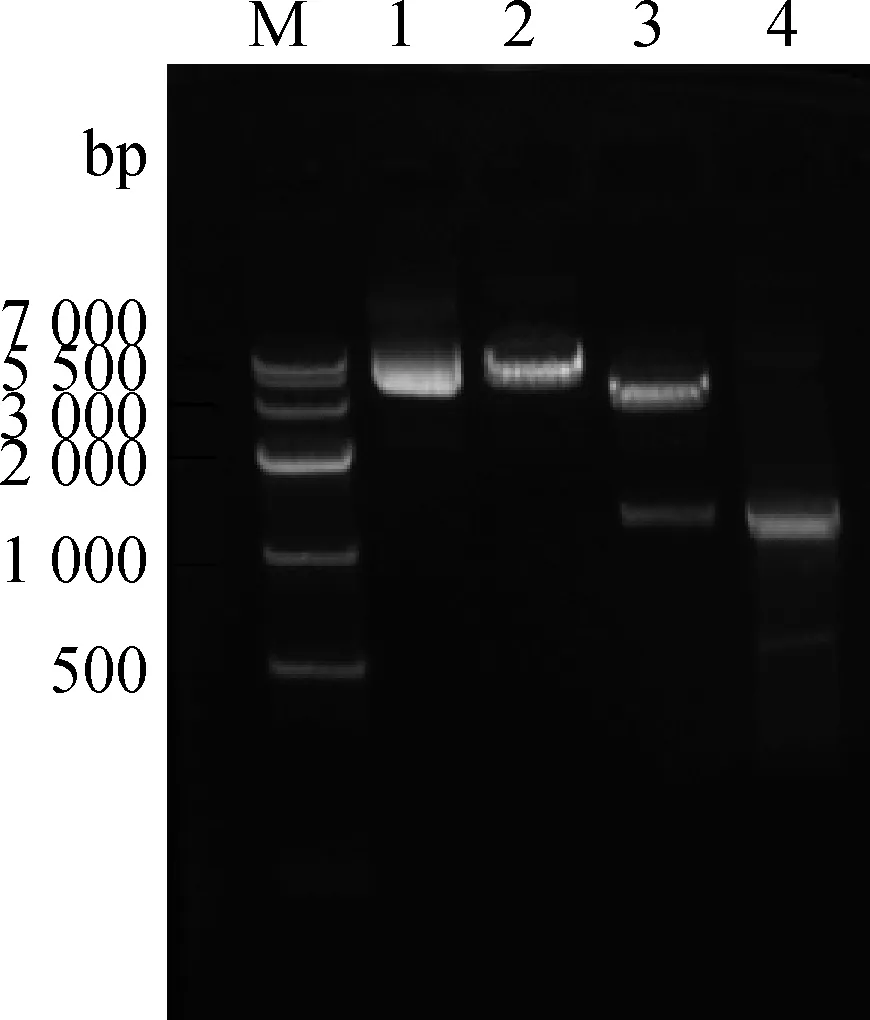
M.DNA相对分子质量标准(DL7000);1.BamHⅠ单酶切pEGFP-C1空质粒; 2.BamHⅠ单酶切pEGFP-C1/Hyal2重组质粒;3.BamH Ⅰ和Hind Ⅲ双酶切pEGFP-C1/Hyal2重组质粒;4.Hyal2基因扩增产物M.DNA marker(DL7000);1.Digested product of pEGFP-C1 with BamH Ⅰ;2.Digested product of pEGFP-C1/Hyal2 with BamH Ⅰ;3.Digested product of pEGFP-C1/Hyal2 with BamH Ⅰ and Hind Ⅲ;4.PCR product of Hyal2图3 重组质粒pEGFP-C1/Hyal2单双酶切鉴定Fig.3 Identification of recombinant plasmid pEGFP-C1/Hyal2 by single and double restriction endonuclease digestion
2.3 绵羊绒毛膜滋养层细胞电转染条件的确立
按照NEPA21高效基因转染系统说明书内12套电转染参数进行电转染,电转染完成后将细胞悬液接种到含有预热的完全培养基的6孔板内,48 h后观察绿色荧光蛋白表达情况,通过荧光显微镜下计数,确定不同电转条件下的细胞转染率。程序1为对照组,加入10 μg pEGFP-C1质粒DNA,但不进行电转染(图4A和4B)。随着脉冲电压的增大,细胞转染效率不断升高,同时细胞死亡率也在增高。在程序5(脉冲电压150 V,脉冲时间5.0 ms,电击次数2次,间隔时间50 ms)时绵羊绒毛膜滋养层细胞的电转染效率最高,约87.53%(图4C和4D)。再增加脉冲电压后细胞的死亡率达到60%以上(图4E和4F),故将程序5定为绵羊绒毛膜滋养层细胞的最佳电转染条件,用于后续试验。
2.4 enJSRV-env及Hyal2在绵羊绒毛膜滋养层细胞中瞬时表达
将转染重组质粒pEGFP-C1/enJSRV-env、pEGFP-C1/Hyal2和对照空载体pEGFP-C1 48 h后的绵羊绒毛膜滋养层细胞用4%的多聚甲醛固定及DAPI染细胞核。荧光显微镜下发现转染pEGFP-C1空质粒的细胞在细胞质和细胞核内都有大片的绿色荧光(图5A3);转染pEGFP-C1/enJSRV-env质粒的细胞质内有弥散的绿色荧光,在细胞膜上围绕一圈浅绿色荧光,细胞核中有少量的绿色荧光显现(图5B3);转染pEGFP-C1/Hyal2质粒的细胞质内有弥散的点状绿色荧光(图5C3)。表明enJSRV-env在绵羊绒毛膜滋养层细胞表达后,囊膜蛋白主要分布于细胞膜和细胞质内,而受体透明质酸酶2主要分布于细胞质内的细胞器上。
2.5 enJSRV-env及Hyal2在绵羊绒毛膜滋养层细胞融合过程中的作用
将真核表达质粒pEGFP-C1/enJSRV-env、pEGFP-C1/Hyal2、pcDNA6.2-GW/EmGFP-miR /enJRSV-env-shRNA按照最佳电转染条件分别转入对数生长期的原代绵羊绒毛膜滋养层细胞中。转染48 h后,用4%的多聚甲醛固定后再用DAPI进行细胞核染色。结果在荧光显微镜下可以观察到双核滋养层细胞(图6A3)、三核滋养层细胞(图6B3)、多核滋养层细胞(图6C3)。在荧光显微镜下分别取10个视野观察绵羊三核和多核绒毛膜滋养层细胞的个数,发现转染pEGFP-C1/enJSRV-env及pEGFP-C1/enJSRV-env与pEGFP-C1/Hyal2共转染的绵羊绒毛膜滋养层细胞中多核细胞数目明显增加,平均每个视野分别可以观察到1.8和2.3个多核细胞。然而转染pEGFP-C1、pEGFP-C1/Hyal2及pcDNA6.2-GW/EmGFP-miR/enJRSV-env-shRNA干扰质粒的绵羊绒毛膜滋养层细胞中多核细胞数变化不明显,平均每个视野分别可以观察到0.5、0.5和0.4个多核细胞(图7)。
3 讨 论
由于内源性逆转录病毒颗粒常常在生殖道和胎盘中观察到,S.S.Kalter等[18]推测ERVs在合体滋养层细胞形成上发挥重要的生理作用。ERVs已确定在灵长类动物[19](合胞体蛋白-1和-2)、鼠科[20](合胞体蛋白-A,-B)、兔[21](合胞体蛋白-Ory1)胎盘中存在。在人类和小鼠的合胞体蛋白(人类合胞体蛋白-1和小鼠合胞体蛋白-A)都能够诱导细胞发生融合[2,22-23]。同样在母羊的生殖道不同组织上皮中大量表达enJSRV,如在子宫内膜腔上皮和腺上皮中可检测到enJSRV mRNA[24]和蛋白[25]。在母羊整个妊娠期内,胎盘的滋养外胚层巨型双核细胞、滋养层多核合胞体与滋养层小半鞘翅也大量表达enJSRV[2,26]。enJSRV完整的囊膜基因在胎盘多核合体滋养层细胞中表达,已有几千年的历史了[2,11,27]。根据合胞体蛋白在体外诱导的细胞融合的特性,有学者提出enJSRV囊膜蛋白及其受体透明质酸酶2共同诱导绵羊胎盘多核合体滋养细胞形成假说。为了验证这一假说的真实性,笔者通过体外培养绵羊绒毛膜滋养层细胞,并从中克隆内源性绵羊肺腺瘤病毒囊膜基因及其受体透明质酸酶2基因进行功能研究。本研究发现转染pEGFP-C1/enJSRV-env质粒及pEGFP-C1/enJSRV-env与pEGFP-C1/Hyal2共转染的绵羊绒毛膜滋养层细胞中多核细胞数目明显增加,而且pEGFP-C1/enJSRV-env与pEGFP-C1/Hyal2共转染的绵羊绒毛膜滋养层细胞中多核细胞数目要比单独转染pEGFP-C1/enJSRV-env质粒的绵羊绒毛膜滋养层细胞中多核细胞数目多,这说明enJSRV囊膜蛋白与其受体透明质酸酶2共同作用促进多核绒毛膜滋养层细胞的形成。同时笔者也发现多核绒毛膜滋养层细胞要比单核及双核的绒毛膜滋养层细胞体积大而且呈圆形。然而转染pEGFP-C1/Hyal2质粒的绵羊绒毛膜滋养层细胞中多核细胞数目没有变化,这也说明受体透明质酸酶2本身并不促进绵羊绒毛膜滋养层细胞融合。转染pcDNA6.2-GW/EmGFP-miR/enJRSV-env-shRNA干扰质粒的绵羊绒毛膜滋养层细胞中多核细胞数变化不明显与转染空质粒的绵羊绒毛膜滋养层细胞基本相似。这一结果说明RNA干扰试验不在细胞核计数方法的灵敏度范围内,故不能够很好的检测到细胞融合活性的降低。本研究的结论为K.A.Dunlap等[12]提出的enJSRV囊膜蛋白及其受体透明质酸酶2共同诱导绵羊胎盘多核合体滋养细胞形成的假说提供有力的理论依据,但enJSRV囊膜蛋白及其受体透明质酸酶2共同诱导绵羊胎盘多核合体滋养细胞形成的机理还需要后续深入的研究。由于胎盘的形成与肿瘤的发生和转移的特点类似,而且enJSRV囊膜蛋白与致癌的外源性JSRV 囊膜蛋白具有高度相似性,同时JSRV与enJSRVs使用相同的受体透明质酸酶2进入细胞[11,15]。故C.Ferretti等[28]推测,内源性JSRV 囊膜蛋白利用同外源性JSRV 囊膜蛋白相似的机制,促使滋养层细胞增殖和分化。滋养层细胞比一般细胞具有较高的增殖、转移和侵入的能力,同时也可以躲避机体的免疫系统,这也是肿瘤细胞的特性。JSRV囊膜蛋白主要通过Ras-MEK-MAPK、Rac1和PI3K-AKT-mTOR 3条信号通路,使绵羊肺泡Ⅱ型上皮细胞和细支气管Clara细胞发生癌变[28-29]。Ras-MEK-MAPK、Rac1和PI3K-AKT-mTOR信号通路是在人类和啮齿类动物胎盘滋养层细胞生长和分化的重要调节通路[2,28,30]。但迄今仍没有充分的证据证明enJSRV囊膜蛋白通过Ras-MEK-MAPK、Rac1和PI3K-AKT-mTOR 3条信号通路来促使滋养层细胞的生长和分化[2]。

A、C、E为电转染48 h后绵羊绒毛膜滋养层细胞的相差显微镜照片;B、D、F为转染后表达绿色荧光蛋白的细胞A,C and E are transfected sheep trophoblast cells by electroporation after 48 h observed under phase contrast;B,D,F are transfected cells which expressing green fluorescent protein图4 电转染pEGFP-C1后的绵羊绒毛膜滋养层细胞100×Fig.4 The ovine trophoblast cells after electric transfected with pEGFP-C1 100×

A1~A3.绵羊绒毛膜滋养层细胞转染pEGFP-C1后荧光显微镜照片(A1.DAPI染核,A2.GFP绿色荧光,A3.重叠后照片);B1~B3.绵羊绒毛膜滋养层细胞转染pEGFP-C1/enJSRV-env后荧光显微镜照片(B1.DAPI染核,B2.GFP/enJSRV-env融合蛋白绿色荧光,B3.重叠后照片);C1~C3.绵羊绒毛膜滋养层细胞转染pEGFP-C1/ Hyal2后荧光显微照片(C1.DAPI染核,C2.GFP/Hyal2融合蛋白绿色荧光,C3.重叠后照片)A1-A3.The sheep trophoblast cells transfected with pEGFP-C1(A1.Cell stained with DAPI,A2.Expression of EGFP,A3.Merge);B1-B3.The sheep trophoblast cells transfected with pEGFP-C1/enJSRV-env(B1.Cell stained with DAPI,B2.Expression of GFP/enJSRV-env,B3.Merge);C1-C3.The sheep trophoblast cells transfected with pEGFP-C1/Hyal2(C1.Cell stained with DAPI,C2.Expression of GFP/Hyal2,C3.Merge)图5 enJSRV-env及Hyal2在绵羊绒毛膜滋养层细胞中瞬时表达 200×Fig.5 Transient expressions of enJSRV-env and Hyal2 gene in ovine trophoblast cells 200×
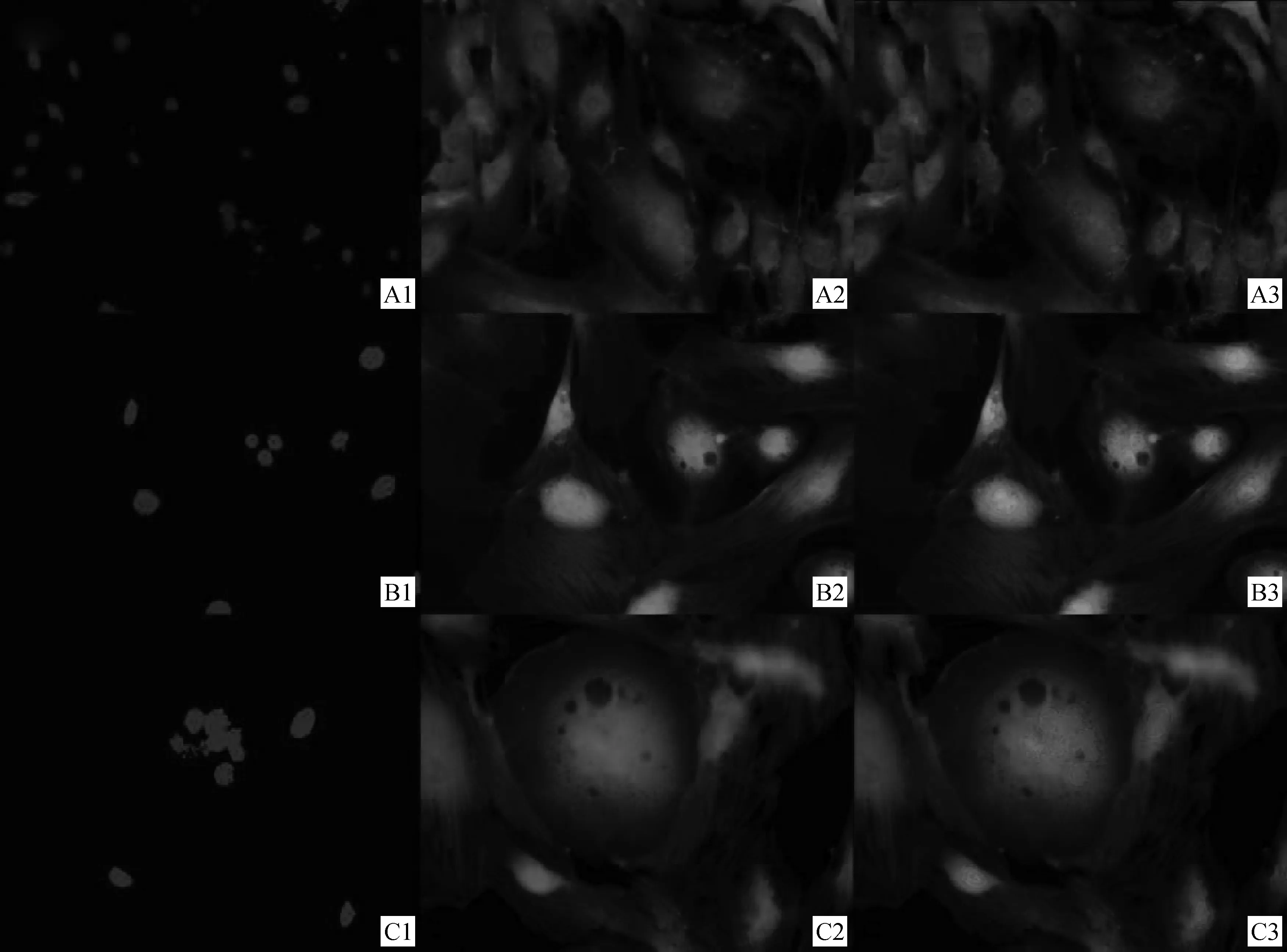
A1、B1、C1.DAPI染核;A2、B2、C2.GFP绿色荧光;A3、B3、C3.重叠后照片A1,B1,C1.Cell stained with DAPI;A2,B2,C2.Expression of GFP;A3,B3,C3.Merge图6 荧光显微镜下观察绵羊双核及多核绒毛膜滋养层细胞 200×Fig.6 Bi-and multi-nucleated trophectoderm cells in sheep observed under fluorescence microscope 200×
本研究结果表明,转染pEGFP-C1/Hyal2的绒毛膜滋养层细胞的细胞质内有弥散的点状的绿色荧光,且主要集中在细胞核周边。瞬时表达EGFP-enJSRV-env融合蛋白的绒毛膜滋养层细胞的细胞质内有弥散的绿色荧光,在细胞膜上围绕一圈浅绿色荧光,细胞核中有少量的绿色荧光显现,说明JSRV囊膜蛋白定位于细胞膜与细胞核上,这与笔者之前研究的exJSRV囊膜蛋白亚细胞定位结果相同[15]。因为enJSRV囊膜蛋白与致癌的外源性JSRV 囊膜蛋白具有高度相似性[11,15]。ERVs的生物学意义进行了几十年的辩论,通常被认为是“垃圾DNA”,因为ERVs由于突变、缺失、重排、甲基化的积累导致他们不健全的复制机制[2,31]。然而,最近的研究表明,ERVs部分基因对他们的宿主有多种有益的作用[32]。此外,ERVs部分基因保持了完整的开放阅读框(ORF),且具有转录活性,这支持了宿主通过特定的生物学功能征用了一些ERVs的想法[33]。由于在绵羊的基因组中至少包含有27个拷贝的enJSRV[7,34],故绵羊成为理想的动物模型来研究ERVs的生物学作用。本研究以绵羊绒毛膜滋养层细胞为基础克隆且表达了enJSRV-env及其受体Hyal2,同时证实了内源性绵羊肺腺瘤病毒囊膜蛋白在绵羊绒毛膜滋养层细胞融合过程可以起到一定的促进作用。
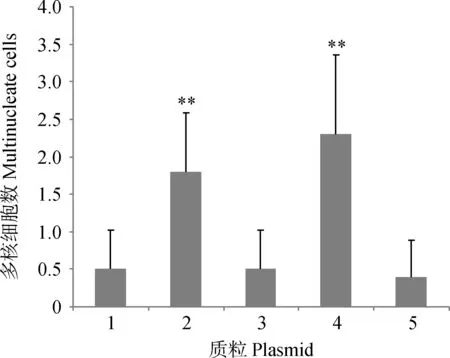
**.P<0.01。1.pEGFP-C1;2.pEGFP-C1/enJSRV-env;3.pEGFP-C1/Hyal2;4.pEGFP-C1/enJSRV-env与pEGFP-C1/Hyal2共转染;5.pcDNA6.2-GW/EmGFP-miR/enJRSV-env-shRNA**.P<0.01.1.Trophoblast cells transfected with pEGFP-C1 plasmids;2.Trophoblast cells transfected with pEGFP-C1/enJSRV-env plasmids;3.Trophoblast cells transfected with pEGFP-C1/Hyal2 plasmids;4.Trophoblast cells co-transfected with pEGFP-C1/enJSRV-env and pEGFP-C1/Hyal2 plasmids;5.Trophoblast cells transfected with pcDNA6.2-GW/EmGFP-miR/enJRSV-env-shRNA plasmids图7 绵羊绒毛膜滋养层细胞转染不同质粒后多核绒毛膜滋养层细胞的数目Fig.7 The number of multinucleated trophectoderm cells which ovine trophoblast cells transfected with different plasmids
[1] SHARP J M,DE MARTINI J C.Natural history of JSRV in sheep[J].CurrTopMicrobiolImmunol,2003,275:55-79.
[2] 张宇飞,王专家,刘淑英,等.绵羊多核绒毛膜滋养层细胞中enJSRV-env克隆与生物信息学分析[J].科技论文在线,2014:201309-245. ZHANG Y F,WANG Z J,LIU S Y,et al.Cloning and bioinformatics analysis of enJSRV-env gene of sheep multinucleated syncytiotrophoblast cells[J].SciencepaperOnline,2014:201309-245.(in Chinese)
[3] GIFFORD R,TRISTEM M.The evolution,distribution and diversity of endogenous retroviruses[J].VirusGenes,2003,26(3):291-315.
[4] LANDER E S,LINTON L M,BIRREN B,et al.Initial sequencing and analysis of the human genome[J].Nature,2001,409(6822):860-921.
[5] ADELSON D L,RAISON J M,EDGAR R C.Characterization and distribution of retrotransposons and simple sequence repeats in the bovine genome[J].ProcNatlAcadSciUSA,2009,106(31):12855-12860.
[6] SPENCER T E,PALMARINI M.Application of next generation sequencing in mammalian embryo genomics:lessons learned from endogenous betaretroviruses of sheep[J].AnimReprodSci,2012,134(1-2):95-103.[7] QI J W,XU M J,LIU S Y,et al.Identification of sheep endogenous beta-retroviruses with uterus-specific expression in the pregnant Mongolian ewe[J].JIntegrAgr,2013,12(5):884-891.
[8] PALMARINI M,SHARP J M,FAN H,et al.Jaagsiekte sheep retrovirus is necessary and sufficient to induce a contagious lung cancer in sheep[J].JVirol,1999,73(8):6964-6972.
[9] ALLEN T E,SHERRILL K J,CRISPELL S M,et al.The jaagsiekte sheep retrovirus envelope gene induces transformation of the avian fibroblast cell line DF-1 but does not require a conserved SH2 binding domain[J].JGenVirol,2002,83(11):2733-2742.
[10] 刘丽珍,刘淑英.妊娠早期蒙古绵羊子宫内膜enJSRV及IFN-τ基因表达水平的分析[J].畜牧兽医学报,2012,43(6):979-984. LIU L Z,LIU S Y.Analysis of the expression of enJSRV and IFN-τin endometrium of mongolian sheep in early pregnancy[J].ActaVeterinariaetZootechnicaSinica,2012,43(6):979-984.(in Chinese)
[11] 张宇飞,刘 月,刘淑英,等.靶向enJSRV-env基因shRNA真核表达质粒的构建及其干扰效率的测定[J].中国兽医科学,2013,43(1):53-59. ZHANG Y F,LIU Y,LIU S Y,et al.Construction of short hairpin RNA eukaryotic expression plasmids targeting enJSRV-envgene and interference efficiency detection[J].ChineseVeterinaryScience,2013,43(1):53-59.(in Chinese)
[12] DUNLAP K A,PALMARINI M,SPENCER T E.Ovine endogenous betaretroviruses(enJSRVs) and placental morphogenesis[J].Placenta,2006,27(20):135-140.
[13] 徐萌杰,陈大勇,刘淑英.妊娠绵羊子宫内膜组织内源性反转录病毒及其受体HYAL2基因表达水平的检测[J].中国兽医科学,2011,41(3):256-261. XU M J,CHEN D Y,LIU S Y.Detection of expression level of endogenous jaagsiekte sheep retrovirus and its receptor HYAL2 in endometrium of pregnant Mongolian sheep by TaqMan real-time PCR andinsituhybridization[J].ChineseVeterinaryScience,2011,41(3):256-261.(in Chinese)
[14] SPENCER T E,JOHNSON G A,BAZER F W,et al.Pregnancy recognition and conceptus implantation in domestic ruminants:roles of progesterone,interferons and endogenous retroviruses[J].ReprodFertilDev,2007,19(1):65-78.
[15] 张宇飞,刘 月,刘淑英,等.绵羊肺腺瘤病毒pEGFP-C1/exJSRV-env构建及引起NIH3T3细胞恶性转化的研究[J].病毒学报,2014,30(3):268-276. ZHANG Y F,LIU Y,LIU S Y,et al.Construction and transfection of pEGFP-C1/exJSRV-env into NIH3T3 and research on its cellular localization[J].ChineseJournalofVirology,2014,30(3):268-276.(in Chinese)
[16] 刘 慧,刘淑英,刘丽珍,等.绵羊胎盘滋养层细胞的体外培养与鉴定[J].中国兽医科学,2012,42(3):309-313. LIU H,LIU S Y,LIU L Z,et al.Culture and identification of sheep trophoblast cellsinvitro[J].ChineseVeterinaryScience,2012,42(3):309-313.(in Chinese)
[17] 王专家,张宇飞,刘淑英.绵羊多核绒毛膜滋养层细胞的分离培养与鉴定[J].细胞与分子免疫学杂志,2014,30(1):82-86. WANG Z J,ZHANG Y F,LIU S Y.Isolation,culture and identification of sheep multinucleated chorionic trophoblast cells[J].ChineseJournalofCellularandMolecularImmunology,2014,30(1):82-86.(in Chinese)
[18] KALTER S S,HEBERLING R L,HELMKE R J,et al.A comparative study on the presence of C-type viral particles in placentas from primates and other animals[J].BiolHaematol,1975(40):391-401.
[19] BLOND J L,LAVILLETTE D,CHEYNET V,et al.An envelope glycoprotein of the human endogenous retrovirus HERV-W is expressed in the human placenta and fuses cells expressing the type D mammalian retrovirus receptor[J].JVirol,2000,74(7):3321-3329.
[20] DUPRESSOIR A,MARCEAU G,VERNOCTHET C,et al.Syncytin-A and syncytin-B,two fusogenic placenta-specific murine envelope genes of retroviral origin conserved in Muridae[J].ProcNatlAcadSciUSA,2005,102(3):725-730.
[21] HEIDMANN O,VERNOCHET C,DUPRESSOIR A,et al.Identification of an endogenous retroviral envelope gene with fusogenic activity and placenta-specific expression in the rabbit:a new “syncytin” in a third order of mammals[J].Retrovirology,2009,6(1):107-118.
[22] WATSON E D,CROSS J C.Development of structures and transport functions in the mouse placenta[J].Physiology,2005,20(3):180-193.
[23] MANGENEY M,RENARD M,BOUALLAGA I,et al.Placental syncytins:genetic disjunction between the fusogenic and immunosuppressive activity of retroviral envelope proteins[J].ProcNatlAcadSciUSA,2007,104(51):20534-20539.
[24] 吴晓莉,齐景伟,刘淑英,等.Real-time PCR和组织原位杂交法检测enJSRV在绵羊胎儿免疫器官及肺脏中的表达[J].畜牧兽医学报,2010,41(8):1018-1023. WU X L,QI J W,LIU S Y,et al.Expression of enJSRV in immune organs and lung of the fetus by in situ hybridization and real-time PCR[J].ActaVeterinariaetZootechnicaSinica,2010,41(8):1018-1023.(in Chinese)
[25] PALMARINI M,GRAY C A,FAN H,et al.Expression of endogenous betaretroviruses in the ovine uterus:effects of neonatal age,estrous cycle,pregnancy and progesterone[J].JVirol,2001,75(23):11319-11327.
[26] DUNLAP K A,PALMARINI M,SPENCER T E,et al.Sheep endogenous betaretroviruses(enJSRVs) and the hyaluronidase 2(HYAL2) receptor in the ovine uterus and conceptus[J].BiolReprod,2005,73(2):271-279.
[27] SPENCER T E,MURA M,GRAY C A,et al.Receptor usage and fetal expression of ovine endogenous betaretroviruses:implications for coevolution of endogenous and exogenous retroviruses[J].JVirol,2003,77(1):749-753.
[28] FERRETTI C,BRUNI L,BELLET D,et al.Molecular circuits shared by placental and cancer cells,and their implications in the proliferative,invasive and migratory capacities of trophoblasts[J].HumReprodUpdate,2007,13(2):121-141.
[29] 张亚坤,刘淑英.绵羊肺腺瘤病毒囊膜蛋白的致癌作用研究进展[J].中国兽医科学,2012,42(12):1315-1320. ZHANG Y K,LIU S Y.Research progress in tumorigenesis of Jaagsiekte sheep retrovirus’ envelope protein[J].ChineseVeterinaryScience,2012,42(12):1315-1320.(in Chinese)
[30] POLLHEIMER J,KNOFLER M.Signalling pathways regulating the invasive differentiation of human trophoblasts:a review[J].Placenta,2005,26:S21-S30.
[31] BOCK M,STOYE J P.Endogenous retroviruses and the human germline[J].CurrOpinGenetDev,2000,10(6):651-655.
[32] JERN P,COFFIN J M.Effects of retroviruses on host genome function[J].AnnuRevGenet,2008,42:709-732.[33] KURTH R,BANNERT N.Beneficial and detrimental effects of human endogenous retroviruses[J].IntJCancer,2010,126(2):306-314.
[34] ARNAUD F,CAPORALE M,VARELA M,et al.A paradigm for virus-host coevolution:sequential counter-adaptations between endogenous and exogenous retroviruses[J].PLoSPathog,2007,3(11):1716-1729.
(编辑 程金华)
Study on the Transient Expression of enJSRV Envelope Protein and Its Receptor and the Induction of Trophoblast Cell Fusion in Sheep
ZHANG Yu-fei1,SHI Jing1,LIU Shu-ying1,2*
(1.CollegeofVeterinaryMedicine,InnerMongoliaAgriculturalUniversity,Huhhot010018,China;2.KeyLaboratoryofClinicalDiagnosisandTreatmentTechnologyinAnimalDisease,MinistryofAgriculture,Huhhot010018,China)
This paper aimed to study the possible role of endogenous jaagsiekte sheep retrovirus(enJSRV) envelope protein in sheep placenta formation process.Chorionic trophoblast cells from Mongolian sheep were culturedinvitro.RT-PCR technique was used to amplify enJSRV-envgene as well as the full-length gene of its receptorHyal2.The genes were then directionally cloned into the eukaryotic expression vector pEGFP-C1.The electric transfection conditions of the chorionic trophoblast cells were optimized and the electrical transfer efficiency was measured.The constructed eukaryotic expression plasmids were transfected into chorionic trophoblast cells by electroporation,and transient expressions of enJSRV envelope protein and its receptorHyal2 were observed under a fluorescence microscope.The activity of cell fusion in chorionic trophoblast cells under high expression and RNA interference silencing of enJSRV-envgene was also observed.The results showed that eukaryotic expression plasmids were successfully constructed and named as pEGFP-C1/enJSRV-envand pEGFP-C1/Hyal2,respectively.The best transfection conditions were pulse voltage 150 V,pulse time 5.0 ms,electric shock number for 2 times with 50 ms interval.The number of multinucleated cells were significantly increased in the trophoblast cells which co-transfected pEGFP-C1/Hyal2 with the transfection of pEGFP-C1/enJSRV-envplasmid and pEGFP-C1/enJSRV-env.We observed 2.3 and 1.8 multinucleated cells in average per field.The enJSRV-envhad a certain role in promoting the cell fusion of chorionic trophoblast cells.This study provides an experimental basis for further exploring the structure and function of enJSRV envelope protein and the fusion mechanism of chorionic trophoblast cells.
enJSRV;endogenous retroviruses;envelope protein;trophoblast cells;cell fusion
10.11843/j.issn.0366-6964.2015.11.003
2015-02-05
国家自然科学基金(31160493;31360597);内蒙古科技创新引导基金项目(20130224);教育部博士点基金博导类项目(20111515110008)
张宇飞(1988-),男,呼和浩特人,博士生,主要从事生殖内分泌及病毒病理学研究,E-mail:enjoy_zyf@163.com
*通信作者:刘淑英,教授,博士生导师,Tel:0471-4309175,E-mail:liushuying_imau@126.com
S826.2
A
0366-6964(2015)11-1924-10

