尼克酰胺对人脐带间充质干细胞的保护效应*
杨晓蕾,陈智聪,廖继东△,谷景义,于 波,刘革修(暨南大学医学院田家炳医学实验中心,血液病研究所,广东广州5063)
尼克酰胺对人脐带间充质干细胞的保护效应*
杨晓蕾1,陈智聪1,廖继东1△,谷景义1,于波1,刘革修2
(暨南大学医学院1田家炳医学实验中心,2血液病研究所,广东广州510632)
目的:探讨尼克酰胺(nicotinic acid amide,NAA)减轻人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUC-MSCs)输注损伤的效应。方法:空白对照组为0. 3 mL生理盐水、MSC组为0. 3 mL 1× 106CFSE标记的hUC-MSCs,MSC + NAA组为0. 3 mL 10 mmol/L NAA处理24 h的1×106CFSE标记的hUC-MSCs,分别与2. 7 mL正常人全血混匀,注入改良Chandler Loop内,在37℃下,20 mL/min循环1 h,检测循环前后血小板、白细胞、hUC-MSCs和C3a的变化。结果:血小板消耗率空白对照组为(29. 96±10. 88) %、MSC组为(77. 76± 19. 29) %、MSC + NAA组为(50. 13±18. 10) %;白细胞消耗率空白对照组为(37. 82±13. 81) %、MSC组为(64. 57 ±17. 08) %、MSC + NAA组为(41.52±17.26) %,MSC组和MSC + NAA组与空白对照组比较差异均有统计学意义(P<0. 05)。MSC + NAA组的hUC-MSCs存活率较MSC组高(P<0. 05)。空白对照、MSC和MSC + NAA组的C3a含量分别为(206. 27±58. 10)μg/L、(230. 47±39. 61)μg/L和(208. 37±40. 66)μg/L。结论: hUC-MSCs与正常人全血在改良Chandler Loop内共循环1 h可模拟血液介导即刻炎症反应(instant blood-mediated inflammatory reaction,IBMIR),大量损耗MSCs和血液成分,导致C3a上升。NAA可抑制IBMIR、降低血液成分的损耗、提高hUC-MSCs的存活率,提示NAA能减轻MSCs的输注损伤。
人脐带间充质干细胞;血液介导即刻炎症反应; Chandler Loop;尼克酰胺
[ABSTRACT]AIM: To investigate the effect of nicotinic acid amide (NAA) on the infusion damage of human umbilical cord mesenchymal stem cells (hUC-MSCs) under the condition of instant blood-mediated inflammatory reaction (IBMIR).METHODS: Normal peripheral blood without anticoagulant at volume of 2. 7 mL was mixed with 0. 3 mL physiological saline (as blank group),CFSE labeled hUC-MSCs (1×106cells in 0. 3 mL as MSC group) and CFSE labeled hUC-MSCs (1×106cells in 0. 3 mL) preprocessed with NAA at concentration of 10 mmol/L for 24 h (as MSC + NAA group),respectively.The mixture was immediately injected into the improved Chandler Loop model,placed in 37℃water bath,and then started the peristaltic pump at the speed of 20 mL/min for 1 h.The number of CFSE labeled hUC-MSCs,platelets,white blood cells were counted and the concentration of complement C3a was measured before and after cycling,respectively.RESULTS: After 1 h circulation,the platelet dissipation rate were (29. 96±10. 88) % in blank group,(77. 76±19. 29) % in MSC group all and (50. 13±18. 10) % in MSC + NAA group; and the leukocyte counts were (37. 82±13. 81) % in blank group,(64. 57±17. 08) % in MSC group and (41. 52±17. 26) % in MSC + NAA group.Compared with blank group,the differences of the dissipation rates in MSC group and MSC + NAA group all had statistical significance.The hUC-MSCs relative survival rate in MSC + NAA group was higher than that in MSC group.C3a concentrations in blank group,MSC group and MSC + NAA group were (206. 27±58. 10),(230. 47±39. 61) and (208. 37± 40. 66)μg/L,respectively.CONCLUSION: Co-circulating the mixture of hUC-MSCs with normal peripheral blood without anticoagulant in the improved Chandler Loop for 1 h depletes a large number of hUC-MSCs and blood components,and increases C3a,suggesting that this model can induce IBMIR.NAA has a protective effect on the hUC-MSCs in the infusion damage by inhibiting IBMIR,reducing the wastage of the blood components and enhancing the survival rate of the hUCMSCs.
[KEY WORDS]hUC-MSCs; Instant blood-mediated inflammatory reaction; Chandler Loop; Nicotinic acid amide
细胞治疗是利用患者自体(或异体)的细胞对组织、器官进行修复,已被用于白血病、癌症或肿瘤、免疫系统疾病、神经系统疾病等多种疾病的临床治疗研究,展现出诱人的应用前景[1]。随着细胞生物学,尤其是干细胞研究的深入发展和细胞工程技术的不断进步,可用于细胞治疗的细胞来源日益丰富,靶标不断拓展[2]。细胞治疗无论是细胞代替治疗,刺激治疗还是养生疗法,都必须将细胞导入机体内部的靶标部位。迄今,将各类细胞导入机体的最佳途径仍然是通过血循环系统。因此,治疗细胞进入机体首先接触的就是血液。报道证实,治疗细胞一旦接触患者的血液便可发生血液介导即刻炎症反应(instant blood-mediatedinflammatoryreaction,IBMIR)[3-4],使高达70%的输入细胞被快速破坏而丢失[5-7]。这是影响细胞治疗疗效、导致弥漫性血管内凝血(disseminated intravascular coagulation,DIC)及免疫反应的主要原因之一。间充质干细胞(mesenchymal stem cells,MSCs)因其来源广、分化增殖潜力大、免疫原性低而获得广泛关注,已被用于多项临床疾病的细胞治疗实验研究。已有报道证实MSC与受体血液接触所致IBMIR可能与其疗效低下有直接关系[8]。可见抑制MSC输注所致IBMIR是减少不良反应、提高疗效的潜在途径之一。本文利用改良的Chandler Loop模拟体内IBMIR,探讨尼克酰胺(nicotinic acid amide,NAA)减轻人脐带间充质干细胞(human umbilical cord MSCs,hUC-MSCs)输注损伤的保护效应及其机制。
材料和方法
1材料
本实验采用在暨南大学华侨医院妇产科出生的、胎龄为37~40周、无先天性疾病及梅毒、艾滋病、肝炎等传染性疾病的健康新生儿脐带,按本室已有程序制备鉴定hUC-MSCs[9-10]。供者对脐带用于实验研究均已知情同意,并获暨南大学华侨医院医学伦理委员会批准。正常人外周血取自健康自愿者(临用前采集) ; NAA购自Sigma;人补体C3a酶联免疫分析试剂盒购自广州穗硕生物有限公司。
2方法
2.1hUC-MSCs的处理和标记取0. 984 g NAA用1 L双蒸水溶解成80 mmol/L浓度的NAA溶液。将传代3~5 d、生长状态良好的hUC-MSCs用0. 25%胰蛋白酶消化1 min,1 000 r/min离心5 min收集细胞,PBS洗3次后用37℃预温的无血清DMEM/F12
配成1×1010/L,加入等体积NAA溶液(终浓度为10 mmol/L),置37℃培养箱中孵育24 h,1 000 r/min离心5 min收集细胞,PBS洗3次后调整细胞浓度至1×1010/L。取500 μg CFSE溶解于180 μL DMSO (20 g/L)配成5 mmol/L溶液储存于-20℃备用。每1 mL细胞悬液加入CFSE溶液0.8 μL,置37℃10 min,转移至4℃冰浴,加入800 μL PBS,终止反应10 min,1 000 r/min离心5 min收集细胞,PBS洗2次,用PBS调整细胞至1×109/L。
2.2改良的Chandler Loop模型构建根据Chandler Loop模型[3,11-12],结合实验目的进行改良,改良模型拟申报专利,暂时保密。
2.3IBMIR实验按表1所示,各取含1×106经0、10 mmol/L NAA预处理的、经CFSE标记的hUCMSCs细胞悬液及生理盐水300 μL与2. 7 mL新鲜正常人外周血混匀(终浓度为1×105hUC-MSCs),迅速注入改良Chandler Loop模型的环管内,以20 mL/ min的流速循环1 h。分别取1 mL用于hUC-MSCs检测和20 μL用于血细胞计数,其余血样经3 000 r/ min离心15 min分离血浆用于人C3a检测。

表1 IBMIR实验分组及实验方案Table 1.Grouping and protocol of the IBMIR experiment (n =7)
2.4白细胞、血小板计数和白细胞分类计数取血样20 μL分别加入380 μL白细胞或血小板稀释液(南京建成科技有限公司出品)中混匀,显微镜下通过血细胞计数板分别用低倍镜和高倍镜计数血小板和白细胞总数。另取一滴血样涂片,经快速瑞姬氏染色液染色,在油镜下进行白细胞分类计数。以上操作均由2位以上熟练人员在互不干扰的情况下分别独立进行计数和分类,取其计数的平均值[13]。
2.5hUC-MSCs的检测分别取NAA处理和未处理的CFSE标记的hUC-MSCs细胞悬液及PBS液100 μL与EDTA抗凝的正常人外周血900 μL混匀作为相应各组的参照(未经改良Chandler Loop模型循环)。向各实验样本及其参照中加入14 mL PBS混匀,4℃1 000 r/min离心10 min。吸去上层细胞碎片,沉淀细胞加PBS至1 mL,吹打混匀,取200 μL加入96孔萤光酶标板内,重复3孔。在TZ-CANSAFIRE-2萤光酶标仪(TZCAN)上,以490 nm激发,检测530 nm荧光度值,按下列公式计算hUC-MSCs的相对存活率。

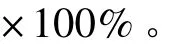
2.6C3a的检测取3 mL新鲜正常人外周血配制空白血清对照(Serum)组。按试剂盒操作指南,在96孔板上设置标准曲线及空白孔,分别加入不同浓度标准溶液50 μL及等体积样本稀释液,其余各孔分别加入样品稀释液40 μL、样品10 μL,轻摇混匀,盖上盖板,置于湿盒内37℃温育30 min;除空白孔外每孔加入酶标试剂50 μL,继续温育30 min;弃去液体并甩干,加满洗涤液静置30 s弃去,如此重复5次,拍干;加显色剂A 50 μL,混匀37℃避光显色15 min;加终止液50 μL,立即在TZ-CAN-SAFIRE-2萤光酶标仪上读取450 nm波长吸光度(A)值。以标准孔的浓度与A值计算标准曲线的直线回归方程,将样品A值代入方程并乘以稀释倍数计算样品实际浓度。
3统计学处理
实验数据用均值±标准差(mean±SD)表示,应用SPSS 13. 0统计软件进行分析,用单因素方差分析和t检验检测组间均数差异,以P<0. 05为差异有统计学意义。
结果
1NAA降低血液成分损耗率
经改良的Chandler Loop模型循环1 h后,各组血液成分的损耗情况见表2。可见加入1×106hUCMSCs(MSC组和MSC + NAA组)后血小板、粒细胞、淋巴细胞及单核细胞的损耗率(%)与空白对照组相比明显增加(P<0. 05)。经10 mmol/L NAA处理的hUC-MSCs较未经NAA处理的hUC-MSCs相比,血小板、粒细胞、淋巴细胞及单核细胞的损耗率明显下降(P<0. 05)。

表2 血液成分损耗率Table 2.The dissipation rate of the blood components (%.Mean±SD.n =7)
2NAA提高hUC-MSCs存活率
CFSE标记的hUC-MSCs的荧光检测计算结果见图1所示。可见,经10 mmol/L NAA处理较未经NAA处理的hUC-MSCs存活率高(P<0. 05)。

Figure 1.The survival rate of hUC-MSCs.Mean±SD.n = 7.*P<0. 05 vs MSC.图1 hUC-MSCs的存活率
3NAA未能抑制使血清C3a上升
经改良的Chandler Loop装置循环1 h后,各组血清经ELISA检测C3a的含量见图2所示。可见实验组(MSC组和MSC + NAA组)和空白对照组的C3a含量均明显高于空白血清对照组,差异显著(P<0. 05)。

Figure 2.The changes of serum C3a contents.Mean±SD.n = 7.*P<0. 05 vs serum.图2 血清C3a含量的变化
4 hUC-MSCs的鉴定
本实验制备的传代培养第3代hUC-MSCs呈均一的梭形成纤维细胞样聚集贴壁生长,表达CD105+/CD29+/CD44+/CD31-/CD34-/CD40-/CD45-/ HLA-DR-,可分化为成骨细胞及脂肪细胞,见图3、4。
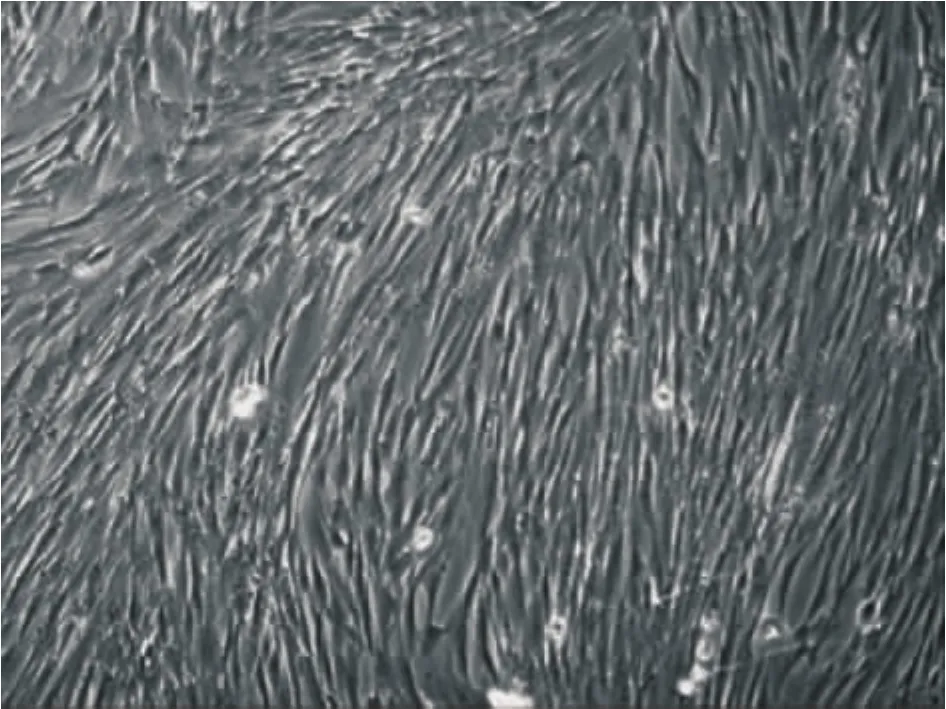
Figure 3.Morphology of human umbilical cord mesenchymal stem cells at passage 3 (×100).图3 第3代人脐带间充质干细胞形态
讨论
已知受体血小板、凝血因子和补体系统被输注的外源细胞所激活,产生C3a、Csb-9等炎症介质,在短时间内致使输入的细胞及受体的血小板、粒细胞甚至红细胞等血液成分被大量地破坏损耗,甚至可能引起DIC等致命反应是IBMIR的显著特征,是影响细胞治疗效果的重要因素之一[8,14]。IBMIR在大量消耗输注的MSC的同时,产生了大量的活化血小板。已有报道显示,活化的血小板可抑制MSC向凋亡心肌细胞的迁移,进一步降低MSC的作用[15]。
本文按照我们课题组已有程序制备鉴定hUCMSCs,传代至第3代的hUC-MSCs细胞呈均一梭形成纤维细胞样聚集贴壁生长,具有向成骨细胞及脂肪细胞分化的潜能,表型为CD105+/CD29+/ CD44+/CD31-/CD34-/CD40-/CD45-/HLA-DR-,与前期结果一致[10,16],符合首届胎盘来源干细胞国际研讨会及国际细胞治疗协会关于MSCs的最低标准[17]。改良的Chandler Loop装置根据Bennet等[3,11-12]的报道,并参考其它血液循环模型[18-21]构建。正常人非抗凝外周血经该装置循环1 h各血液成分的损耗率分别为:白细胞(37. 82±13. 81) %、粒细胞(14. 18±0. 39) %、淋巴细胞(2. 36±1. 32) %、单核细胞(30. 92±0. 22) %、血小板(29. 96±10. 88) %,与改良型Chandler Loop模型相近[3],基本满足血液体外循环实验的需求。

Figure 4.The cell surface markers of passage 3.图4 第3代hUC-MSCs细胞表型鉴定
IBMIR的特征是受体血小板、凝血系统及补体系统同时被激活,以及血液成分和输注细胞在短时间内的大量损耗[22-23]。1×108/L hUC-MSCs致使循环后各血液成分的损耗率明显上升,血清C3a含量增加显著,hUC-MSCs存活率低至(16. 51±8. 29) %,与IBMIR中受体血小板损耗,以及血细胞和输注细胞的大量破坏丢失相吻合[22-23]。提示hUC-MSCs在改良的Chandler Loop装置内与正常人血液共循环1 h产生了外源细胞输入体内所致IBMIR的基本血液学改变及靶细胞损耗[24]。
NAA是维生素B3的主要成分,参与了许多重要的生物学过程,具有抗炎和抗氧化作用[25-26],体外实验证实NAA可抑制大鼠胰岛细胞表达组织因子及MCP-1,进而抑制IBMIR所致大鼠胰岛细胞的损耗[27-29]。已有报道MSCs表达组织因子的量随传代而升高[30],且传代次数越多的MSCs输注时发生的IBMIR越强烈,提示组织因子与MSCs输注所致的IBIMR强度有关[31]。本实验中参考Jung等[32]的研究并进行预实验后选择10 mmol/L为工作浓度,实验结果显示,10 mmol/L NAA可明显降低hUC-MSCs共循环所致血液成分的损耗率,提高hUC-MSCs存活率,抑制IBMIR,提示10 mmol/L NAA对受到输注损伤的hUC-MSCs具有一定的保护作用。此外,各实验组与实验对照组C3a含量差异不明显,提示在hUCMSCs输注发生的IBMIR中补体系统激活C3a水平较弱。有关NAA对hUC-MSCs输注损伤保护作用的量效关系及其机制有待进一步探讨。
[1]万超,李刚,秦泗河.国际细胞治疗学会第十次年会纪要——细胞治疗研究进展[J].中国矫形外科杂志,2006,14(4) : 311-314.
[2]何蕊,陈舒,江其生.干细胞治疗前景的展望[J].放射免疫学杂志,2010,23(6) : 644-647.
[3]Bennet W,Sundberg B,Groth CG,et al.Incompatibility between human blood and isolated islets of Langerhans: a finding with implications for clinical intraportal islet transplantation?[J].Diabetes,1999,48(10) : 1907-1914.
[4]Soland MA,Bego M,Colletti E,et al.Mesenchymal stem cells engineered to inhibit complement-mediated damage [J].PLoS One,2013,8(3) : e60461.
[5]Eriksson O,Eich T,Sundin A,et al.Positron emission tomography in clinical islet transplantation[J].Am J Transplantation,2009,9(12) : 2816-2824.
[6]Gupta S,Rajvanshi P,Sokhi R,et al.Entry and integration of transplanted hepatocytes in rat liver plates occur by disruption of hepatic sinusoidal endothelium[J].Hepatology,1999,29(2) : 509-519.
[7]van der Windt DJ,Bottino R,Casu A,et al.Rapid loss of intraportally transplanted islets an overview of pathophysiology and preventive strategies[J].Xenotransplantation,2007,14(4) : 288-297.
[8]Moll G,Hult A,von Bahr L,et al.Do ABO blood group antigens hamper the therapeutic efficacy of mesenchymal stromal cells?[J].PLoS One,2014,9(1) : e85040.
[9]陈智聪,刘俊,廖继东,等.连续传代培养对hUCMScs上NLR家族mRNA表达的影响[J].中国病理生理杂志,2014,30(6) : 1082-1087.
[10]毛文哲,许超,李扬秋,等.长期培养的人脐带间充质干细胞PCNA、IL-6、IL-11和galectin-3的表达[J].中国病理生理杂志,2012,28(6) : 1051-1056.
[11]Goto M,Tjernberg J,Dufrane D,et al.Dissecting the instant blood-mediated inflammatory reaction in islet xenotransplantation[J].Xenotransplantation,2008,15(4) : 225-234.
[12]Goto M,Johansson H,Maeda A,et al.Low-molecular weight dextran sulfate abrogates the instant blood-mediated inflammatory reaction induced by adult porcine islets both in vitro and in vivo[J].Transplantation Proc,2004,36 (4) : 1186-1187.
[13]李家增,王鸿利,韩忠朝.血液实验学[M].上海:上海科学技术出版社,1997.35-40.
[14]Cohen Jeffrey A.Mesenchymal stem cell transplantation in multiple sclerosis[J].J Neurol Sci,2013,333(1) : 43-49.
[15]Vogel S,Chatterjee M,Metzger K,et al.Activated platelets interfere with recruitment of mesenchymal stem cells to apoptotic cardiac cells via high mobility group box 1/Tolllike receptor 4-mediated down-regulation of hepatocyte growth factor receptor MET[J].J Biol Chem,2014,289 (16) : 11068-11082.
[16]许超,廖继东,柳菁,等.长期培养人脐带间充质干细胞的生物活性及其限制性[J].中国组织工程研究与临床康复,2011,15(10) : 1750-1754.
[17]Majore I,Moretti P,Stahl F,et al.Growth and differentiation properties of mesenchymal stromal cell populations derived from whole human umbilical cord[J].Stem Cell Rev Reports,2011,7(1) : 17-31.
[18]van Oeveren W,Tielliu IF,de Hart J.Comparison of modified chandler,roller pump,and ball valve circulation models for in vitro testing in high blood flow conditions: application in thrombogenicity testing of different materials for vascular applications[J].Int J Biomaterials,2012,2012: 673163.
[19]喻琴梅,周翔,牛挺,等.体外血栓模型设计及标准化探讨[J].华西医学,2012,27(2) : 210-212.
[20]程虹,元艳宏,樊瑜波,等.体外血小板流动腔研究方法的建立和应用[J].血栓与止血学,2008,14(5) : 205-209.
[21]杨钰楠,高云华,谭开彬,等.携rgds的脂膜氟烷超声造影剂增强血栓显影的实验研究[J].临床超声医学杂志,2007,9(7) : 388-390.
[22]Bennet W,Groth CG,Larsson R,et al.Isolated human islets trigger an instant blood mediated inflammatory reaction: implications for intraportal islet transplantation as a treatment for patients with type 1 diabetes[J].Upsala J Med Sci,2000,105(2) : 125-133.
[23]Hwang JW,Jung HS,Lee DY.Inhibition of platelet adhesion onto intrahepatically transplanted islets using PEGylation for attenuating instant blood-mediated inflammatory reaction (IBMIR)[J].J Controlled Release,2011,152 (Suppl 1) : e213-e214.
[24]Nilsson B.The instant blood-mediated inflammatory reaction in xenogeneic islet transplantation[J].Xenotransplantation,2008,15(2) : 96-98.
[25]Shi Y,Zhang L,Jiang R,et al.Protective effects of nicotinamide against acetaminophen-induced acute liver injury [J].Int Immuno-Pharmacol,2012,14(4) : 530-537.
[26]Lappas M,Permezel M.The anti-inflammatory and antioxidative effects of nicotinamide,a vitamin B3derivative,are elicited by FoxO3 in human gestational tissues: Implications for preterm birth[J].J Nutr Biochem,2011,22 (12) : 1195-1201.
[28]Moberg L,Johansson H,Lukinius A,et al.Production of tissue factor by pancreatic islet cells as a trigger of detrimental thrombotic reactions in clinical islet transplantation [J].Lancet,2002,360(9350) : 2039-2045.
[29]王鑫.尼克酰胺抑制胰岛移植后IBMIR作用的研究[D].沈阳:中国医科大学,2008.
[30]Moll G,Rasmusson-Duprez I,von Bahr L,et al.Are therapeutic human mesenchymal stromal cells compatible with human blood?[J].Stem Cells,2012,30 (7) : 1565-1574.
[31]Tatsumi K,Ohashi K,Matsubara Y,et al.Tissue factor triggers procoagulation in transplanted mesenchymal stem cells leading to thromboembolism[J].Biochem Biophys Res Commun,2013,431(2) : 203-209.
[32]Jung DY,Park JB,Joo SY,et al.Effect of nicotinamide on early graft failure following intraportal islet transplantation[J].Exp Mol Med,2009,41(2) : 782-792.
(责任编辑:林白霜,余小慧)
Protective effect of nicotinic acid amide on human umbilical cord mesenchymal stem cells
YANG Xiao-lei1,CHEN Zhi-cong1,LIAO Ji-dong1,GU Jing-yi1,YU Bo1,LIU Ge-xiu2
(1Tin Ka-ping Center for Medical Experiments,2Institute of Hematology,School of Medicine,Jinan University,Guangzhou 510632,China.E-mail: tliaojd@jnu.edu.cn)
R363. 2
A
10.3969/j.issn.1000-4718.2015.10.005
1000-4718(2015)10-1756-06
2015-01-26
2015-04-27
国家自然科学基金资助项目(No.81270568)
△Tel: 020-85225841; E-mail: tliaojd@jnu.edu.cn

