对2006-2015 年美国FDA 召回的神经调控类医疗器械产品分析
王伟明 李路明 郝红伟 胡春华 刘方军 马伯志 文雄伟 清华大学航天航空学院 (北京 100084)
医疗器械召回是在发现医疗器械存在缺陷或医疗器械的使用会危及公共安全健康时所采取的行动,目的是确保医疗器械使用的安全性并消除其对公共安全健康的威胁。医疗器械召回并不总是意味着必须立即停止使用该器械或将该器械退回到制造商,召回有时仅表示医疗器械需要进行检查,调整或者修理[1]。美国食品药品监督管理局(FDA)按召回事件的严重和紧迫性,分为三级:一级代表最高风险等级的召回,使用产品可能造成严重的不良后果或者死亡;二级代表中等风险等级的召回,使用产品可能产生暂时的或医学上可逆的不良后果,不能引发严重不良后果;三级代表最低风险等级的召回,不太可能造成不良后果[2,3]。FDA 是国际上开展医疗器械产品召回工作比较成熟的机构之一。
本次分析着重介绍美国FDA 对神经刺激类产品的召回情况,尤其是DBS 和SCS 产品,为临床使用风险较高器械。旨在为我国高端医疗器械类产品的审评,检测监测,相关领域研究和产品制造商提供参考。从而尽量避免潜在伤害事件发生,推动我国高风险高端医疗器械的发展。
1.研究材料和方法
登陆FDA 官方网站,进入Medical Device Recalls,即可检索神经调控类产品历年的召回事件,重点根据产品类别对召回原因进行分类整理。
参照国际上产品召回制度中对产品缺陷的分类理论[2],结合神经刺激类产品的特点,将召回原因分为7 类:生产制造,设计,包装和标签,以及非长期植入辅助部分,说明书,元件失效和系统缺陷。
2.结果
世界上神经刺激类器械的主要生产厂家有Medtronic,St. Jude Medical 和Boston Scientific。文献[4]和[5]对这三家生产的神经刺激器产品阐述了充电过程发热的对比研究,这和FDA 召回中充电发热相对应。本次分析主要针对Medtronic,St. Jude Medical 和Boston Scientific 这三家公司的相关产品展开,与之前相关FDA 召回事件研究相比[2,3],具有针对性更强的特点。
2.1 Medtronic
Medtronic 神经调控业务涉及:DBS,SCS,Interstim 骶神经电刺激和鞘内药物输注类产品。对Medtronic 神经调控部门,FDA 网站上历年所有召回事件分析。2006.10.20-2015.1.12 召回事件共105 条。其中1 级召回42 条(40%),2 级召回60 条(57.1%),3 级召回3 条(2.9%)。二级召回为最多。表1 为Medtronic 神经调控部门各召回等级召回事件数量统计。
图1 为2006.10.20-2015.1.12 召回事件条数和对应的年份分布图,从图中可以看出2008 年召回数量最多,随后召回事件维持在一个相对较低的水平。总体看,神经调控类产品召回事件维持在较低的水平。
总体召回水平和文献报道的临床统计基本一致。2012 年发表的文献[6]给出脑刺激器类产品应用是硬件故障率相对低的一种安全方法。该文献回顾总结了从1996 年到2010 年作者机构所有接受DBS 治疗的病人,分析了硬件问题和手术修正的原因。总共512 个病人,856 个电极植入。其中297 (58%) 个帕金森病(PD)病人,127 (24.8%) 个特发性振颤 (ET),40 (7.8%) 个肌张力障碍和48 (9.37%) 个其他运动障碍类患者。电极平均植入3.9 ± 2.8 年。共44 个病人(8.6%) 有硬件问题或系统修正。电极断裂是最常见的问题,出现13 (2.5%)个病人,紧跟着的是感染 (n = 10,1.9%),电极触点异位 (n = 10,1.9%),电极触点移动 (n = 9,1.75%),其他问题 (n = 2,0.39%)。 ET 病人与PD 病人相比较有更高的硬件风险(13% vs. 7%)。结论为DBS 是一种硬件故障率相对低的一种安全方法。

表1. Medtronic 神经调控部门各召回等级召回事件数量

图1. Medtronic 神经调控部门召回事件条数和对应年份分布图
由于用于治疗慢性疼痛的SCS 和DBS 设计大体相同,因此本次分析中将SCS 和DBS 归为一类讨论。文献[7]报告了11 年的SCS 应用总结。从1989 到2000 年间102 个病人进行调查,共对35 个病人进行了64 次修正手术。其中电极更换和重新定位29 个,脉冲发生器更换23 个,连接线问题3 个和植入取出5 个。该文献认为由于技术等原因修正手术率比较高。文献[8]也得出硬件问题相对常见,大约26%的病人发生。
2000 年左右的相关文献倾向得出硬件故障率高的结论。2012 年文献表明DBS 是一种硬件故障率相对低的安全方法。十年间硬件取得了巨大的进步,生厂商在应用中不断改进从而日渐成熟,带动了整个产业进步。基本认为,2000 年以后DBS 和SCS 硬件维持在低故障率水平。和图1情况基本一致。
对Medtronic 神经调控部门,FDA 网站上历年所有召回事件分析。2006.10.20-2015.1.12 召回事件共105 条。将SCS 和DBS 归为一类,1 到3级召回中,DBS 和SCS 产品分布情况见图2-4。
图2 为一级召回的总体分布情况。Class 1 召回共42 条,2 条(4.8%)为DBS 相关召回(具体为非长期植入辅助部分:DBS 电极帽导致电极损坏),SCS 召回条数为0 条。其余为Interstim骶神经电刺激和鞘内药物输注产品召回40 条(95.2%)。
图3 为二级召回的总体分布情况。Class 2 召回共60 条,其中19 条(31.7%)为DBS 和SCS产品,41 条(68.3%)为Interstim 骶神经电刺激和鞘内药物输注产品。
图4 为三级召回的总体分布情况。Class 3 召回共3 条,其中2 条为SCS 体外软件(病人编程器应用软件装载错误,无法通信)。其余1 条为Interstim 骶神经电刺激和鞘内药物输注产品。
从DBS 和SCS 各类召回事件在神经调控类产品的分布来看,DBS 和SCS 产品总体召回率较低。

图2. Medtronic 神经调控部门2006.10.20-2015.1.12 一级召回分布图
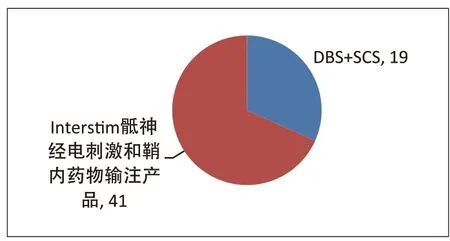
图3. Medtronic 神经调控部门2006.10.20-2015.1.12 二级召回分布图
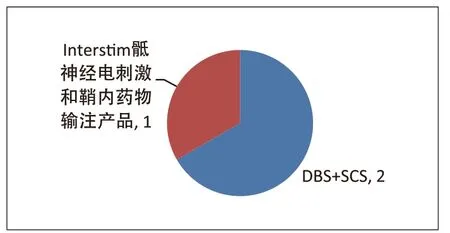
图4. Medtronic 神经调控部门2006.10.20 -2015.1.12 三级召回分布图
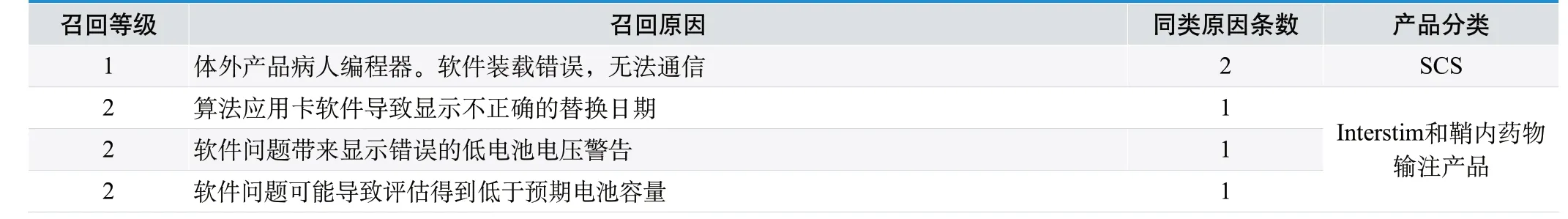
表2. Medtronic 神经调控部门2006.10.20-2015.1.12 所有软件召回

表3. Medtronic 神经调控部门2006.10.20-2015.1.12 DBS 和SCS 全部召回情况
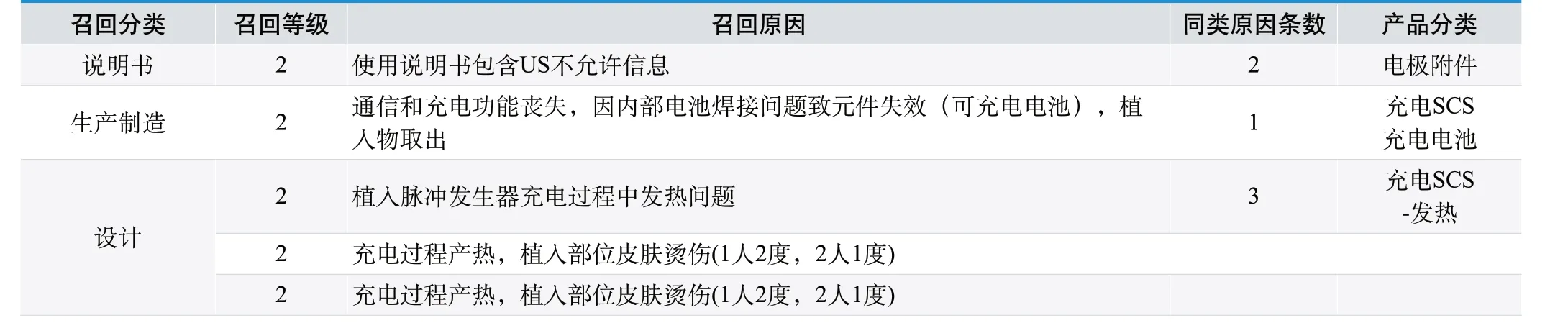
表4. St. Jude Medical SCS 在FDA 网站上所有召回
DSB 和SCS 软件召回的情况值得关注。在Medtronic 神经调控部门2006.10.20-2015.1.12 所有召回中,涉及FDA 召回事件明确具体原因为软件召回的共5 条。其中,2 个为SCS 产品,SCS产品涉及体外产品软件装载错误。其余3 条为Interstim 骶神经电刺激和鞘内药物输注产品。
心脏起搏器等医疗器械产品,软件复杂,相对召回较多。神经刺激器类产品因目前大多为开环控制,软件相对比较简单,代码量较小,不涉及复杂算法,从表2 可以看出,相应召回事件也较少。相比之下,神经刺激类产品体外配套产品软件较体内植入部分更为复杂,需要对体外配套产品加以重视。
Medtronic 神经调控部门2006.10.20-2015.1.12,DBS 和SCS 全部召回情况见表3。DBS 和SCS召回事件共23 条,占Medtronic 神经调控部门总召回事件的21.9%。召回事件集中体现在:生产制造,设计,包装和标签,以及非长期植入辅助部分。其中,非长期植入辅助部分召回事件共7条(30.4%),包装和标签召回事件共6 条(26.1%),设计召回事件共6 条(26.1%),生产制造召回事件共4 条(17.4%)。
2.2 St. Jude Medical
St. Jude Medical SCS,在FDA 网站上所有召回见表4,集中在2013-2014 年。
St. Jude Medical SCS 源 自Advanced Neuromodulation Systems Inc(ANS),在FDA上ANS 查得到的所有召回情况见表5,集中在2009-2013 年。
近些年可充电电池技术已经用于植入产品,以获得更长的电池寿命和减少手术更换。充电神经刺激类产品随着植入可充电电池成熟而近年来产生的新产品带来的新问题值得关注。St. Jude Medical SCS 的召回大部分为充电类产品,与EonTM 和Eon MinTM 相关,和充电这一新应用相关,充电部分是其核心和关键问题。问题主要涉及,如表4 和表5 中设计部分的充电发热召回事件,文献[4~5]与之对应,发热问题是充电神经刺激器产品特别需要关注的问题;另外,文献[9]首次描述了“电池屏蔽症状”。当将Medtronic 公司非充电电池的Kinetra 替换成充电的Active RC,需要一个额外的连接器。这个附加的硬件,如果向浅表移动,会变成一个对充电电池的阻碍。该问题临床共发生2 例,其中1 例必须手术重新放置连接器到皮下袋深的一面。
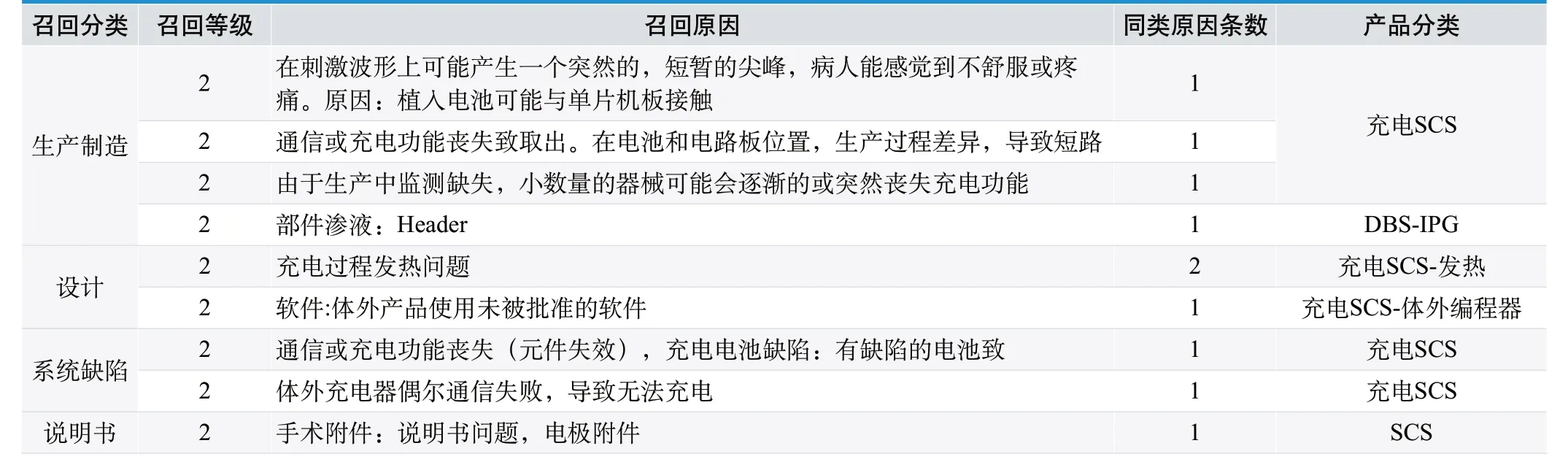
表5. Advanced Neuromodulation Systems Inc SCS 在FDA 网站上所有召回

表6. Advanced Bionics 至2015.1.12 在FDA 网站上所有召回
总之,St.Jude Medical 涉及的召回大部分和充电这一新应用相关,其中充电发热和充电电池缺陷值得关注,生产制造的问题也稍显突出。
2.3 Boston Scientific
Boston Scientific 公司至2015.1.12 在FDA 网站上没有与DBS 或SCS 相关的召回。波科产品源自Advanced Bionics Corporation,其在FDA 网站上至2015.1.12 所有召回见表6。充电发热,生产制造和元件失效的问题比较突出。
3.讨论
加强对召回信息的利用。通过对召回事件进行分析,尤其针对某一类产品深入,结合临床文献的分析,有助于加强对医疗器械安全性的客观认识。通过召回产品及其原因分类,提示监管,检测,审评和生产厂家关注这些问题。
3.1 关注新设计应用带来的新问题
以充电发热问题为例,FDA 对St.Jude Medical公司EonTM 和Eon MinTM 充电SCS 产品的召回,其在植入部位发生1-2 度病人烧伤。充电过程的发热问题是充电式植入医疗仪器设计过程中重点需要关注的问题。对商用充电产品的发热情况有相关研究报道[4,5,10]。充电过程,时变电磁场下人体金属植入物的涡流产热会带来局部组织的温升,充电产品的能量接收线圈一般密封在金属钛壳内部,充电过程中钛壳的涡流产热以及人体植入部位组织的导热能力,共同决定了充电的发热情况。根据FDA 的该召回,新兴厂商和我国的检测和审评部门都需要对该项目作重点关注。
3.2 软件问题
随着医疗器械远程医疗等网络化的不断发展,医疗器械的软件问题需要引起重视,文献[2]中,有关软件的召回有109 例(3.5%)。像心脏起搏器等医疗产品,软件复杂,相对召回较多。但神经刺激器类产品因目前大多开环控制,软件比较简单,代码量较小,不涉及复杂算法,因此相应召回也较少。但是要加强对植入高风险医疗仪器体外配套装置的软件重视。
3.3 植入电池问题
设计和生产制造是医疗器械召回的主要原因之一,对同类产品的召回分析,进行自查可以有效地纠正设计和制造问题。
但FDA 召回仅是参考,比如FDA 在 DBS和SCS 召回中,电池原因较少。但如果一个国产的高风险医疗器械厂商使用新兴的国产植入电池,对于电池这一高风险部件,就需要全面地验证。
3.4 硬件可靠性问题
国际知名公司的设计相对已经比较成熟。但新兴的生厂商目前还没有渠道分享成熟生厂商的众多经验[11]。因此早期应用过程发生的问题,有一定的借鉴意义。
3.5 其他问题
一般问题,如包装和标签问题,需要引起重视。还有生产制造和非长期植入辅助部分均需引起重视。
4.总结
通过对美国FDA 深部脑刺激器(DBS)和脊髓刺激器(SCS)这两类神经调控类高风险医疗器械产品召回分析表明,存在缺陷是客观情况。应加强对医疗器械召回信息的利用,总结FDA 召回事件的规律。为我国高端医疗器械类产品的审评,检测监测,相关领域研究和产品化提供参考。同时注重积累我国的召回事件,为我国医疗器械产品的召回工作借鉴FDA 提供参考。
[1] 吕宏光.美国FDA 医疗器械召回.中国医疗器械信息.2012 年第2 期:68-71.
[2] 张强,刘胜林等.对2005-2006 年美国FDA 召回的医疗器械产品分析.中国医疗器械杂志.2011 年35 卷第4 期:280-283.
[3] 文强,夏世韬等.272 例FDA 医疗器械产品一级召回事件分析和探讨.中国药物警戒.第11 卷第4 期.2014.4.:235-240.
[4] Smith D K, Lovik R D, Sparrow E M, et al. Human tissue temperatures achieved during recharging of new-generation neuromodulation devices. International Journal of Heat and Mass Transfer, 2010, 53(15):3292-3299.
[5] Lovik R D, Abraham J P, Sparrow E M. Potential tissue damage from transcutaneous recharge of neuromodulation implants. International Journal of Heat and Mass Transfer, 2009, 52(15):3518-3524.
[6] Baizabal Carvallo JF, Mostile G, Almaguer M, Davidson A, Simpson R, Jankovic J. Deep brain stimulation hardware complications in patients with movement disorders: risk factors and clinical correlations. 2012,90(5):300-6.
[7]QuigleyD.G.,ArnoldJ.,EldridgeP.R.,CameronH.,McIvorK.,MilesJ.B.,VarmaT.R.K. Long-Term Outcome of Spinal Cord Stimulation and Hardware Complications. Meet Am Soc Stereotact Funct Neurosurg, New York, N.Y., 2003. Stereotact Funct Neurosurg 2003,81:50–56.
[8] Kelly E. Lyons, PhD; Steven B. Wilkinson, MD; John Overman, BS, BEE; and Rajesh Pahwa, MD. Surgical and hardware complications of subthalamic stimulation--- A series of 160 procedures.2004.
[9] Chelvarajah R.,Lumsden D.,Kaminska M.,Samuel M.,Hulse N.,Selway R.P.,Lin J.-P and Ashkan K. Shielded Battery Syndrome: A New Hardware Complication of Deep Brain Stimulation . Stereotact Funct Neurosurg 2012;90:113–117.
[10] Lovik R D, Abraham J P, Sparrow E M. Surrogate human tissue temperatures resulting from misalignment of antenna and implant during recharging of a neuromodulation device. Neuromodulation: Technology at the neural interface, 14: p. 501–511.
[11] http://www.inemi.org/project-page/defining-requirements-development-medical-electronics-reliability-specifications

