肥胖型和非肥胖型多囊卵巢综合征患者的内分泌特征比较*
战思恩,王 娟,翟燕红,王文娟(首都医科大学附属北京妇产医院:.检验科;.内分泌科,北京0006)
·论 著·
肥胖型和非肥胖型多囊卵巢综合征患者的内分泌特征比较*
战思恩1,王 娟2,翟燕红1,王文娟1
(首都医科大学附属北京妇产医院:1.检验科;2.内分泌科,北京100026)
目的 探讨肥胖型和非肥胖型多囊卵巢综合征(PCOS)患者的内分泌特征是否相同。方法 选择就诊的未经过药物治疗的PCOS患者211例,分为肥胖组和非肥胖组,分别检测其基础血清总睾酮(TT)、硫酸脱氢表雄酮(DHEAS)、性激素结合球蛋白(SHBG)、卵泡刺激素(FSH)、黄体生成素(LH)、雌二醇(E2)、孕酮(PO)及催乳素(PRL)水平,并对其进行统计分析。结果 肥胖组PCOS患者的SHBG、LH、E2和PO明显低于非肥胖组,差异有统计学意义(P<0.05)。PCOS患者肥胖与TT、FSH及E2绝对正相关,与SHBG、LH及PO绝对负相关,差异有统计学意义(P<0.05)。结论 肥胖型和非肥胖型PCOS患者的基础内分泌指标间存在差异,这对于进一步了解PCOS的发病机制及异质性具有重要意义。
多囊卵巢综合征; 肥胖; 内分泌指标; 异质性
多囊卵巢综合征(PCOS)是最常见的妇科内分泌紊乱性疾病之一,育龄期妇女发病率高达5%~7%,占无排卵性不孕的50%~70%,其确切的发病原因和机制目前仍不明确[1-2]。PCOS临床表现呈多态性、异质性,主要包括高雄激素血症、多囊卵巢、月经异常、多毛、肥胖,以及一系列内分泌改变等[3-6]。50%~80%的PCOS患者超重或肥胖[7-8],而且与正常体质量的PCOS患者相比,超重或肥胖的PCOS患者往往更加难以治疗和受孕,即使受孕也易发生流产,其原因尚不清楚。本研究的主要目的是对肥胖型和非肥胖型PCOS患者的内分泌特征进行分析比较,初步探讨不同体质量的PCOS患者间的内分泌特征是否存在差异,从而有助于进一步了解PCOS的发病原因、机制及异质性。
1 资料与方法
1.1 一般资料 选取2013年9月1日至2014年10月31日来本院就诊并确诊的PCOS患者211例,年龄14~39岁,平均(26.86±4.40)岁。PCOS诊断标准为欧洲人类生殖和胚胎医学会与美国生殖医学会(ESHRE/ASRM)提出的鹿特丹标准[9],即排除其他雄激素过多相关疾病,符合下列标准中的任意2条即可诊断:A.稀发排卵或无排卵;B.临床症状和(或)生化指标显示雄激素过多症;C.双囊巢多囊样改变(一侧或双侧卵巢2~9 mm的卵泡不低于12个,或卵巢体积不低于10 mL)。稀发排卵或无排卵的表现是稀发月经或闭经。高雄激素的临床症状为多毛(Ferriman-Gallwey 评分不低于6分)、痤疮、雄激素性脱发,生化指标为总睾酮(TT)≥0.77 ng/mL或硫酸脱氢表雄酮(DHEAS)≥2.75 mg/mL。纳入标准:(1)符合PCOS诊断标准;(2)年龄在13~40岁;(3)首次诊断。排除标准:(1)孕妇;(2)具有其他雄激素过多相关疾病,例如库兴氏征、高泌乳素血症、先天性肾上腺增生、严重的胰岛素抵抗综合征、分泌雄激素的肿瘤、生长激素肿瘤及甲状腺功能异常等;(3)患有原发性高脂血症或心脑血管疾病或有卵巢手术史;(4)在近3个月内接受过激素治疗。
1.2 研究方法 (1)体格检查:记录每例受试对象年龄、身高和体质量,并计算体质量指数(BMI):BMI(kg/m2)=体质量/身高2。BMI<25 kg/m2为正常体质量,BMI≥25 kg/m2为肥胖。(2)空腹血样的采集:受试对象在月经周期第2~4天早晨空腹采集静脉血标本5 mL,闭经的PCOS患者(停经时间超过以往3 个月经周期或者不低于6 个月)可任意日采血[10]。所有抽取到的血待血液凝固后3 000 r/min离心10 min分离出血清,放置4 ℃或-80 ℃,以备完成内分泌代谢指标的检测。(3)内分泌指标检测方法:应用西门子ADVIA Centaur XP化学发光全自动免疫分析仪测定卵泡刺激素(FSH)、促黄体生成素(LH)、雌二醇(E2)、孕酮(PO)、催乳素(PRL)和TT,应用西门子IMMULIFE 2000化学发光全自动免疫分析仪测定DHEAS和性激素结合球蛋白(SHBG)。上述检测均使用配套的试剂、定标液和质控品。以上各指标的批间差异和批内差异(CV)均小于10%。

2 结 果
2.1PCOS患者肥胖组和非肥胖组的内分泌特征比较 参与本研究的所有PCOS患者的平均BMI值为27.61kg/m2,有149例患者为肥胖,占总人数的70.6%。将非肥胖组和肥胖组两组的各种内分泌指标相比较,结果见表1。肥胖组患者的SHBG、LH、E2和PO水平明显低于非肥胖组,差异有统计学意义(P<0.05)。两组的年龄、TT、DHEAS、FSH及PRL差异无统计学意义(P>0.05)。
2.2PCOS患者肥胖与各种内分泌指标的相关性分析及回归分析 经相关性分析发现,PCOS患者的BMI值与TT、FSH及E2绝对正相关,与SHBG、LH及PO绝对负相关,差异有统计学意义(P<0.05),而与年龄、DHEAS及PRL无相关性。以BMI为因变量,TT、SHBG、FSH、LH、E2及PO为自变量,进行多元线性回归分析得到:BMI=28.601+0.028TT-0.160SHBG+0.509FSH-0.301LH+0.016E2-0.326PO,见表3。

表1 PCOS患者肥胖组和非肥胖组的内分泌特征比较±s或M(X25%~X75%)]

续表1 PCOS患者肥胖组和非肥胖组的内分泌特征比较±s或M(X25%~X75%)]
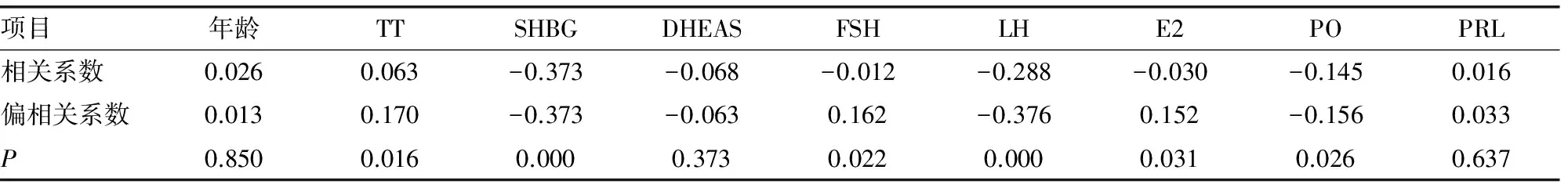
表2 PCOS患者肥胖(BMI)与各种内分泌参数的相关性分析

表3 PCOS患者肥胖(BMI)与各种内分泌参数的回归性分析
3 讨 论
本研究结果表明,肥胖型和非肥胖型PCOS患者的基础内分泌指标间存在差异,肥胖组的SHBG、LH、E2和PO明显低于非肥胖组。经相关性分析及多元线性回归分析发现,肥胖与TT、FSH及E2水平绝对正相关,与SHBG、LH及PO水平绝对负相关。
高雄激素血症是PCOS患者最主要特征之一,同时也是诊断标准之一。PCOS患者雄激素的来源主要有两个:卵巢和肾上腺。卵巢主要产生雄烯二酮和睾酮,而肾上腺主要产生脱氢表雄酮(DHEA)和DHEAS。PCOS临床表现多样不一,有可能与其雄激素的来源和类型不同有关[11-13]。本研究发现,PCOS患者肥胖与TT水平正相关,与DHEAS水平不相关。此结果提示我国北京地区的PCOS患者发生肥胖可能与卵巢来源的雄性激素(睾酮)增高有关,而与肾上腺来源的雄激素(DHEAS)无关。此结果与其他一些研究结果一致[14-15],但与某些研究结果不完全一致[16],其原因可能是PCOS与不同种族的基因多态性密切相关,不同种族的致病因素可能不完全相同。
SHBG是主要由肝细胞合成的一种能结合性激素的球蛋白,也称睾酮-雌激素结合球蛋白或甾体结合蛋白,其主要生理功能是特异性结合转运性激素。雄性激素(睾酮)由于与SHBG结合而得到保护,从而避免了血管的吸附、生物和化学的破坏以及快速降解,而发挥生物学活性的主要是其游离状态的雄性激素,因而SHBG能够调控血液中具有生物活性的睾酮浓度[17]。本研究中,肥胖组SHBG血清浓度明显低于非肥胖组,且相关分析及回归分析表明,肥胖与SHBG浓度负相关。SHBG血清浓度降低,可以使具有生物活性的游离状态的睾酮浓度增加,游离睾酮的升高又进一步减少了胰岛素的清除,从而诱导肌肉组织产生胰岛素抵抗,进而促使机体分泌更多的胰岛素,而增高的胰岛素又能进一步抑制肝脏合成SHBG,最终导致恶性循环的形成。因而肥胖的PCOS患者往往具有更加严重的内分泌紊乱等临床症状,也更难以治疗。
本研究中还发现,PCOS肥胖组的LH、E2和PO浓度明显低于肥胖组,肥胖组的FSH浓度也有偏低于非肥胖组的趋势,但差异无统计学意义(P>0.05)。经多因素线性回归分析后发现肥胖与FSH及E2水平绝对正相关,与LH及PO水平绝对负相关。Silfen等[18]也研究发现,肥胖组的LH浓度明显低于非肥胖组,而FSH浓度与非肥胖组无差别,虽然有偏低的趋势,与本研究结果一致。与非肥胖PCOS患者相比,肥胖PCOS患者的血清LH浓度偏低的原因及机制目前还不太清楚。仅有部分研究发现可能是由于肥胖PCOS体内更高浓度的胰岛素水平导致了LH浓度的降低[19-20]。FSH和LH是卵巢卵泡发育、成熟及排卵所必需的两种糖蛋白激素。FSH是刺激卵泡发育最重要的激素,能促使窦前卵泡及窦状卵泡的颗粒细胞增殖与分化,分泌卵泡液,以促进卵细胞的生长发育、成熟。同时FSH还能激活颗粒细胞内的芳香化酶,使卵泡膜细胞产生的雄激素转化为雌激素,大量的雌激素进一步促进卵泡的成熟及LH的分泌。LH在FSH的协同作用下可激发排卵,促进颗粒细胞黄素化,并分泌孕激素。与非肥胖的PCOS患者相比,肥胖的PCOS患者体内FSH、LH、E2及PO水平偏低,使卵巢内卵泡发育经历的募集、选择、优势化、排卵等一系列生理过程受阻得更加严重,同时多个发育不全的小卵泡停留在各阶段或提前闭锁,形成多囊性卵巢的形态。另外,由于PO的低水平,即使肥胖PCOS患者怀孕成功,发生早期流产的可能性也很大。因此,肥胖的PCOS患者往往病情更加严重。
总之,我国北京地区的PCOS患者发生肥胖可能与卵巢来源的雄性激素增高有关,而与肾上腺来源的雄激素无关。而且,PCOS患者的肥胖还与其他多种性激素及相关蛋白相关联,这对于进一步了解PCOS的发病机制及异质性具有重要意义。
[1]DumitrescuR,MehedintuC,BriceagI,etal.ThePolycysticOvarySyndrome:Anupdateonmetabolicandhormonalmechanisms[J].JMedLife,2015,8(2):142-145.
[2]TrikudanathanS.Polycysticovariansyndrome[J].MedClinNorthAm,2015,99(1):221-235.
[3]GoodarziMO,DumesicDA,ChazenbalkG,etal.Polycysticovarysyndrome:etiology,pathogenesisanddiagnosis[J].NatRevEndocrinol,2011,7(4):219-231.
[4]LunguAO,ZadehES,GoodlingA,etal.Insulinresistanceisasufficientbasisforhyperandrogenisminlipodystrophicwomenwithpolycysticovariansyndrome[J].JClinEndocrinolMetab,2012,97(2):563-567.
[5]谷郁婷.PCOS合并胰岛素抵抗与血脂代谢异常的相关性分析[J].当代医药论丛,2014,12(21):53-54.
[6]EcklundLC,UsadiRS.Endocrineandreproductiveeffectsofpolycysticovariansyndrome[J].ObstetGynecolClinNorthAm,2015,42(1):55-65.
[7]GambineriA,PelusiC,VicennatiV,etal.Obesityandthepolycysticovarysyndrome[J].IntJObesRelatMetabDisord,2002,26(7):883-896.
[8]AzzizR,SanchezLA,KnochenhauerES,etal.Androgenexcessinwomen:experiencewithover1000consecutivepatients[J].JClinEndocrinolMetab,2004,89(2):453-462.
[9]TheRotterdamESHRE/ASRM-sponsoredPCOSworkshopgroup.Revised2003consensusondiagnosticcriteriaandlong-termhealthrisksrelatedtopolycysticovarysyndrome(PCOS)[J].HumReprod,2004,19(1):41-47.
[10]中华医学会妇产科学会内分泌学组.多囊卵巢综合征的诊断和治疗专家共识[J].中华妇产科杂志,2008,43(7):553-555.
[11]KöüN,KöüA,KamalakZ,etal.Impactofadrenalversusovarianandrogenratioonsignsandsymptomsofpolycysticovariansyndrome[J].GynecolEndocrinol,2012,28(8):611-614.
[12]LerchbaumE,SchwetzV,GiulianiA,etal.Opposingeffectsofdehydroepiandrosteronesulfateandfreetestosteroneonmetabolicphenotypeinwomenwithpolycysticovarysyndrome[J].FertilSteril,2012,98(5):1318-1325.
[13]GoodarziMO,CarminaE,AzzizR.DHEA,DHEASandPCOS[J].JSteroidBiochemMolBiol,2015,145:213-225.
[14]HolteJ,BerghT,BerneC,etal.Serumlipoproteinlipidprofileinwomenwiththepolycysticovarysyndrome:relationtoanthropometric,endocrineandmetabolicvariables[J].ClinEndocrinol(Oxf),1994,41(4):463-471.
[15]GruletH,HecartAC,DelemerB,etal.RolesofLHandinsulinresistanceinleanandobesepolycysticovarysyndrome[J].ClinEndocrinol(Oxf),1993,38(6):621-626.
[16]HolteJ,BerghT,GennarelliG,etal.Theindependenteffectsofpolycysticovarysyndromeandobesityonserumconcentrationsofgonadotrophinsandsexsteroidsinpremenopausalwomen[J].ClinEndocrinol(Oxf),1994,41(4):473-481.
[17]王文娟,战思恩.性激素结合球蛋白在妇产科疾病中的应用研究进展[J].检验医学与临床,2013,10(17):2318-2321.
[18]SilfenME,DenburgMR,ManiboAM,etal.Earlyendocrine,metabolic,andsonographiccharacteristicsofpolycysticovarysyndrome(PCOS):comparisonbetweennonobeseandobeseadolescents[J].JClinEndocrinolMetab,2003,88(10):4682-4688.
[19]AcienP,QueredaF,MatallinP,etal.Insulin,androgens,andobesityinwomenwithandwithoutpolycysticovarysyndrome:aheterogeneousgroupofdisorders[J].FertilSteril,1999,72(1):32-40.
[20]ArroyoA,LaughlinGA,MoralesAJ,etal.Inappropriategonadotropinsecretioninpolycysticovarysyndrome:influenceofadiposity[J].JClinEndocrinolMetab,1997,82(11):3728-3733.
Comparison of endocrine characteristics between obese and non-obese women with polycystic ovary syndrome*
ZHANSi-en1,WANGJuan2,ZHAIYan-hong1,WANGWen-juan1
(1.DepartmentofClinicalLaboratory;2.DepartmentofEndocrinology,AffiliatedBeijingObstetricsandGynecologyHospital,CapitalMedicalUniversity,Beijing100026,China)
Objective To investigate whether having the same endocrine characteristics in non-obese and obese women with polycystic ovary syndrome(PCOS).Methods 211 untreated women with PCOS were selected and divided into the obese group and the non-obese group.The basal levels of serum total testosterone(TT),dehydroepiandrosterone sulfate (DHEAS),sex hormone binding globulin(SHBG),follicle stimulating hormone(FSH),luteinizing hormone(LH),estradiol (E2),progesterone (PO) and prolactin(PRL) were measured and the results were analyzed statistically.Results The basal SHBG,LH,E2 and PO levels in the PCOS patients of the obese group were significantly lower than those of the non-obese group,the difference was statistically significant (P<0.05).Obese was absolutely positively correlated with the TT,FSH and E2 levels in the PCOS patients,but absolutely inversely correlated with the SHBG,LH and PO levels(P<0.05).Conclusion The difference of basal endocrine indicators exist between non-obese and obese women with PCOS,which has an important significance for further understanding the pathogenesis and heterogeneity of PCOS.
PCOS; obese; endocrine indicators; heterogeneity
首都医科大学附属北京妇产医院院内课题(2013-13)。
战思恩,女,副主任技师,博士,主要从事临床检验工作。
10.3969/j.issn.1672-9455.2015.21.016
A
1672-9455(2015)21-3172-03
2015-05-26
2015-08-15)

