右美托咪定复合芬太尼用于烧伤换药的镇痛效果观察
曹 剑,崔 剑,顾健腾,石胜驰,曾 静,鲁开智
(第三军医大学第一附属医院麻醉科,重庆400038)
芬太尼已广泛应用于烧伤患者的换药操作,具有较强的镇痛作用[1]。但芬太尼剂量过大时易使患者出现呼吸、循环抑制,威胁患者安全[2]。右美托咪定具有良好的镇静、镇痛作用,且无明显的呼吸抑制作用[3]。基于两种药物的药理学特性,本研究在烧伤更换敷料术中应用小剂量右美托咪定复合芬太尼麻醉,取得了良好效果,现报道如下。
1 资料与方法
1.1 一般资料 选择2010年1月至2012年12月收治的成人烧伤患者60例,采用随机数字表法,将患者分成右美托咪定组(D组)和生理盐水组(N组),每组30例。两组患者年龄、性别、体质量、烧伤面积及换药时间差异无统计学意义(P>0.05),具有可比性。美国麻醉师协会(ASA)Ⅰ~Ⅱ级、年龄20~60岁,烧伤面积不超过75%,深度不超过Ⅲ度。要求患者神志清楚,能够正确理解和使用视觉模拟评分法(VAS)表达疼痛程度;无严重复合伤及重度吸入性损伤;既往无心、肺疾病史,内分泌疾病史,药物过敏史。本研究患者均知情同意,并获得本院伦理委员会批准。
1.2 方法
1.2.1 麻醉方法 所有患者换药前均禁食8~12h,禁饮4h。常规监测动脉血压收缩压(SBP)、动脉血压舒张压(DBP)、心率(HR)、血氧饱和度(SpO2),开放静脉通路。D组于换药前静脉注射右美托咪定1.0μg/kg,注射时间为10min,然后以0.5μg·kg-1·h-1持续输注至换药结束;N组泵注同等容积生理盐水作为对照。两组均于换药前5min静脉注射芬太尼50μg,换药中尽量保持患者的自主呼吸并给予鼻导管吸氧(2 L/min)。
1.2.2 观察指标 记录麻醉开始前和换药开始时的SBP、DBP、HR、SpO2;记录换药结束后15min及30min创面疼痛的VAS评分;创面换药前、后10min对各组患者采集静脉血8 mL,采用速率散射比浊法测定C反应蛋白(CRP);采用放射免疫分析法来测定皮质醇、胰岛素;采用葡萄糖氧化酶法测定血糖。
1.3 统计学处理 采用SPSS10.0软件统计分析,计量资料用±s表示,组内比较采用配对t检验.组间比较采用成组t检验,以P<0.05为差异有统计学意义。
2 结 果
两组麻醉前的SBP、DBP、HR、SpO2组间差异无统计学意义;D组换药开始时的SBP、DBP和HR比麻醉前均有下降(P<0.05),见表1;D组换药后的血糖、胰岛素、皮质醇、CRP水平与麻醉前比较差异均有统计学意义(P<0.05),见表2。两组患者在换药结束后15min及30min创面疼痛的VAS评分比较中,D组换药时、结束后15、30min的VAS小于N组(P<0.05),见表3。两组患者在换药期间均未见明显不良反应。
表1 患者不同时点生命体征的比较(±s,n=30)

表1 患者不同时点生命体征的比较(±s,n=30)
a:P<0.05,与麻醉前比较。
组别 SBP(mm Hg)DBP(mm Hg)HR(次/分钟) SpO2(%)D组麻醉前 116.8±11.8 78.9±9.6 86.7±16.9 98.6±0.8换药时 103.8±8.8a 66.8±7.8a81.8±11.4a97.2±1.0 N组麻醉前 121.2±12.6 76.9±10.2 90.8±13.6 98.5±0.7换药时110.7±9.8 75.8±8.9 92.5±14.9 95.5±0.7
表2 两组患者换药前后应激指标比较(±s,n=30)
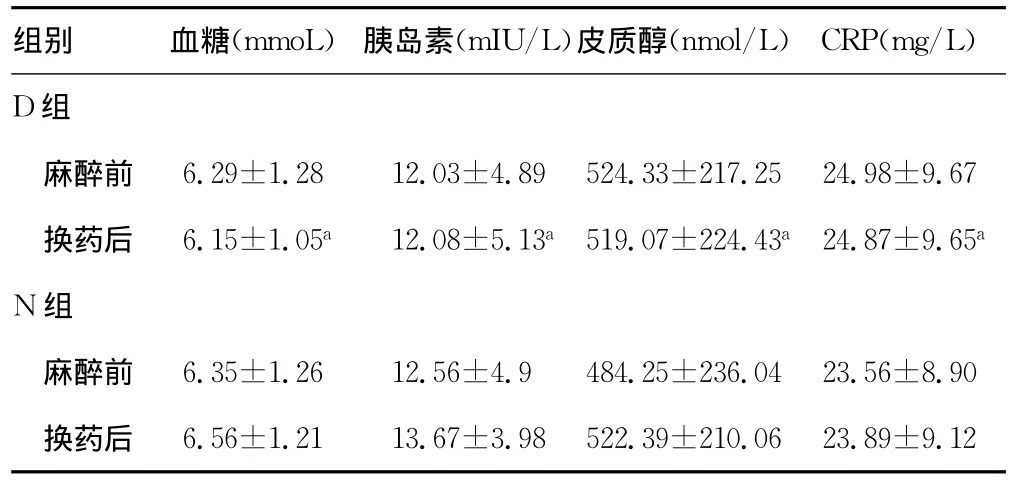
表2 两组患者换药前后应激指标比较(±s,n=30)
a:P<0.05,与麻醉前比较。
组别 血糖(mmoL) 胰岛素(mIU/L)皮质醇(nmol/L) CRP(mg/L)D组麻醉前 6.29±1.28 12.03±4.89 524.33±217.25 24.98±9.67换药后 6.15±1.05a12.08±5.13a519.07±224.43a24.87±9.65a N组麻醉前 6.35±1.26 12.56±4.9 484.25±236.04 23.56±8.90换药后 6.56±1.21 13.67±3.98 522.39±210.06 23.89±9.12
表3 两组换药时、换药后15、30min时创面疼痛的VAS评分比较(±s,n=30)

表3 两组换药时、换药后15、30min时创面疼痛的VAS评分比较(±s,n=30)
a:P<0.05,与N组比较。
VAS评分(分)组别30min D组 1.89±0.18a 1.82±0.19a 1.02±0.23换药时 换药后15min 换药后a N组3.79±0.25 2.79±0.28 2.42±0.17
3 讨 论
目前,我国烧伤患者疼痛逐渐受到临床医师重视,皮肤严重烧伤后其正常的保护功能受到破坏,神经末梢游离于体表,因此在换药过程中更换敷料或皮肤消毒受到刺激时,将引起剧烈的疼痛,加重创伤后的应激反应[4-6]。此类操作导致的急性疼痛常常引起患者的焦虑和恐惧,故本研究在换药前对患者行小剂量的镇静、镇痛治疗,以提高患者烧伤后的生命质量。
芬太尼是临床麻醉中常用的阿片类镇痛药,它具有起效快、持续时间短的特点,并能抑制应激反应,但易使患者出现眩晕、咳嗽、恶心、呕吐等不良反应。α2肾上腺素受体广泛分布于大脑中枢神经系统各突触前和突触后,具有镇静、镇痛和抗交感的作用,易唤醒,且没有呼吸抑制[7-8]。右美托咪定为高选择性α2肾上腺素受体激动剂,可激活突触后膜上,以及突触前膜α2受体,并分别抑制脊髓前侧的角交感神经活性、去甲肾上腺素和儿茶酚胺的释放,最终使SBP、DBP和HR的下降。右美托咪定与传统的镇静药物不同,前者的镇静作用并不依赖γ-氨基丁酸系统,而是作用于中枢蓝斑系统发挥镇静效应,并类似于自然睡眠可随时唤醒机体。但右美托咪定主要引起低血压、心动过缓的不良反应。其机制推测:初始负荷剂量可使外周血管收缩、血压短暂性升高,反射性引起心动减缓;随后连续输注该药后导致的低血压则是由于该药作用于心血管调节中枢,抑制交感神经,兴奋迷走神经,导致HR降低、血管舒张。故使用时需监测患者的生命体征。
本研究采用了右美托咪定推荐剂量1.0μg/kg,于换药前10min应用右美托咪定,发现D组换药时、换药结束后15min和30min时换药创面的VAS评分显著优于N组。药代学表明,右美托咪定静脉给药7~10min后血药浓度达峰值,发挥最大的镇静、镇痛效应[9]。可有效抑制换药引起的损伤性刺激向中枢传递及神经中枢敏化。因此换药前10min应用右美托咪定实施镇痛可获得更加令人满意的镇痛效果。整个换药过程中,两组的SBP、SDP、HR、SpO2均有下降,但是两组间差异无统计学意义,这表明右美托咪定不会增加芬太尼的呼吸循环抑制不良反应。当右美托咪定与芬太尼合用时,两者能相辅相成,达到更好的镇静镇痛效果。因此在烧伤换药时施行有效的镇痛治疗十分必要,不仅减轻患者痛苦,同时减弱相应的应激反应[10]。静脉注射右美托咪定复合芬太尼,可以使患者安静、无痛地接受换药治疗[11]。右美托咪定的细胞内信号转导通路研究还表明它具有抑制炎性反应的作用,对抑制全身炎性反应效果明显,特别适用于烧伤、创伤等全身炎性反应的患者[12]。
综上所述,右美托咪定复合芬太尼应用于烧伤换药的镇痛、镇静效果确切,且换药期间血流动力学稳定,具有良好的安全性。
[1]Cantinho FA,Silva AC.Assessment of the use of racemic ketamine and its S(+)isomer,associated or not with low doses of fentanyl,in balneotherapy for major burn patients[J].Rev Bras Anestesiol,2009,59(4):396-408.
[2]Lim KJ,Lee SK,Lee HM,et al.Aspiration pneumonia caused by fentanyl-induced cough-a case report[J].Korean J Anesthesiol,2013,65(3):251-253.
[3]Han G,Yu WW,Zhao P.A randomized study of intranasal vs.intravenous infusion of dexmedetomidine in gastroscopy[J].Int J Clin Pharmacol Ther,2014,59(2):159-163.
[4]Li YX,Tang HT,Zhou WF,et al.Analgesic and sedative effects of inhaling a mixture of nitrous oxide and oxygen on burn patient during and after dressing change [J].Zhonghua Shao Shang Za Zhi,2013,29(6):537-540.
[5]彭坚,夏建国.芬太尼镇痛对严重烧伤患者休克期应激反应和免疫功能的影响[J].华中科技大学学报,2010,39(4):558-561.
[6]Snell JA,Loh NH,Mahambrey T,et al.Clinical review:the critical care management of the burn patient[J].Crit Care,2013,17(5):241.
[7]Arcangeli A,Gaspari R.Dexmedetomidine use in general anaesthesia [J].Curr Drug Targets,2009,10(8):687-695.
[8]Bamgbade OA,Alfa JA.Dexmedetomidineanaesthesia for patients with sleep apnoea undergoing bariatric surgery[J].Eur J Anaesthesiol,2009,26(2):176-177.
[9]Ihmsen H,Saari TI.Dexmedetomidine,pharmacokinetics and pharmacodynamics[J].Anaesthesist,2012,61(12):1059-1066.
[10]Yu C,Li S,Deng F,et al.Comparison of dexmedetomidine/fentanyl with midazolam/fentanyl combination for sedation and analgesia during tooth extraction [J].Int J Oral Maxillofac Surg,2014,43(9):1148-1153.
[11]Wibbenmeyer L,Sevier A,Liao J,et al.Evaluation of the usefulness of two established pain assessment tools in a burn population[J].J Burn Care Res,2011,32(1):52-60.
[12]Sanders RD,Sun P,Patel S,et al.Dexmedetomidine provides corticalneuro protection:impact on anaesthetic-induced neuroapoptosisin the rat developing brain[J].Acta Anaesthesiol Scand,2010,54(6):710-716.

