炎症因子TGF-β1、IFN-γ 在冠心病患者中的表达及意义①
刘莹莹 卢 义 孙 敏 黄海燕 王越晖 (吉林大学第一医院老年病科,长春 130021)
冠心病(Coronary heart disease,CHD)的病理基础是动脉粥样硬化(Atherosclerosis,AS)。研究发现,血管受损后的炎症反应与AS 的发生发展密切相关[1]。因此,大量炎症因子参与了AS 的进程,并介导急性冠脉事件的发生[2]。本研究通过探讨不同类型冠心病患者血清转化生长因子 β1(Transforming growth factor β1,TGF-β1)和γ-干扰素(Interferon-γ,IFN-γ)的变化,尝试阐述TGF-β1 和IFN-γ 在冠心病中的作用及可能的机制。
1 材料与方法
1.1 研究对象 选择行冠状动脉造影检查的住院患者,依据1979 年缺血性心脏病的诊断标准确定冠心病的患者。36 例患者中男21 例、女15 例,分为:冠心病组(CHD)及正常对照组(NC),前者又分为急性心肌梗塞组(AMI)和不稳定型心绞痛组(UAP)。AMI 组12 例,男8 例,女4 例,平均年龄(63.58±8.44)岁;UAP 组12 例,男7 例,女5 例,平均年龄(61.33±9.05)岁;NC 组12 例,男5 例,女7例,平均年龄(58.67±4.81)岁。排除了合并严重肝、肾、内分泌、血液系统疾病和肿瘤患者、严重心功能不全(NYHA Ⅲ级及以上)及低血压患者,合并有焦虑、抑郁症的患者。各组间性别、年龄、体重、血压、血脂、血糖、用药、伴发病等均无显著性差异,具有可比性。
1.2 实验方法
1.2.1 病史采集 详细询问并记录冠心病家族史、吸烟史及其他疾病史。
1.2.2 样本采集 各组患者均于清晨在空腹状态下抽取静脉血5 ml,30 min 内3 000 r/min 离心10 min,获得血清,-20℃保存,TGF-β1、IFN-γ 应用双抗体夹心ELISA 法测定。试剂盒由美国R&D 公司生产,并严格按照说明书操作。酶标仪于波长450 nm 测吸光度,结合标准品浓度得出线性回归方程,进一步计算样品的浓度。
1.3 统计学方法 应用SPSS13.0 统计软件。计量资料以±s 表示,多组间比较采用单因素方差分析,组内两两比较采用t 检验;计数资料采用χ2检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 患者一般临床特征 为了排除不同组别患者性别、年龄、血脂等一般临床特征对实验结果的影响,对以上指标进行统计学分析,分析结果显示:对照组入选12 例患者,其中男性5 例,UAP 及AMI 组同样入选12 例患者,男性分别为7 例及8 例,无统计学差异(P>0.05)。两组患者在年龄、吸烟史、甘油三酯水平等一般资料方面同样不存在统计学差异(P>0.05)。见表1。
2.2 患者TGF-β1 和IFN-γ 血清水平 两组患者血清TGF-β1 和IFN-γ 水平检测结果见表2。AMI 组和UAP 组血清TGF-β1 水平均显著低于正常对照组(P<0.01),而AMI 组与UAP 组相比,血清TGFβ1 水平显著减少(P<0.01)。血清TGF-β1 水平随冠心病病情加重而降低。
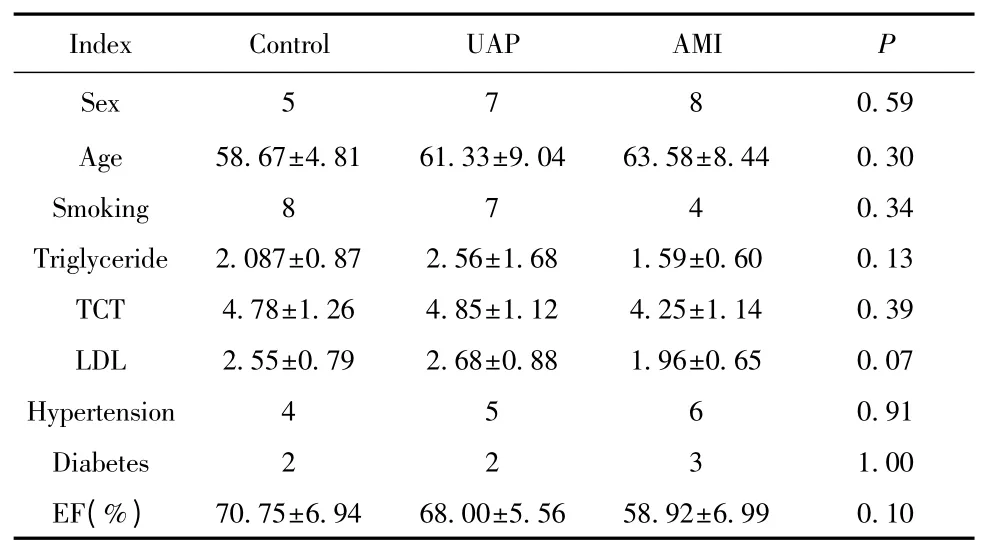
表1 患者的一般临床特征Tab.1 General clinical characteristics of patients
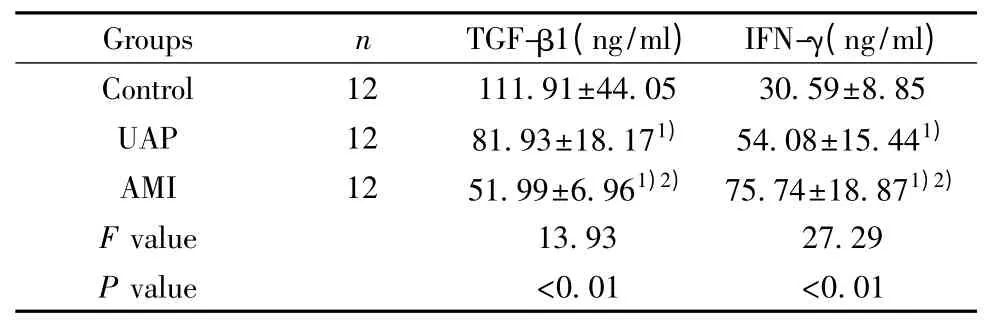
表2 三组患者血清TGF-β1 及IFN-γ 水平Tab.2 TGF-β1 and IFN-γ level in different groups
AMI 组和UAP 组血清IFN-γ 水平显著高于正常对照组(P<0.01),AMI 组与UAP 组相比,血清IFN-γ 水平显著增加(P<0.01)。血清IFN-γ 水平随冠心病病情加重而升高。
3 讨论
冠状动脉粥样硬化的发病机制,从最初的脂肪浸润学说,到血小板聚集和血栓形成及平滑肌细胞克隆学说,再到现在的动脉粥样硬化形成的损伤-反应学说,对发病机制的解释经历了一次次的变革[4]。目前认为冠状动脉粥样硬化是多因素导致的炎症反应性疾病,炎症贯穿于动脉粥样硬化发生和发展的全过程。在动脉粥样硬化发生发展的过程中,大量的炎性因子参与其中[5]。
TGF-β1 主要由血小板和活化的巨噬细胞分泌,合成之初是一种非活性的前体,在血管内皮细胞遭到破坏的情况下,蛋白裂解酶被激活,存在于正常细胞中的无活性TGF-β 转变为有活性TGF-β。活化的TGF-β 可以趋化单核细胞、促进成纤维细胞的增生、移动和合成胶原及纤维黏连蛋白,后者又能抑制胶原的降解,对纤维化的发生发展起关键的作用[6]。TGF-β1 可能通过产生足够多的细胞外基质,加固纤维帽,从而达到抗炎的作用[7]。而低水平的TGF-β1 也是冠状动脉粥样硬化的危险因素[8],这说明TGF-β1 可能作为保护因子参与了动脉粥样硬化的病理过程。本文研究结果表明血清TGF-β1 水平与冠心病病情呈负相关,血清TGF-β1水平随冠心病病情加重而递减[TGF-β1(正常对照组)>TGF-β1(UAP)>TGF-β1(AMI)]。因此,可以通过血清TGF-β1 水平来初步判断患者冠心病的病情。
IFN-γ 可由包括单核/巨噬细胞、Th1 细胞、NK细胞等在内的多种细胞合成和分泌,IFN-γ 与多种致炎因子相互作用,并可以通过活化内皮细胞促进动脉粥样硬化的形成,因此,IFN-γ 可通过多个信号通路促进动脉粥样硬化的发生发展[9,10]。研究发现,IFN-γ 缺失的小鼠,其冠状动脉粥样硬化的水平明显减轻,病情进展缓慢[11]。我们的研究结果表明血清IFN-γ 水平与冠心病病情呈正相关,即血清IFN-γ 水平随冠心病病情加重而递增[IFN-γ(正常对照组)<IFN-γ(UAP)<IFN-γ(AMI)]。
人类免疫应答是一个高度复杂的调节系统和复杂的控制网络。不同的抗炎和促炎因子和不同的细胞之间形成复杂的细胞因子网络和通讯网络。我们的研究表明血清IFN-γ 水平随冠心病病情严重而增加,而血清TGF-β1 水平随冠心病病情严重而降低。研究发现,TGF-β1、IL-4、IL-10 及糖皮质激素均可负向调节IFN-γ 的分泌[12]。因此,我们推测,在正常人血清中,高水平的TGF-β1 抑制了IFN-γ 的分泌,而在冠心病患者的血清中,IFN-γ 抑制了巨噬细胞分泌TGF-β1 而发挥了促炎作用促进了动脉粥样硬化的发生发展。因此,动态监测IFN-γ 和TGF-β1水平,可评估患者冠心病的病变情况,同时调控二者的血清含量将是治疗动脉粥样硬化的新靶点。
[1]Peter Libby.Inflammation in atheronsclerosis[J].Arterioscler Thromb Vasc Biol,2012,32(9):2045-2051.
[2]Robert Kleemann,Susanne Zadelaar,Teake Kooistra.Cytokines and atherosclerosis:a comprehensive review of studies in mice[J].Cardiovasc Res,2008,79(3):360-376.
[3]徐济民.缺血性心脏病诊断的命名及标准——国际心脏病学会和协会/世界卫生组织临床命名标准化专题组的联合报告[J].国外医学·心血管疾病分册,1979,6(6):365-366.
[4]Libby P,Theroux P.Pathophysiology of coronary artery disease[J].Circulation,2005,111:3481-3488.
[5]Kleemann R,Zadelaar S,Kooistra T.Cytokines and atherosclerosis a comprehensive review of studies in mice[J].Cardiovasc Res,2008,79(3):360-376.
[6]Toma I,McCaffrey TA.Transforming growth factor-β and atherosclerosis:interwoven atherognic and atheroprotective aspects[J].Cell Tissue Res,2012,347(1):155-175.
[7]Teicher BA.Malignant cells,directors of the malignant process:role of transforming growth factor-beta[J].Cancer Metastasis Rev,2001,20(1-2):133-143.
[8]Stefoni S,Cianciolo G,Donati G,et al.Low TGF-beta1 serum levels are a risk factor for atherosclerosis disease in ESRD patients[J].Kidney Int,2002,61(1):324-335.
[9]Harvey EJ,Ramji DP.Interferon-gamma and atherosclerosis:pro-or anti atherogenic[J].Cardiovasc Res,2005,67(1):11-20.
[10]Schroecksnadel K,Frick B,Winkler C,et al.Crucial role of interferon-gamma and stimulated macrophages in cardiovascular disease[J].Current Vascular Pharmacology,2006,4 (3):205-213.
[11]Whitman SC,Ravisankar P,Daugherty A.IFN-gamma deficiency exerts gender-specific effects on atherogenesis in apolipoprotein E-/-mice[J].J Interferon Cytokine Res,2002,22(6):661-670.
[12]Fukao T,Frucht DM,Yap G,et al.Induciable expression of Stat4 in dendritic cells and macrophages and its critical role in innate and adaptive immune responses[J].J Immunol,2001,166(7):4446-4455.