射波刀联合经导管肝动脉化疗栓塞治疗原发性肝癌的疗效及预后分析
薛 慧,钟 青,刘 虎,韩 萍,张爱民,李文刚,梁 燕,梁雪峰,常小云,段学章
原发性肝癌(primary liver cancer,PLC)在全球恶性肿瘤中发病率居第5位,其中90%以上是肝细胞癌(hepatocellular carcinoma,HCC)。我国HCC病死率居恶性肿瘤的第2位,发病率高,疗效差。HCC首选手术治疗,然而大多数患者确诊HCC时已经处于进展期和晚期,仅有10%~30%的患者有手术治疗机会。非手术治疗中,经导管肝动脉化疗栓塞(transcatheterarterial chemoembolization,TACE)可治疗大部分患者,但由于许多肿瘤存在动脉-静脉瘘、侧支循环或肿瘤乏血供,疗效并不理想[1-2]。
近年来,放疗技术发展迅速,三维适形放疗(3-dimensional conformal radiation therapy,3DCRT)、调强放疗(intensity-modulated radiation therapy,IMRT)和图像引导下的放疗技术(image-guided radiation therapy,IGRT)如螺旋断层放疗(helical tomotherapy)即TOMO和射波刀等精确的放疗技术得以产生和发展。这些新技术能使高剂量照射区域和肿瘤的立体形态完全一致,给予肿瘤很高的放射剂量,降低对肿瘤周围正常组织的剂量,减少了放射性肝病(radiation-induced liver disease,RILD)发生率。IMRT和IGRT治疗HCC成为目前临床研究的热点问题。
但目前国内尚缺乏射波刀联合TACE治疗大肝癌的大样本病例疗效观察及分析,我中心较早开展了针对直径≥5 cm肝癌患者的射波刀联合TACE治疗,取得了良好的临床效果。本文以同期单用TACE治疗直径≥5 cm的HCC患者为对照,对这2种方法进行研究,现将研究结果报道如下。
1 对象与方法
1.1 对象 110例为我院2011年1月—2013年5月诊断为HCC的患者。入组标准:均符合PLC临床诊断标准[4]且肿瘤最大直径均≥5 cm,包括初治及复发患者;肿瘤数目≥1个;体力状态尚可,Karnofsky评分均≥60分,术前1周未接受靶向治疗及静脉化疗;预计生存期>3个月。排除标准:妊娠、哺乳期妇女;BCLC分期D期;急性感染或慢性感染急性期;精神异常不能配合者。
110例中55例采用射波刀联合TACE治疗(治疗组),55例单独接受TACE治疗(对照组),2组均顺利完成治疗,一般临床资料见表1。对2组性别、年龄、肿瘤大小、肿瘤数目、BCLC分期、肝功能Child-Pugh分级等基线特征进行比较,差异无统计学意义。
1.2 方法 详细记录患者信息,术前均完善血、尿及大便常规、凝血功能、肝肾功能、电解质、心电图、X线胸片或肺CT等检查。治疗组给予射波刀联合TACE治疗,对照组单独给予TACE治疗,接受治疗前2组均已签署知情同意书。
1.2.1 TACE治疗方法 所有患者均采用泰尔茂公司5FRH导管、Embocath 3F微导管及0.038英寸亲水超滑导丝、21G细穿刺针;设备为飞利浦公司大型X光机Allura XPer FD20型数字减影系统(DSA);超液态碘油为Guerbet公司生产(10ml/支)。2组均采用Seldinger技术穿刺股动脉插管至肝固有动脉,行肝固有动脉DSA造影,明确肿瘤大小、数目及血供情况。将导管超选择至肿瘤供血动脉,因人而异注入治疗用药及碘油用量。术后给予保肝降酶等对症支持治疗。
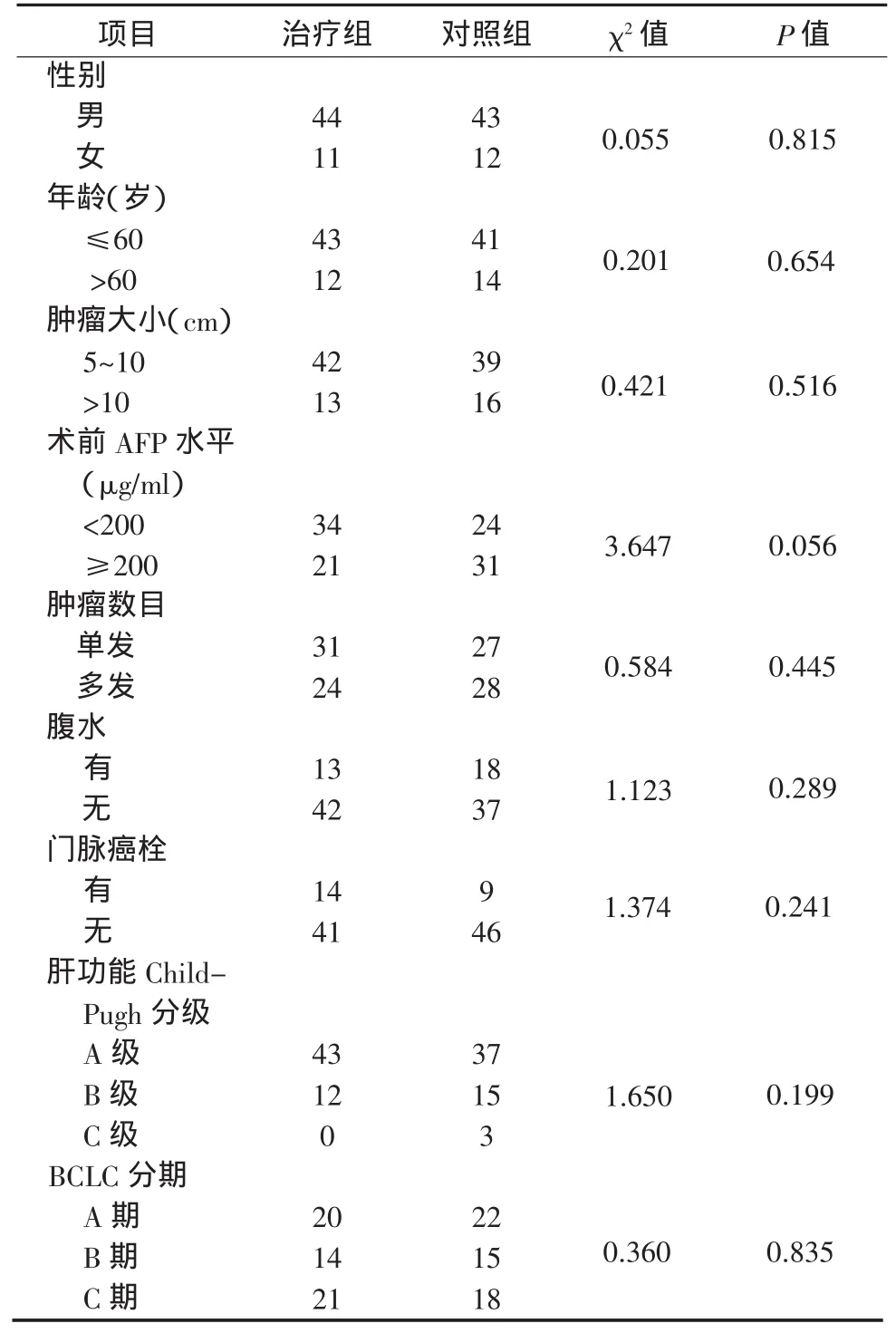
表1患者一般临床资料(例)Table1 General clinical data of the patients(cases)
1.2.2 放疗技术及步骤 治疗组在TACE治疗后给予射波刀治疗。术后3~7 d于CT引导下向肝内植入金标3~5颗,5~7 d后用三维CT进行定位,定位2~3 d后开始针对肿瘤病灶行射波刀治疗。放疗期间给予抑酸、保护胃黏膜、保肝、防止呕吐等对症支持治疗。放疗设备采用美国Accuray公司生产的G4射波刀。
1.2.2.1 金标植入术 完善常规术前检查,包括体检、血常规、心肝肾功能、凝血功能及心电图等,应用2%利多卡因局部浸润麻醉,由CT引导下在无菌环境中进行穿刺操作,术后卧床6~12 h,给予止血药物治疗,同时密切监测生命体征。
1.2.2.2 CT定位及治疗前准备 采用真空垫固定,制作放疗体位固定装置。放疗中采用金标追踪及呼吸追踪技术。选用64排CT扫描采图。CT扫描图像输送到治疗计划系统,由医师和物理师共同勾画靶区和危及器官。结合CT、MRI或PET-CT等影像学资料,勾画大体肿瘤体积(gross tumor volume,GTV),GTV外放后为计划靶区(planning target volume,PTV),上下、前后、左右分别外放 2、1、1 cm,避开重要器官(胃、十二指肠、胰腺、肾和脊髓等)。
1.2.2.3 治疗计划实施 以100%等剂量线覆盖PTV,并以此为靶区处方剂量,单次靶区处方剂量4~12Gy,每天或隔1~2 d照射1次,单个靶区总剂量40~60Gy,分4~8次完成。放疗期间检测血常规及肝肾功能情况,一旦发生严重不良反应,立即终止治疗。
1.2.3 观察指标及疗效评估 术后1~3个月复查肝脏增强CT或MRI,并按照RECIST 1.1实体瘤的疗效判定标准分为完全缓解(complete remission,CR)、部分缓解(partial remission,PR)、进展(progressive disease,PD)和稳定(stable disease,SD)。比较2组的局部控制率(影像学上肿瘤无增大的患者占总数的比例)及临床获益率(CR┼PR┼SD之和)情况。然后对患者进行远期疗效评估:每1~3个月复查影像学检查,了解肿瘤有无复发转移,直至患者死亡或出现疾病进展;若出现肿瘤复发则可再次行介入或放射治疗,记录患者的总生存期、无疾病进展时间及术后6、12、18、24个月的总生存率。
1.3 统计学处理 用SPSS 19.0软件进行统计分析。2组间率的比较用四格表卡方检验或校正卡方检验。用Kaplan-Meier法估计生存率并绘制生存曲线,2条生存曲线的比较用long-rank检验。生存影响因素的分析用Cox回归分析。P<0.05表示差异有统计学意义。
2 结 果
2.1 生存分析 用Kaplan-Meier法估计生存率并绘制生存曲线进行生存分析。mOS生存曲线见图1,经long-rank检验,2条曲线差异有统计学意义(χ2=10.285,P=0.001)。治疗组和对照组的 mOS分别为19个月和10个月。2组均随访至2015年5月1日,治疗组术后随访6、12、18、24个月的生存例数和生存率分别为 53例(96.36%)、47例(85.45%)、32例(58.18%)、21例(41.00%);对照组分别为 43例(78.18%)、21例(38.18%)、17例(30.91%)、13例(23.64%)。治疗组生存率高于对照组。
mPFS生存曲线见图2。经long-rank检验,2条曲线差异有统计学意义(χ2=27.322,P=0.000),治疗组和对照组的mPFS分别为7个月和2.5个月。治疗组生存率高于对照组。
2.2 临床获益率和局部控制率 2组在治疗结束后1~3个月进行疗效评价,治疗组CR 0例,PR 21例(38.18%),SD 21例(38.18%),PD 13例(23.64%);对照组CR 0例,PR 4例(7.27%),SD 20例(36.37%),PD 31例(56.36%)。因此2组的临床获益率分别为76.36%和43.64%,差异有统计学意义。2组的局部控制率分别为90.91%和63.64%,差异有统计学意义(表2)。
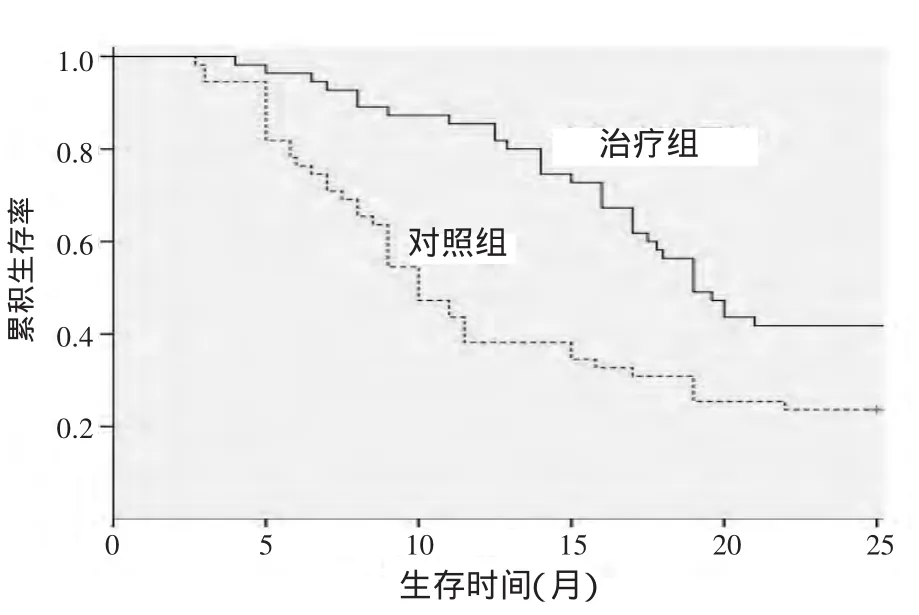
图1 2组OS生存曲线图Figure 1 OS survival curves of the 2 groups
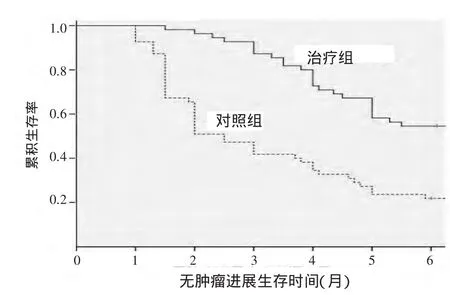
图2 2组PFS生存曲线图Figure 2 PFS survival curves of the 2 groups
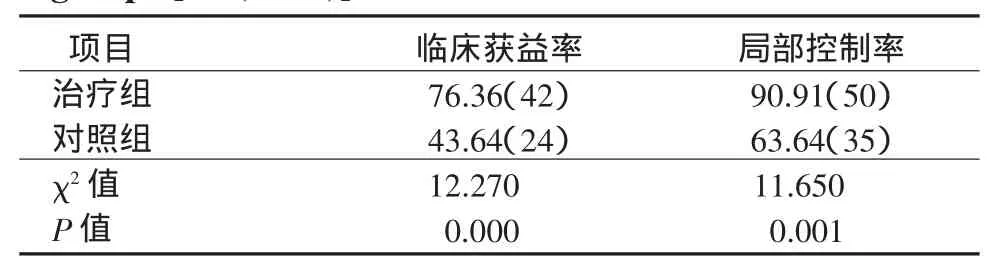
表2 2组临床获益率和局部控制率[百分率(例)]Table 2 Clinical benefit rate and local control rate of the 2 groups[%(cases)]
2.3 治疗组生存相关影响因素分析 采用Cox回归模型分析治疗组自变量肿瘤大小、数目、有无腹水、门脉癌栓、BCLC分期、肝功能Child-Pugh分级、性别、年龄和术前AFP水平等因素对总生存期的影响。结果显示,肿瘤大小和有无腹水是生存率影响因素。无腹水患者的死亡风险是有腹水的0.241倍,有腹水者死亡风险增加75.9%;肿瘤大小为5~10 cm患者的死亡风险是肿瘤>10 cm患者的0.38倍,肿瘤>10 cm时死亡风险增加62%。而性别、年龄、肿瘤数目、术前AFP水平、BCLC分期、门脉癌栓和肝功能Child-Pugh分级对患者生存率的影响无统 计学意义(表3)。
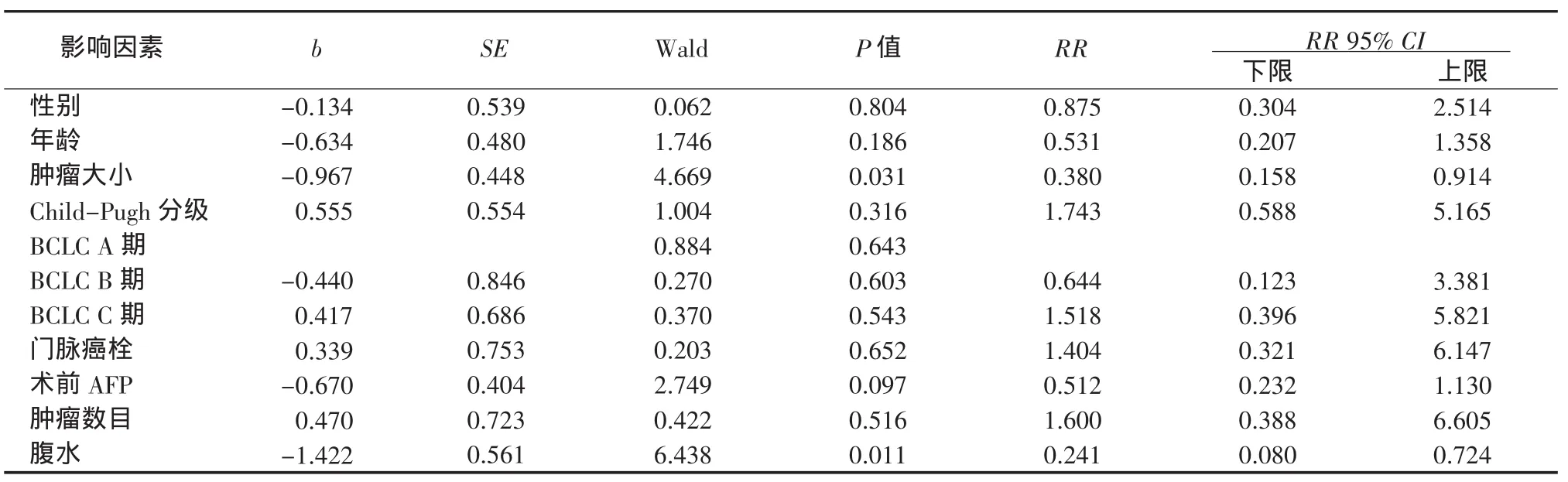
表3 治疗组Cox回归分析结果Table 3 Cox regression analysis in the treatment group
3 讨 论
大肝癌作为PLC的一个特殊类型,一直是治疗的难题。这部分患者常合并不同程度的肝硬化,且大多数包膜不完整,更易出现肝内转移、淋巴结和血管侵犯,根治机会较少,预后极差。目前我国的临床工作中,TACE在大肝癌治疗中的应用已远超越手术治疗,但单纯TACE难以使肿瘤完全坏死,疗效受到很大限制,且肿块越大,疗效越不理想。大肝癌的治疗进入了“瓶颈”,亟需新的治疗方法来打破这一现状。
精确放射治疗在肝癌治疗中所占的比例随着计算机技术和放射技术的不断提高而发生相应的变化,20世纪60年代放射治疗应用于肝癌治疗的比例为17.6%,70年代为42.4%,80年代为68.2%,1990年以后增长至80%以上,且精确放疗联合TACE可弥补单纯TACE的不足。国内回顾性资料显示,接受放疗的中晚期患者的中位生存期为25个月,较单纯介入治疗患者的生存期长,2组差异有统计学意义[3]。国外大量回顾性资料及一些前瞻性研究均显示,不论是单独接受精确放疗还是联合TACE,肝癌患者均可获益。虽然这些报道多数为回顾性或小的、单中心研究,但精确放疗似乎总是伴随着较高的局部控制率,据报道1~2年的局部控制率为70%~90%,与本文治疗组的局部控制率相近[4-15]。基于国内外大量文献支持,我国原发性肝癌诊疗规范(2011版)已明确推荐放疗用于中晚期肝癌患者。近几年,又有新的文献报道肝癌患者接受放疗的情况。2014年,Tanaka等[16]报道67例伴有肝内大血管受侵的肝癌患者接受3DCRT,肿瘤缓解率达到45%,应答组mOS为13.7个月,无应答组mOS为5.9个月。同年,Zou等[17]通过荟萃分析发现,对比单纯TACE,3DCRT联合TACE可显著提高患者1、2、3年生存率且有较高的肿瘤缓解率。
随着精确放疗在肝癌中的地位逐步得到确立,越来越多的国内外学者将精确放疗用于治疗大肝癌。Kang等[18]报道了27例肿瘤直径为8.8~11.4 cm的晚期肝癌患者行IMRT后总的有效率为44.4%。同年,Zhong等[19]对立体定向放疗联合TACE治疗≥10 cm PLT的疗效和安全性进行评估,72例接受立体定向放疗联合TACE治疗,中位总剂量为35.6Gy,分12~14次完成,单次剂量 2.6~3.0 Gy,在18个月的中位随访期间,仅有6例出现病情进展,总缓解率为79.1%,累计 1、3、5年生存率分别为 38%、12%、3%,中位生存期为12个月,治疗耐受性可,无RILD及3级以上不良反应发生。可见,精确放疗对大肝癌的治疗是安全有效的。
虽然文献中单次放疗剂量不同,但公认安全有效的是单次大剂量、治疗次数少的剂量分割方式(即所谓的超分割放射治疗),而不是传统放疗的常规分割方式(1.8~2.0 Gy/次)。目前应用于临床的3DCRT、IMRT、IGRT及TOMO刀和射波刀等均可达到单次大剂量、治疗次数少的剂量分割,这种放疗方式可有效保护肿瘤周围正常肝组织,减少RILD发生率,从而使得放疗在肝癌治疗中获得了技术上的实现。
射波刀作为图像引导下的放疗技术,是放疗技术发展的新高度,它可通过金标及呼吸等6大追踪技术减少呼吸时肝脏动度对照射的影响,从而实现肿瘤的精确定位,并可通过非共面、非等中心的照射来减少射线对周围组织的损伤,可谓精确、安全、有效,且技术上的先进性使得超分割放疗由射波刀执行相对于其他放疗技术更为容易。本研究分析了55例大肝癌患者接受精确放疗联合TACE的情况,其mPFS、mOS及1年临床获益率、局部控制率方面均优于单纯TACE组。在2年生存率方面,治疗组与对照组相比,虽无统计学意义,但仍较对照组高。这提示TACE术后联合精确放疗能提高肿瘤局部控制率,延缓肿瘤复发,并延长总生存期,该结果与国内外文献报道一致。但本研究为回顾性资料,且样本量小,可能对结果造成一定的偏倚,此外尚缺乏长期随访数据,另外在比较2组间差异时未发现潜在的混淆因素,最后治疗组所接受照射剂量相对集中,未将治疗剂量进行分组并观察其疗效与剂量的相关性。因此,为获取高级别的循证医学证据并指导临床,应积极开展前瞻性的随机、对照、多中心的大型临床研究,且应增加更多的因素如肝炎肝硬化、病毒载量、心血管疾病、吸烟、饮酒等,以期得到更可靠的结论。
[1]中华人民共和国卫生部.原发性肝癌诊疗规范(2011年版)[J].临床肿瘤学杂志,2011,17(10):926-946.
[2]Wang JH,Wang CC,Hung CH,et al.Survival comparison between surgical resection and radiofrequency ablation for patients in BCLC very early/early stage hepatocellular carcinoma[J].JHepatol,2012,56(2):412-419.
[3]Zeng ZC,Yang P,Wang BL,et a1.Poor lipiodol accumulation is an unfavorable predictor in hepatocellular carcinoma patients treated with combination transcatheter arterial chemoembolization and external beam radiotherapy[J].Int JRadiat Oncol Biol Phys,2011,(Suppl 81):352-353.
[4]Cárdenes HR,Price TR,Perkins SM,etal.Phase I feasibility trial of stereotactic body radiation therapy for primary hepatocellular carcinoma[J].Clin Transl Oncol,2010,12(3):218-225.
[5]Bujold A,Massey CA,Kim JJ,etal.Sequential phase Iand II trials of stereotactic body radiotherapy for locally advanced hepatocellular carcinoma[J].JClin Oncol,2013,31(13):1631-1639.
[6]Sanuki N,Takeda A,Oku Y,et al.Stereotactic body radiotherapy for small hepatocellular carcinoma:a retrospective outcome analysis in 185 patients[J].Acta Oncol,2014,53(3):399-404.
[7]Kang JK,Kim MS,Cho CK,etal.Stereotactic body radiation therapy for inoperable hepatocellular carcinoma as a local salvage treatment after incomplete transarterial chemoembolization[J].Cancer,2012,118(21):5424-5431.
[8]Andolino DL,Johnson CS,Maluccio M,etal.Stereotactic body radiotherapy for primary hepatocellular carcinoma[J].Int J Radiat Oncol Biol Phys,2011,81(4):e447-e453.
[9]Louis C,Dewas S,Mirabel X,et al.Stereotactic radiotherapy of hepatocellular carcinoma:preliminary results[J].Technol Cancer Res Treat,2010,9(5):479-487.
[10]Kwon JH,Bae SH,Kim JY,et al.Long-term effect of stereotactic body radiation therapy for primary hepatocellular carcinoma ineligible for local ablation therapy or surgical resection.Stereotactic radiotherapy for liver cancer[J].BMC Cancer,2010,10:475.
[11]Seo YS,Kim MS,Yoo SY,et al.Preliminary result of stereotactic body radiotherapy as a local salvage treatment for inoperable hepatocellular carcinoma[J].JSurg Oncol,2010,102(3):209-214.
[12]Huang WY,Jen YM,Lee MS,et al.Stereotactic body radiation therapy in recurrent hepatocellular carcinoma[J].Int JRadiat Oncol Biol Phys,2012,84(2):355-361.
[13]Honda Y,Kimura T,Aikata H,et al.Stereotactic body radiation therapy combined with transcatheter arterial chemoembolization for smallhepatocellular carcinoma[J].JGastroenterolHepatol,2013,28(3):530-536.
[14]Bae SH,Kim MS,Cho CK,etal.Feasibility and efficacy of stereotactic ablative radiotherapy for Barcelona clinic liver cancer-C stage hepatocellular carcinoma[J].JKorean Med Sci,2013,28(2):213-219.
[15]Xi M,Zhang L,Zhao L,et al.Effectiveness of stereotactic body radiotherapy for hepatocellular carcinoma with portal vein and/or inferior vena cava tumor thrombosis[J].PLoSOne,2013,8(5):e863-864.
[16]Tanaka Y,Nakazawa T,Komori S,et al.Radiotherapy for patients with unresectable advanced hepatocellular carcinoma with invasion to intrahepatic large vessels:efficacy and outcomes[J].JGastroenterol Hepatol,2014,29(2):352-357.
[17]Zou LQ,Zhang BL,Chang Q,et al.3D conformal radiotherapy combined with transcatheter arterial chemoembolization for hepatocellular carcinoma[J].World JGastroen terol,2014,20(45):17227-17234.
[18]Kang MK,Kim MS,Kim SK,et al.High-dose radiotherapy with intensity-modulated radiation therapy for advanced hepatocellular carcinoma[J].Tumori,2011,97(6):724-731.
[19]Zhong NB,Lv GM,Chen ZH.Stereotactic body radiotherapy combined with transarterialchemoembolization for huge(≥10 cm)hepa-tocellular carcinomas:a clinical study[J].MolClin Oncol,2014,2(5):839-844.

