医院获得性耐甲氧西林金黄色葡萄球菌中PSM-α基因检测及相关研究
于 淼,赵自云,刘成玉,牟晓峰
(1青岛大学医学院,山东 青岛 266021;2青岛大学医学院第二附属医院,山东 青岛 266021)
耐甲氧西林金黄色葡萄球菌(methicillinresistantStaphylococcusaureus,MRSA)是临床上引起鼻腔、口腔黏膜、皮肤和上皮组织的感染,并导致炎症化脓的重要病原菌之一。目前,MRSA按来源分为社区获得性 MRSA(community-acquired MRSA,CA-MRSA)和医院获得性 MRSA(hospitalacquired MRSA,HA-MRSA)。近年来,国内外学者致力于MRSA毒力因子的研究,发现一种称为酚溶调制肽(phenol soluble modulin,PSM)的新型毒力因子。PSM最初由Mehlin等人从表皮葡萄球菌UW-3株的培养液上清中分离,包括由染色体基因组编码的 PSM-α、PSM-β、PSM-γ,以及由位于可移动遗传元件SCCmec上的psm-mec基因编码的PSM-mec[1]。研究[2-3]表明,CA-MRSA 菌株可以分泌PSM-α、PSM-β和PSM-γ,而 HA-MRSA菌株只能分泌PSM-β和PSM-γ,PSM-α和PSM-γ能够溶解中性粒细胞和红细胞等,而PSM-β则缺乏这一活性。本研究采用聚合酶链反应(PCR)方法检测本地区CA-MRSA和HA-MRSA菌株中PSM-α基因的分布,并通过细胞形态学方法来观察PSM-α对人外周血中性粒细胞的溶解作用。
1 材料与方法
1.1 材料
1.1.1 菌株来源 90株不重复 MRSA菌株分离自青岛大学医学院第二附属医院及周边医院住院和社区患者的各种标本,包括痰、血、脓液、粪便、伤口分泌物、口腔分泌物、导管、胸腔积液等。本实验室采用多重PCR方法对菌株SCCmecc型别进行了鉴定,其中型别为 SCCmecⅢ 80 株(88.89%),SCCmecⅡ6株(6.67%),SCCmecⅤ2株(2.22%),SCCmecⅢ、SCCmecⅤ混合型2株(2.22%)。根据SCCmecⅠ、SCCmecⅡ、SCCmecⅢ型主要分布于HA-MRSA菌株中,SCCmecⅣ、SCCmecⅤ型主要分布 于 CA-MRSA 菌株中 的标准进 行 分 类[4-6],90株MRSA菌株中 HA-MRSA86株,CA-MRSA 4株,质控菌株为金黄色葡萄球菌ATCC25923。
1.1.2 主要仪器与试剂 超速低温离心机购自德国Eppendorf公司,BIO-RAD梯度PCR仪购自美国BIO-RAD公司,BYCP-31PN电泳仪购自北京六一仪器厂,GeIX1850型凝胶成像分析系统购自上海欧祥科学仪器有限公司,数显恒温水浴箱购自上海荣计达实验仪器有限公司,普通光学显微镜购自日本Olympus公司,BIOWEST AGAROSE G-10购自西班牙。4%台盼蓝染液由本实验室配制,DNA提取液、TixTap酶及PCR反应相关试剂、DL1000 DNA Marker、上样缓冲液等试剂,均购自宝生物工程(大连)有限公司,人或各种动物外周血中性粒细胞分离液试剂盒购自天津市灏洋生物制品科技有限责任公司。
1.1.3 引物设计与合成 根据 GenBank(http://www.ncbi.nlm.nih.gov)公布的基因序列,利用Primer Premier 5.0软件设计合成引物,PSM-α基因上游引物序列为:ATGGGTATCATCGCTGGCATCATTAAAGTT,下游引物序列:TTTTGCGAAAATGTCGATAATTGCTTTGAT,产物大小为406 bp,由宝生物工程(大连)有限公司合成。
1.2 方法
1.2.1 细菌基因组DNA提取 将冷冻菌株转种于哥伦比亚血琼脂培养基上,于37℃培养箱中过夜培养。取50μL DNA提取液于灭菌的EP管中,用灭菌吸头挑取单菌落,置于EP管中混匀,80℃热变性15 min后,100℃水浴20 min,10 000 r/min离心10 min,裂解后的上清液作为PCR反应的模板。
1.2.2 扩增PSM-α基因 PCR反应体系为25μL,其中10×Buffer缓冲液2.5μL、dNTP2μL、TixTap酶0.15μL、MgCl22μL、上下游引物各1μL、DNA模板2μL、加灭菌去离子水补足25μL。反应条件为94℃预变性5 min,94℃变性35 s,60℃退火45 s,72℃延伸45 s,进行35个循环,最后72℃延伸10 min。
1.2.3 PCR产物检测 PCR产物在1.5%琼脂糖凝胶中电泳,以DL1000 DNA Marker为相对分子质量标准,用凝胶成像分析系统观察电泳结果。
1.2.4 DNA测序 PCR扩增阳性产物送宝生物工程(大连)有限公司进行序列测定,结果与Gen-Bank序列数据库标准序列进行比对分析。
1.2.5 中性粒细胞死亡率检测 按照试剂盒操作说明分离健康成人外周静脉血(EDTA-K2抗凝)中性粒细胞,重悬培养液中。取4份体积均为100μL的中性粒细胞悬液,分别加入30μL的0.5麦氏单位的PSM-α阳性 MRSA菌液、0.5麦氏单位的PSM-α阴性 MRSA菌液、0.5麦氏单位的ATCC 25923菌液、生理盐水,充分混匀,放入培养箱孵育3 h后,用台盼蓝染液染色并在显微镜下计数中性粒细胞死亡率。计算公式:死亡率(%)=染色细胞数/(未染色细胞数+染色细胞数)×100%。
1.3 统计分析 应用SPSS 17.0软件进行统计学分析,将数据进行反正弦转换后进行单因素方差分析,P≤0.05为差异有统计学意义。
2 结果
2.1 MRSA菌株PSM-α携带情况 86株 HA-MRSA中PSM-α基因阳性78株,阳性率为90.70%;4株CA-MRSA中,2株PSM-α基因阳性,阳性率为50.00%。PCR产物电泳结果见图1。
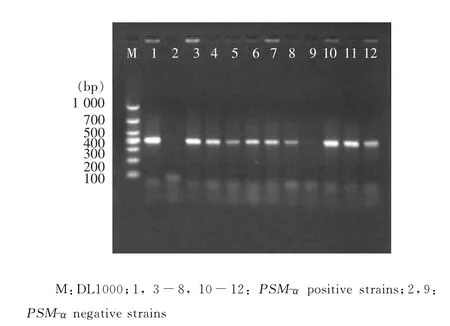
图1 PSM-α基因的PCR产物电泳图Figure 1 Electrophoresis map of PCR product of PSM-α gene
2.2 基因测序结果 测序结果与GenBank序列数据库标准序列(JQ066321.1)比对,结果完全一致。2.3 中性粒细胞死亡率 MRSAPSM-α阳性组中性粒细胞死亡率与生理盐水组、PSM-α阴性组、ATCC25923组间比较,差异有统计学意义(P=0.001),PSM-α阳性组死亡率高于其他3 组,而PSM-α阴性组和ATCC25923组差异,无统计学意义(P=0.886),见表1。PSM-α阳性组与PSM-α阴性组对细胞的毒性结果见图2~3。
表1 MRSAPSM-α使中性粒细胞死亡情况的比较(±s,%)Table 1 Comparison of neutrophil death induced by MRSAPSM-α(±s,%)
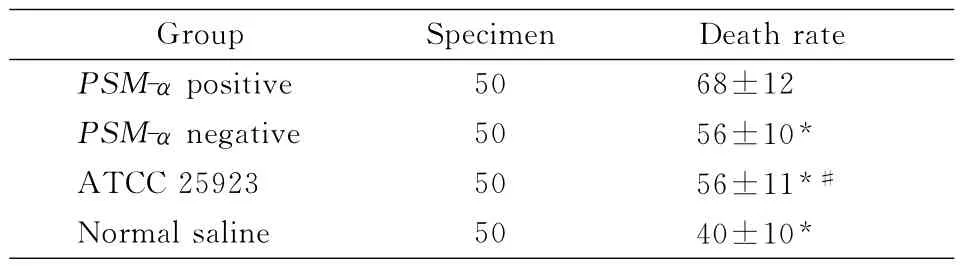
表1 MRSAPSM-α使中性粒细胞死亡情况的比较(±s,%)Table 1 Comparison of neutrophil death induced by MRSAPSM-α(±s,%)
Note:* Compared with PSM-α positive group,P=0.001;#:Compared with PSM-αnegative group,P=0.886
ecimen Death rate PSM-αpositive Group Sp 50 68±12 PSM-αnegative 50 56±10*ATCC25923 50 56±11*#Normal saline 50 40±10*
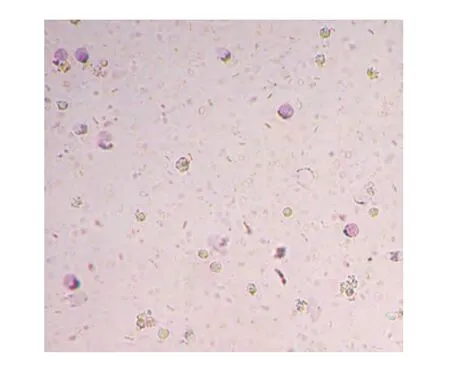
图2 MRSA PSM-α基因阳性组细胞毒性结果Figure 2 Results of cytotoxicity in PSM-αgene positive MRSA group
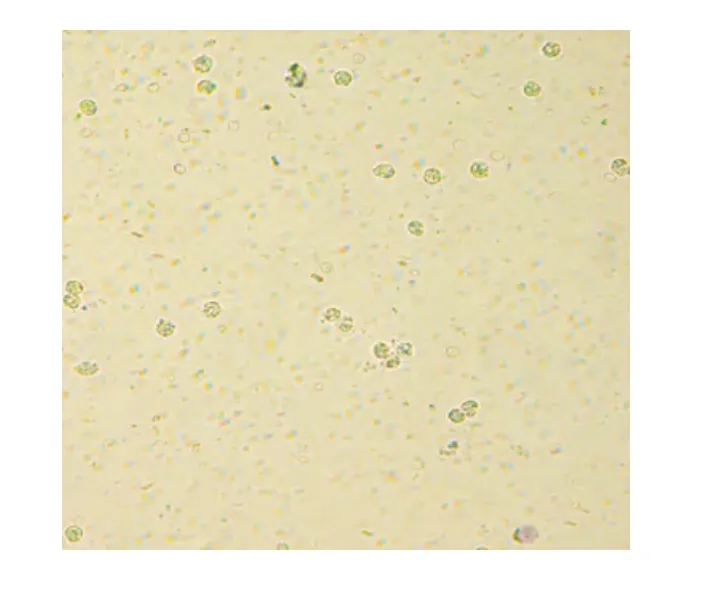
图3 MRSA PSM-α基因阴性组细胞毒性结果Figure 3 Results of cytotoxicity in PSM-αgene negative MRSA group
3 讨论
自2000年美国报道CA-MRSA以来,越来越多的研究者致力于其高致病力机制的研究[7]。研究[2-3]发现,在鼠脓肿和菌血症模型中PSM-α基因缺失菌株的毒力弱于野生型菌株,并证实了PSM-α能够刺激并溶解人的中性粒细胞,最终破坏人体应对金黄色葡萄球菌感染的细胞免疫防御系统,认为CA-MRSA菌株的高毒力是由于其可以分泌具有溶解中性粒细胞活性的PSM-α,而HA-MRSA则不能分泌PSM-α。本研究中,86株 HA-MRSA 中PSM-α基因阳性78株,阳性率为90.70%,这与国外研究[2-3,8]的结果不同,可能因为国内临床治疗中抗菌药物的滥用,导致HA-MRSA菌株毒力增强,但具体原因有待进一步研究。本研究检测到的CA-MRSA菌株过少,无法进行HA-MRSA和CA-MRSA菌株中PSM-α阳性率差异的统计学分析。
中性粒细胞是机体免疫防御系统的第一道防线,通过吞噬作用识别并摄取病原体,随后产生活性氧或脱颗粒作用杀伤病原体,起到局部控制感染的作用[9]。分泌PSM-α的MRSA菌株被中性粒细胞吞噬后,PSM-α可以促进中性粒细胞的胞内溶解,延缓细胞凋亡,使病原菌大量存活,最终逃脱中性粒细胞的杀伤作用,导致疾病的发生[10-11],但 PSM-β不能在这一过程中发挥作用[12]。
为进一步了解本地区分离的HA-MRSA所分泌的PSM-α是否也具有促进中性粒细胞溶解的活性,本研究比较PSM-α基因阳性菌株和阴性菌株对人中性粒细胞的影响,结果表明分泌PSM-α的MRSA对中性粒细胞的溶解作用高于不分泌PSM-α的MRSA,而不分泌PSM-α的MRSA与ATCC25923的溶解作用无差异。
综上所述,本研究有助于我们进一步了解MRSA菌株能够逃脱中性粒细胞杀伤作用的机制,为临床寻找治疗MRSA感染的新途径及金黄色葡萄球菌疫苗的制备提供了理论依据。
[1]Queck SY,Khan BA,Wang R,et al.Mobile genetic elementencoded cytolysin connects virulence to methicillin resistance in MRSA[J].PLoS Pathog,2009,5(7):e1000533.
[2]Wang R,Braughton KR,Kretschmer D,et al.Identification of novel cytolytic peptides as key virulence determinants for community-associated MRSA[J].Nature Med,2007,13(12):1510-1514.
[3]Cheung GY,Duong AC,Otto M.Direct and synergistic hemolysis caused byStaphylococcusphenol-soluble modulins:implications for diagnosis and pathogenesis[J].Microbes Infect,2012,14(4):380-386.
[4]杨延成,程航,饶贤才,等.SCCmec遗传元件及其在耐甲氧西林金黄色葡萄球菌分子分型中的应用[J].遗传,2015,37(5):442-451.
[5]潘军,刘文恩,张运丽,等.耐甲氧西林金黄色葡萄球菌SCCmec基因分型及PVL基因研究[J].中华医院感染学杂志,2010,20(17):2541-2544.
[6]李囡,范红,陈慧莉,等.耐甲氧西林金黄色葡萄球菌基因分型研究[J].中国现代医学杂志,2008,18(15):2122-2126.
[7]Kennedy AD,Otto M,Braughton KR,et al.Epidemic community-associated methicillin-resistantStaphylococcusaureus:recent clonal expansion and diversification[J].Proc Natl Acad Sci U S A,2008,105(4):1327-1332.
[8]Li M,Diep BA,Villaruz AE,et al.Evolution of virulence in epidemic community-associated methicillin-resistantStaphylococcusaureus[J].Proc Natl Acad Sci U S A,2009,106(14):5883-5888.
[9]Kobayashi SD,Voyich JM,Burlak C,et al.Neutrophils in the innate immune response[J].Arch Immunol Ther Exp(Warsz),2005,53(6):505-517.
[10]Rigby KM,DeLeo FR.Neutrophils in innate host defense againstStaphylococcusaureusinfections[J].Semin Immunopathol,2012,34(2):237-259.
[11]Surewaard BG,de Haas CJ,Vervoort F,et al.Staphylococcal alpha-phenol soluble modulins contribute to neutrophil lysis after phagocytosis[J].Cell Microbiol,2013,15(8):1427-1437.
[12]Grosz M,Kolter J,Paprotka K,et al.Cytoplasmic replication ofStaphylococcusaureusupon phagosomal escape triggered by phenol-soluble modulin-α[J].Cell Microbiol,2014,16(4):451-465.

