青岛两所医院鲍曼不动杆菌碳青霉烯酶基因及同源性分析
李 茜,李庆淑,李 智,曲 彦,胡 丹
(青岛大学医学院附属青岛市立医院,山东 青岛 266071)
鲍曼不动杆菌(Acinetobacterbaumannii,AB)是一种非发酵的革兰阴性条件致病菌,可引起各组织和器官感染,包括肺炎、脑膜炎、菌血症、尿路感染和伤口感染等[1]。碳青霉烯类抗生素具有广谱抗菌活性,是目前临床上治疗重症感染的主要抗菌药物。但近年来,随着碳青霉烯类抗生素的广泛应用,对碳青霉烯药物耐药的AB已在全球流行,其治疗已成为世界性难题,对其耐药机制的研究具有重要意义。产碳青霉烯酶是AB对碳青霉烯耐药的重要原因,水解药物的碳青霉烯酶主要有B类金属酶和D类OXA型酶。为了解青岛市两所医院AB耐药情况及碳青霉烯酶基因携带情况,笔者对临床收集的145株AB进行耐药分析,检测其碳青霉烯酶基因携带情况,并进行同源性分析,了解菌株耐药性的演变和耐药基因分布,为临床抗菌药物的合理使用,预防和控制医院感染流行提供可靠依据。
1 资料与方法
1.1 菌株来源 收集青岛市两所医院2013年7月—2014年7月住院患者临床标本分离的AB,共145株,其中A院78株,B院67株,剔除同一患者相同部位重复分离株。质控菌株为铜绿假单胞菌ATCC27853、大肠埃希菌ATCC25922。
1.2 药敏试验 采用纸片扩散法测定细菌对抗菌药物的敏感性,试验结果判断参照美国临床实验室标准化协会(CLSI)2012年标准。
1.3 细菌DNA模板制备 取菌环挑取单一菌落置于LB液体培养液中,在摇箱中过夜培养(37℃,180 r/min),取 浑浊的菌液于1.5 mL EP 管 内,6 000 r/min离心10 min,弃上清,向EP管内加入200μL高压超纯水,吹打混匀后100℃水浴10 min,随后4℃冷却5 min;4℃,12 000 r/min离心3 min;吸取上清液移入另一新的0.5 mL EP管内,即为聚合酶链反应(PCR)检测模板,-20℃冰箱保存备用。1.4 基因检测 PCR反应体系为25μL,含3μL DNA模板,0.2μL Taq酶,2.5μL10×Taq缓冲液(含15 mmol/L MgCl2),2μL2.5 mmol/L dNTP,10μmol/L上下游引物各1μL,15.3μL水。PCR反应条件:94℃预变性5 min;94℃变性30 s,退火30 s(温度51~58℃),72℃延伸60s,共35个循环;最后72℃延伸10 min。肠杆菌基因间一致重复序列(ERIC)-PCR反应条件:94℃预变性5 min,94℃变性1 min,45℃退火1 min,72℃延伸2 min,35个循环后,72℃延伸10 min。产物长度<500 bp,采用2%琼脂糖凝胶进行电泳;产物长度>500 bp,采用1.2%琼脂糖凝胶进行电泳,紫外投射仪观察结果。各靶基因引物序列见表1。

表1 PCR引物序列及产物长度Table 1 The sequences of PCR primers and length of products
1.5 统计分析 应用SPSS 19.0软件进行统计分析,采用秩和检验对两院AB耐药情况进行比较,χ2检验对两院耐药基因携带率进行比较,P≤0.05为差异有统计学意义。
2 结果
2.1 标本类型及科室分布 两所医院标本主要分离自痰(A院75.64%,B院85.07%)、分泌物(A 院11.54%)、组织、引流液、尿、导管末端、胸腔积液等。A院标本主要分离自重症监护室(ICU,37.18%)、高压氧病区(15.38%)、干部病房(12.82%)和手外科(8.97%);B院标本主要分离自ICU(79.10%)和呼吸科(8.96%)。
2.2 药敏结果 A院碳青霉烯耐药AB68株,敏感10株;B院碳青霉烯耐药AB60株,敏感7株。A院AB对头孢哌酮/舒巴坦耐药率最低(3.85%),其次是米诺环素(16.67%);对其他抗菌药物耐药率均>73%。B院AB对米诺环素和替加环素均不耐药,对阿米卡星和左氧氟沙星的耐药率分别为23.88%、38.81%,对其他抗菌药物的耐药率均>64%。两院菌株对哌拉西林/他唑巴坦、头孢吡肟、亚胺培南、美罗培南、庆大霉素的耐药率比较,差异无统计学意义;其他抗菌药物耐药率比较,差异均有统计学意义。见表2。
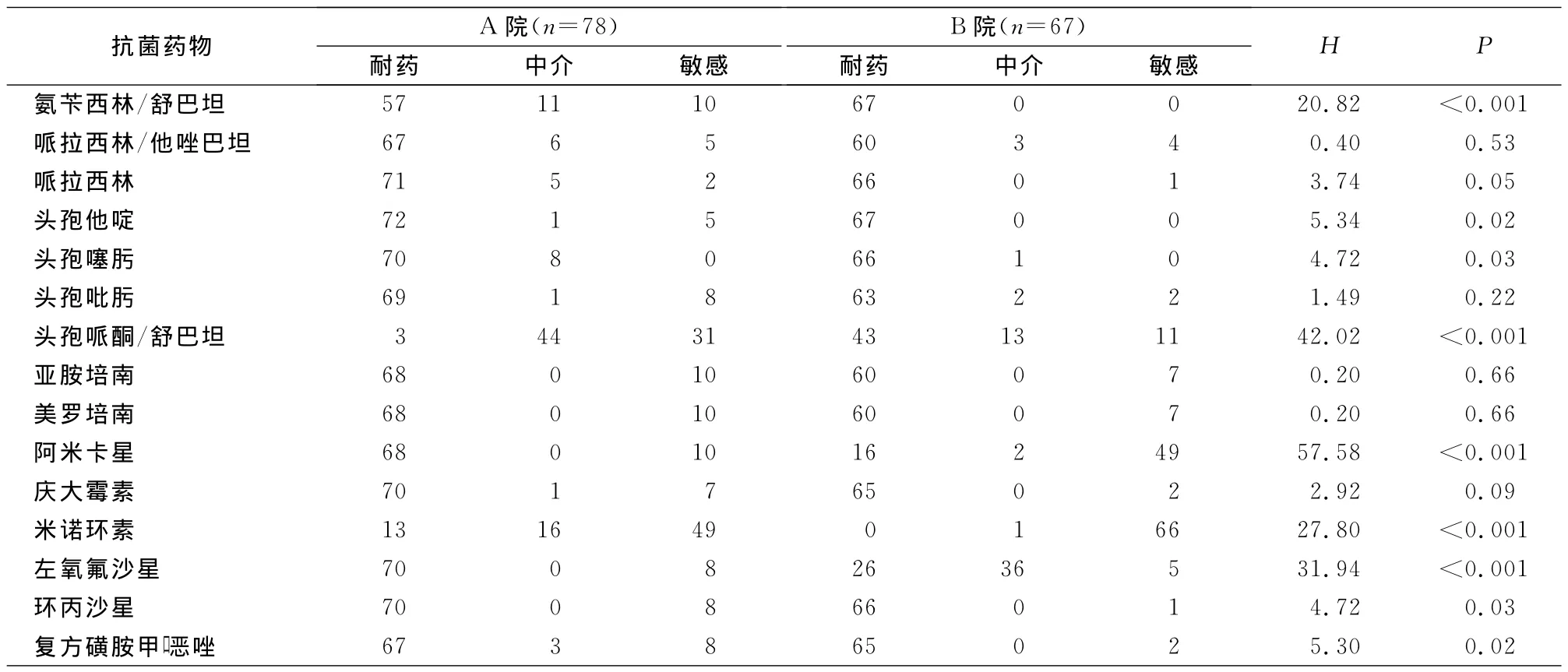
表2 两院AB耐药情况比较(株)Table 2 Comparison in antimicrobial resistance of AB between two hospitals(No.of isolates)
2.3 PCR扩增结果 两院所有菌株均携带OXA-51基因,均未检出SIM-1、IMP-1、IMP-2、VIM-1、VIM-2、OXA-24基因。A、B两院碳青霉烯耐药组OXA-23基因的携带率分别为 86.76%(59/68),56.67%(34/60),差异有统计学意义(χ2=14.53,P<0.001);两院碳青霉烯敏感组OXA-23基因均为阴性。A院3株菌携带OXA-58基因,B院未检出OXA-58基因。电泳结果见图1。
2.4OXA-23基因阳性与阴性株耐药率 除头孢哌酮/舒巴坦、米诺环素、头孢呋辛外,A院OXA-23基因阳性株和阴性株对其他抗菌药物的耐药率差异均有统计学意义(均P<0.05);除亚胺培南、美罗培南、左氧氟沙星、头孢哌酮/舒巴坦及哌拉西林/他唑巴坦外,B院OXA-23基因阳性株和阴性株对其他11种抗菌药物的耐药率比较,差异均无统计学意义(均P>0.05)。见表3。
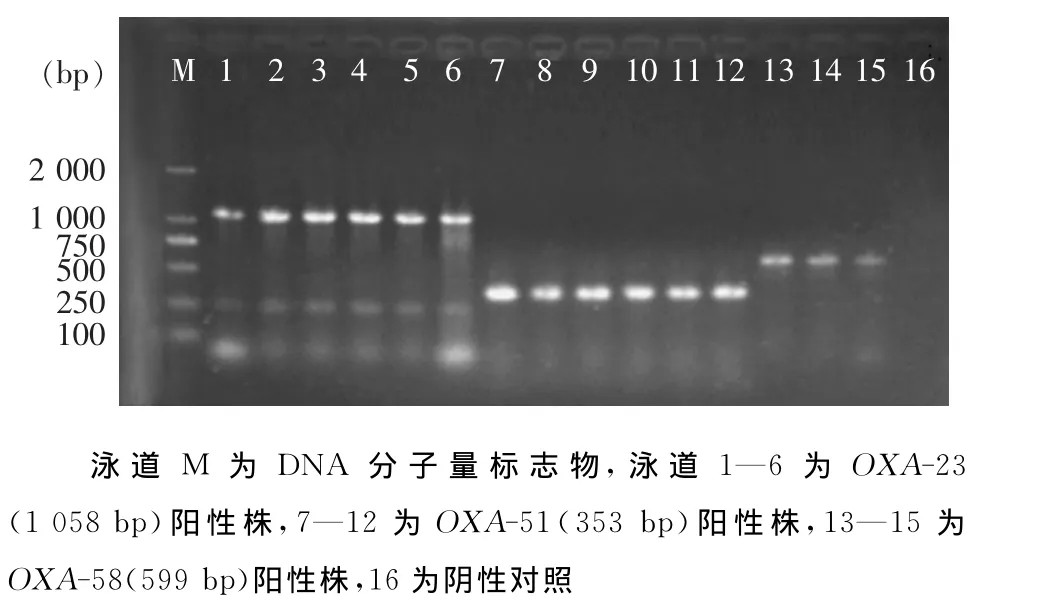
图1 AB碳青霉烯酶基因检测PCR产物电泳图Figure 1 Electrophoresis results of PCR products of AB carbapenemase genes
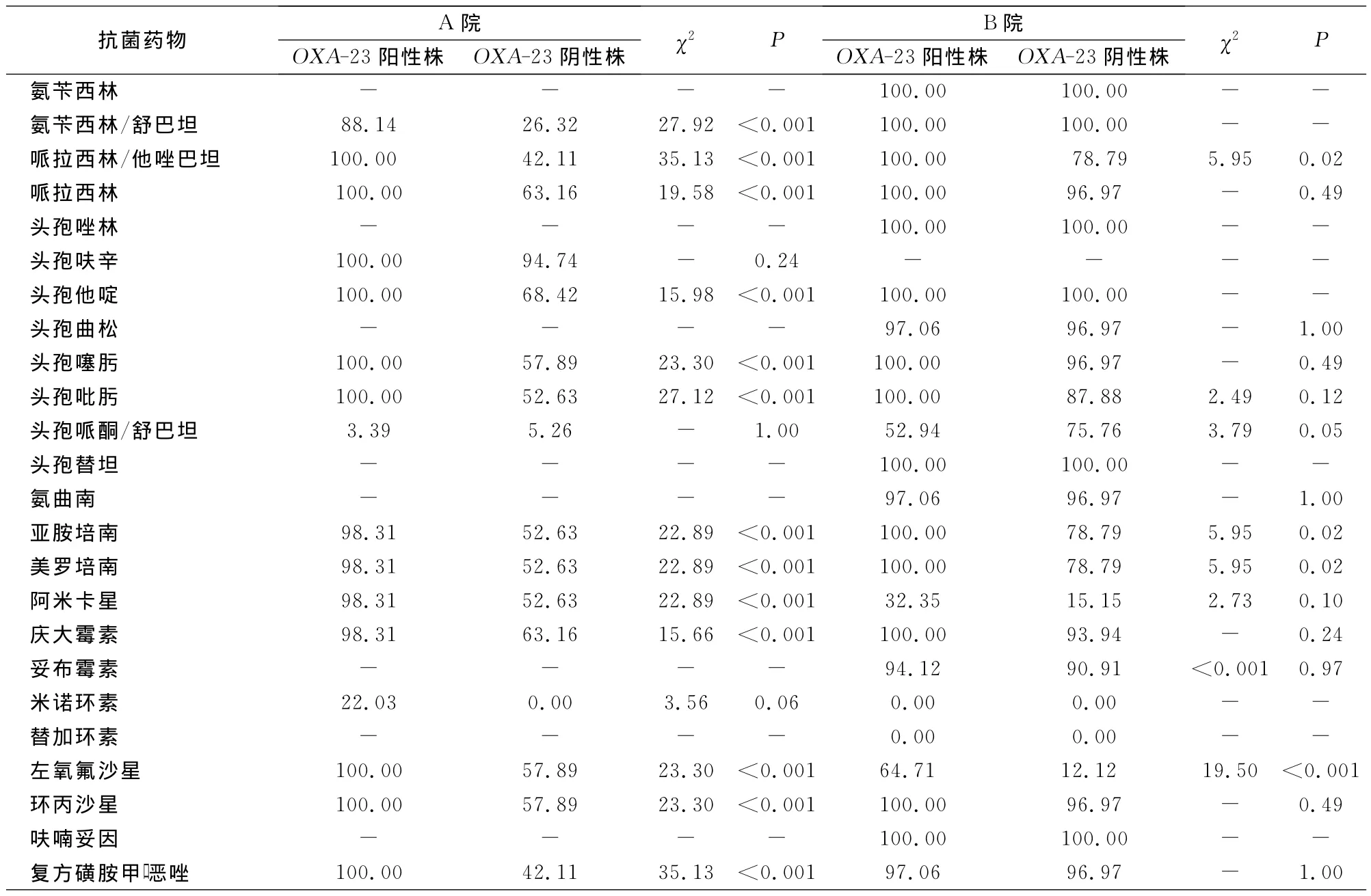
表3 两院AB对常用抗菌药物的耐药率(%)Table 3 Antimicrobial resistant rates of AB from two hospitals(%)
2.5 同源性分析 根据ERIC-PCR扩增产物的电泳带型(见图2),运用BIO-1D软件分析各菌株所有条带分子量大小进行聚类分析。两院所有菌株共分为8个基因型(分别用 A、B、C、D、E、F、G、H 表示),其中A型71株和E型37株,为主要流行株。A型又分为4个亚型,E型分为3个亚型。聚类分析见图3。A院菌株共分为6种类型(除D、F型)主要是 A 型(46.15%)和E型(41.03%);B院共分为8种类型,主要是 A 型 (52.24%)和 C 型(17.91%)。见表4。
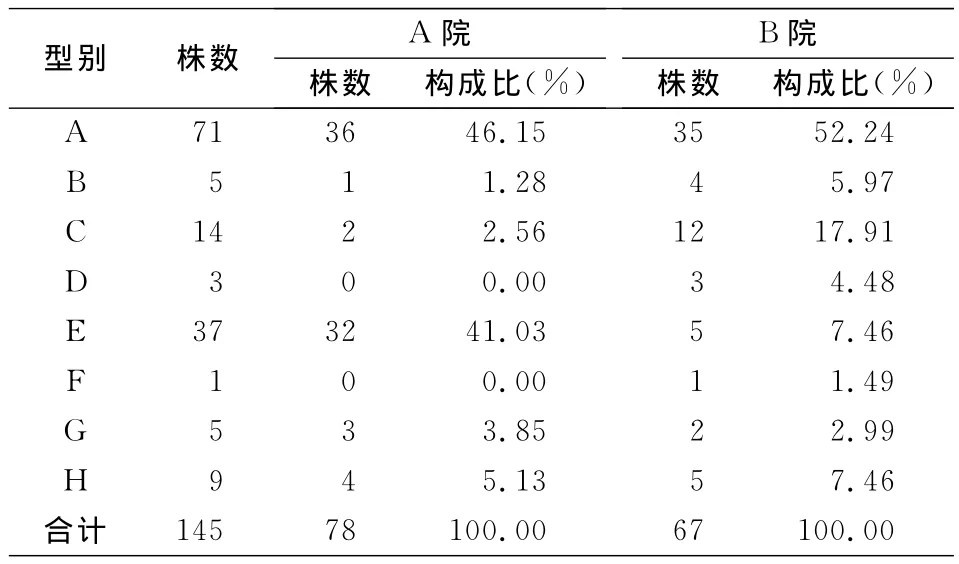
表4 两院AB基因分型构成Table 4 Constituent ratios of genotypes of AB from two hospitals
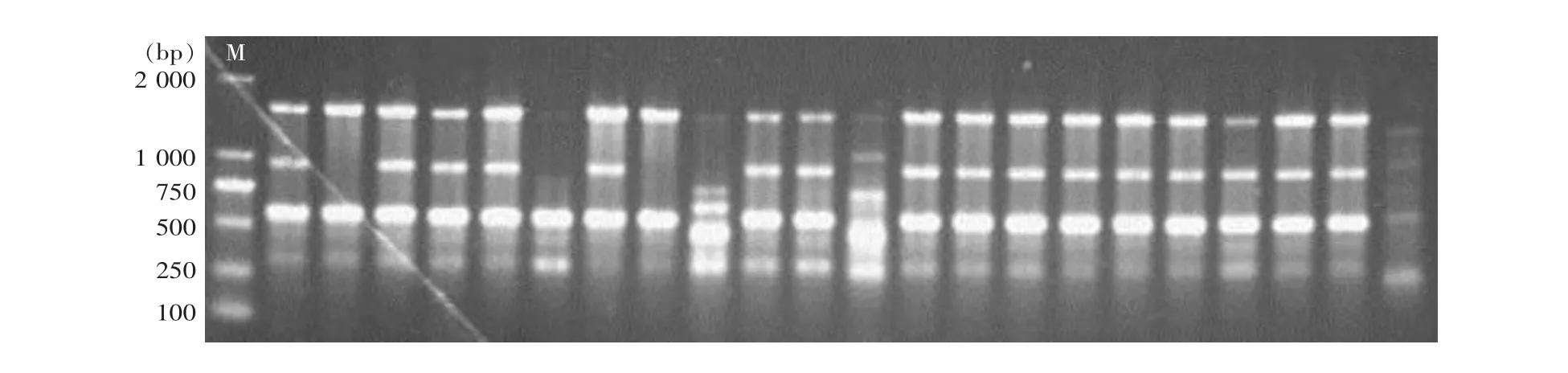
图2 AB ERIC-PCR扩增产物电泳图Figure 2 Electrophoresis results of ERIC-PCR in AB strains
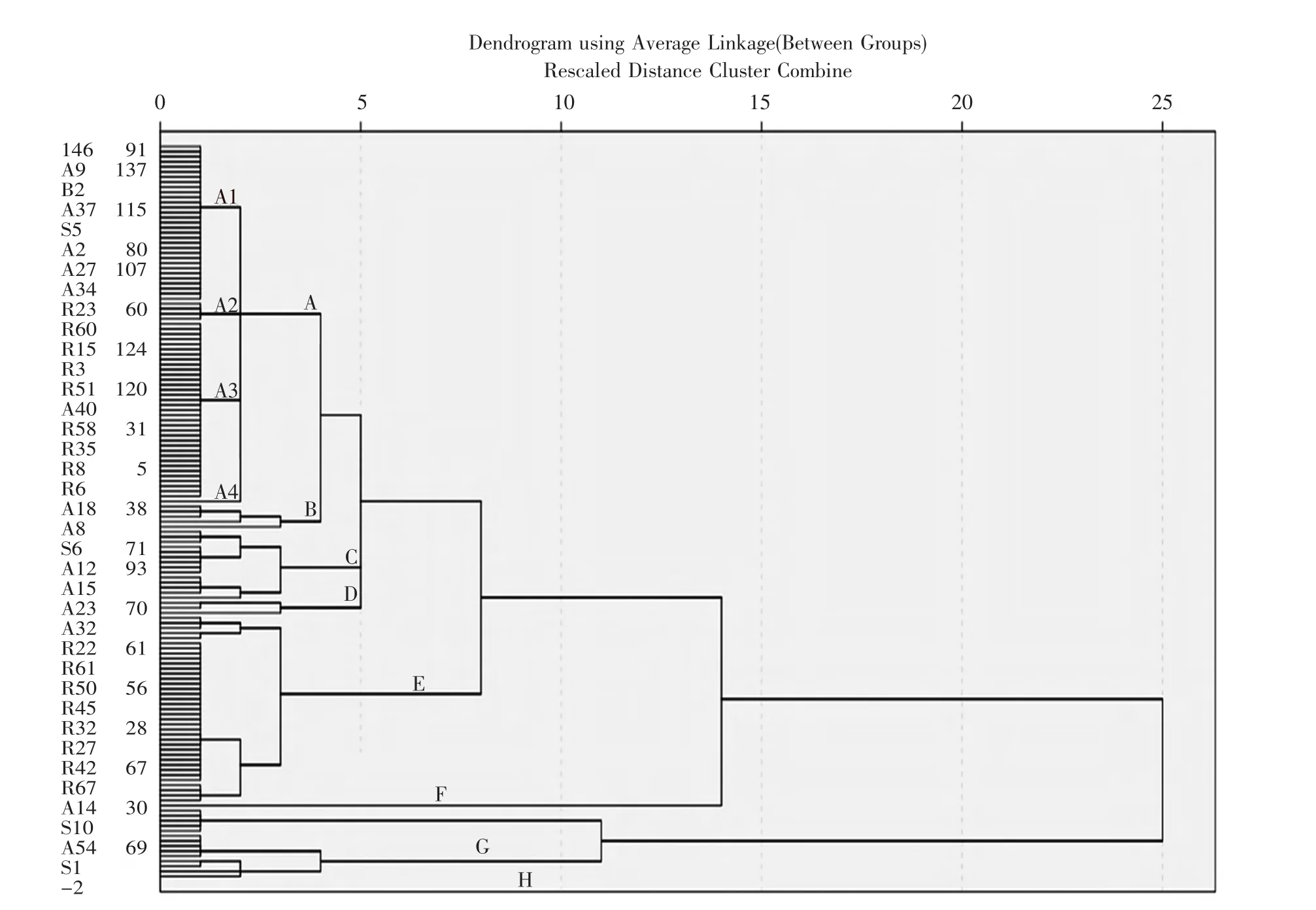
图3 基于ERIC-PCR谱型的两院AB聚类分析结果Figure 3 Hierarchical clustering of AB strains from two hospitals based on ERIC-PCR electrophoresis patterns
3 讨论
AB是医院感染的重要病原菌,随着抗菌药物的广泛运用,其耐药株逐年增加,并且开始由低耐药向高耐药,单一药耐药向多药耐药方向发展,世界各地也陆续出现有关多重耐药 AB(multidrugresistantAcinetobacterbaumannii,MDR-AB)或泛耐药 AB(extensively drug-resistantAcinetobacter baumannii,XDR-AB)的报道[2]。本研究显示,两院分离的AB主要来源于痰标本,表明AB在两所医院主要为下呼吸道感染;其在ICU分离率较高,可能与患者自身多有严重疾病、免疫能力较差,且长期使用广谱抗菌药物及侵入性操作(如气管插管、气管切开、吸痰、静脉置管)等有关。池细俤等[3]采用多因素回归分析结果显示,气管切开和使用呼吸机是MDRAB感染的独立危险因素。另外A院的高压氧病区和干部病区的AB分离率也较高,可能与手卫生差、抗菌药物使用不合理、侵入性操作、年龄等有关。
两院AB耐药性分析显示,耐药情况严重,呈现多重耐药和泛耐药。对氨基青霉素、第一代和第二代头孢菌素、第一代喹诺酮类抗菌药物几乎完全耐药;对舒巴坦复方制剂仍有较高的敏感性,可能与舒巴坦能直接作用于青霉素结合蛋白,并可以抑制细菌产生多种β-内酰胺酶有关[4]。两院菌株耐药情况比较对亚胺培南、美罗培南、哌拉西林、哌拉西林/他唑巴坦、头孢吡肟、庆大霉素差异无统计学意义,对其他抗菌药物差异均有统计学意义,可能与两院环境及抗菌药物选择不同有关。
目前,关于AB对碳青霉烯类药物耐药机制中产碳青霉烯酶的相关报道[5-7]最多。碳青霉烯酶是指能够水解碳青霉烯类药物的1类β-内酰胺酶,在我国主要是B类酶和D类酶。国际上,该菌所产的B类金属酶主要有IMP型、VIM型及SIM-1型,D类 OXA 型酶主要为OXA-23、OXA-24、OXA-51、OXA-58。报道[8]称OXA-51/66是AB天然固有的碳青霉烯酶基因。本实验中所有菌株均携带OXA-51基因,再次证明所有菌株均为AB。OXA-23基因在碳青霉烯敏感组中均为阴性,而耐药组中OXA-23基因携带率两院相比差异有统计学意义。此外OXA-23基因与某些抗菌药物的耐药情况有一定关联性,阳性菌株耐药率高于阴性株;且两院存在一定的差异,可能尚存其他多种耐药机制,有待进一步研究。B类金属酶基因SIM-1、IMP-1、IMP-2、VIM-1、VIM-2及OXA-24基因在两院中均为阴性,与国内其他地区报道[9-10]一致。A院3株 AB携带OXA-58基因,B院菌株OXA-58基因均为阴性。以上结果提示,两院AB对碳青霉烯类抗生素的耐药机制与产D类碳青霉烯酶有关,且主要产OXA-23与OXA-51型酶,尚未发现B类金属酶基因。
耐碳青霉烯AB的出现,使临床治疗和预防感染面临很大挑战,监测其耐药率和流行型别十分重要。ERIC-PCR是目前常用的简便、快速的基因分型技术,其分辨率较强,结果可靠,与细菌分子生物学分型技术的“金标准”脉冲场凝胶电泳(PFGE)分型有一定相关性[11]。ERIC-PCR的扩增产物多为一端有ERIC序列,而另一端为随机序列,小部分产物两端均为随机序列,可根据扩增产物条带位置分析基因的同源性。本研究中,两院所有菌株共分为8个基因型,其中A型71株和E型37株,为主要流行株。A院主要流行A型和E型,主要分布在ICU、呼吸内科、高压氧病区;B院主要流行A型和C型,主要分布在ICU、呼吸内科;其余型别以散发形式存在。A院3株OXA-58基因阳性株分属不同类型,说明A院未出现携带OXA-58基因的AB水平传播。其中A、B、C、D四个克隆型的谱带有较高程度的相似性,它们间的亲缘关系紧密。对于这些亲缘关系较近的菌株,可能来自于同一感染源或为某克隆系在外界环境条件的影响下分化形成的不同克隆型及亚型,具有追溯感染源的意义。A型菌株在两所医院均存在暴发流行,应深入研究这些携带A型菌株患者的临床资料,探讨是否因为相同或相似的临床感染、用药模式、传播途径等而分离出相同的细菌菌型。此外,ERIC分型的每一种型别均分散着OXA-23基因阳性株与阴性株,故认为携带此耐药基因与ERIC分型不一致,可能与细菌合并多种耐药机制,并可通过整合子等移动元件进行水平传播有关。以上结果提示在这一时期内,两所医院存在某种MDRAB的暴发流行,可能以克隆株的形式在病房内和病房间,甚至医院间进行传播,这可能是造成两院MDRAB分离率及耐药率逐年升高的重要原因。
[1]Durante-Mangoni E,Zarrilli R.Global spread of drug-resistantAcinetobacterbaumannii:molecular epidemiology and management of antimicrobial resistance[J].Future Microbiol,2011,6(4):407-422.
[2]陈海红,李华茵,何礼贤.耐碳青霉烯类鲍曼不动杆菌的耐药机制研究进展[J].中国呼吸与危重监护杂志,2010,9(4):439-443.
[3]池细俤,高世华,陈家龙,等.多重耐药鲍曼不动杆菌医院感染危险因素[J].中国感染控制杂志,2014,13(9):534-537.
[4]时露,段秀杰.鲍曼不动杆菌耐药机制及药物治疗研究进展[J].中国公共卫生,2010,26(3):379-381.
[5]明德松,许钰颖,邓勇.我国鲍曼不动杆菌耐碳青霉烯类药物机制的 Meta分析[J].中国病原生物学杂志,2013,8(4):358-360,381.
[6]Ergin A,Hascelik G,Eser OK.Molecular characterization of oxacillinases and genotyping of invasiveAcinetobacterbaumanniiisolates using repetitive extragenic palindromic sequencebased polymerase chain reaction in Ankara between 2004 and 2010[J].Scand J Infect Dis,2013,45(1):26-31.
[7]Taitt CR,Leski TA,Stockelman MG,et al.Antimicrobial resistance determinants inAcinetobacterbaumanniiisolates taken from military treatment facilities[J].Antimicrob Agents Chemother,2014,58(2):767-781.
[8]Poirel L,Naas T,Nordmann P.Diversity,epidemiology,and genetics of class D beta-lactamases[J].Antimicrob Agents Chemother,2010,54(1):24-38.
[9]李光荣,宋敏,杨建波,等.碳青霉烯类耐药鲍曼不动杆菌耐药基因的研究[J].中国全科医学,2014,17(26):3083-3087.
[10]杜坤,应春妹,汪雅萍,等.上海地区四家医院鲍曼不动杆菌产β-内酰胺酶研究[J].检验医学,2012,27(2):103-109.
[11]李永丽,应春妹,陈艺升.ERIC-PCR技术在鲍曼不动杆菌基因分型中的应用评估[J].检验医学,2013,28(7):621-624.

