基于鱼胶原蛋白的组织工程角膜基质载体支架的构建及鉴定
赵君
摘 要:以鳗鲡鱼皮胶原为材料,通过交联的方法构建组织工程角膜载体支架,评价其理化性能、组织结构及生物相容性。结果表明制备的组织工程角膜支架具有良好的理化性质,有望用于组织工程角膜的构建。鱼胶原的应用已涉及生物医学、食品、化妆品等行业,但在组织工程角膜领域的研究较少,Chien等利用罗非鱼下脚料提纯鱼胶原作为载体支架对角膜的再生进行了研究,结果显示支架为兔角膜细胞提供了良好的生长和迁移空间,表明鱼胶原可能成为一种新型的组织工程角膜的支架材料。
关键词:组织工程角膜 载体支架 鱼类胶原蛋白 生物相容性
中图分类号:R772 文献标识码:A 文章编号:1672-3791(2015)08(c)-0203-02
角膜是位于眼睛最前端的透明组织,覆盖虹膜、瞳孔及前房。由于角膜位于眼球前面,直接与外界接触,故易受损伤和感染,致使角膜疾病较为多见,也是致盲的重要原因[1]。目前唯一的治疗办法是进行角膜移植术,但由于捐献角膜的高度匮乏,绝大多数患者因无法得到供体角膜而不能复明[2-3]。因此,寻求合适的角膜替代品作为角膜移植的供体将具有重大的临床应用价值。
1 材料与方法
1.1 材料
鳗鲡鱼皮胶原蛋白由该实验室分离纯化所得。非转染人角膜基质(HCS)细胞系由该实验室自行建立。DMEM/F12培养液、胰蛋白酶和小牛血清购自Gibco公司。噻唑蓝(MTT)、1-(3-二甲基氨基丙基)-3-乙基碳化二亚胺(EDC)、N-羟基琥珀酰亚胺(NHS)购自Sigma公司。其它试剂均为分析纯。
1.2 组织工程角膜载体支架的制备
将鳗鲡鱼皮胶原蛋白溶于0.5M醋酸中,制备成50 mg/mL的胶原溶液,注入一定的模具中,厚度控制为400 μm,冻干成多孔胶原海绵。胶原海绵用EDC/NHS于4 ℃交联12 h,0.1 M Na2HPO4充分清洗除去残留交联剂。
1.3 胶原支架的透明度及透光率
将胶原支架浸泡于PBS中,用滤纸吸除表面多余水分,放置于印有文字的打印纸上,用数码相机在自然光下拍照。胶原支架浸入20%甘油脱水处理后平铺于96孔板板底,用酶标仪检测300~800 nm的透光率,每20 nm测一个。以加20%甘油的孔为空白对照。
1.4 胶原支架的组织结构
为检测胶原载体支架的组织结构,样品在4%多聚甲醛中固定,OCT包埋。用冰冻切片机切成7~10 μm的切片贴在明胶包被的载玻片上,37 ℃烘干12 h。全自动染色机伊红染色后,光镜观察并拍照。
1.5 胶原支架的表面超微结构
胶原载体支架浸入2.5%戊二醛中4 ℃固定24 h。再浸入1%四氧化锇中固定2 h,用30%~100%的丙酮梯度脱水。经过CO2临界点干燥,离子溅射仪铂金喷溅,用扫描电镜观察胶原支架表面超微结构并拍照。
1.6 统计学分析
数据用“平均值±标准差”表示,用SPSS 21.0软件对数据进行统计学分析。组间差异用双尾T检验,P< 0.05时为显著性差异。
2 结果
2.1 胶原蛋白的SDS-PAGE
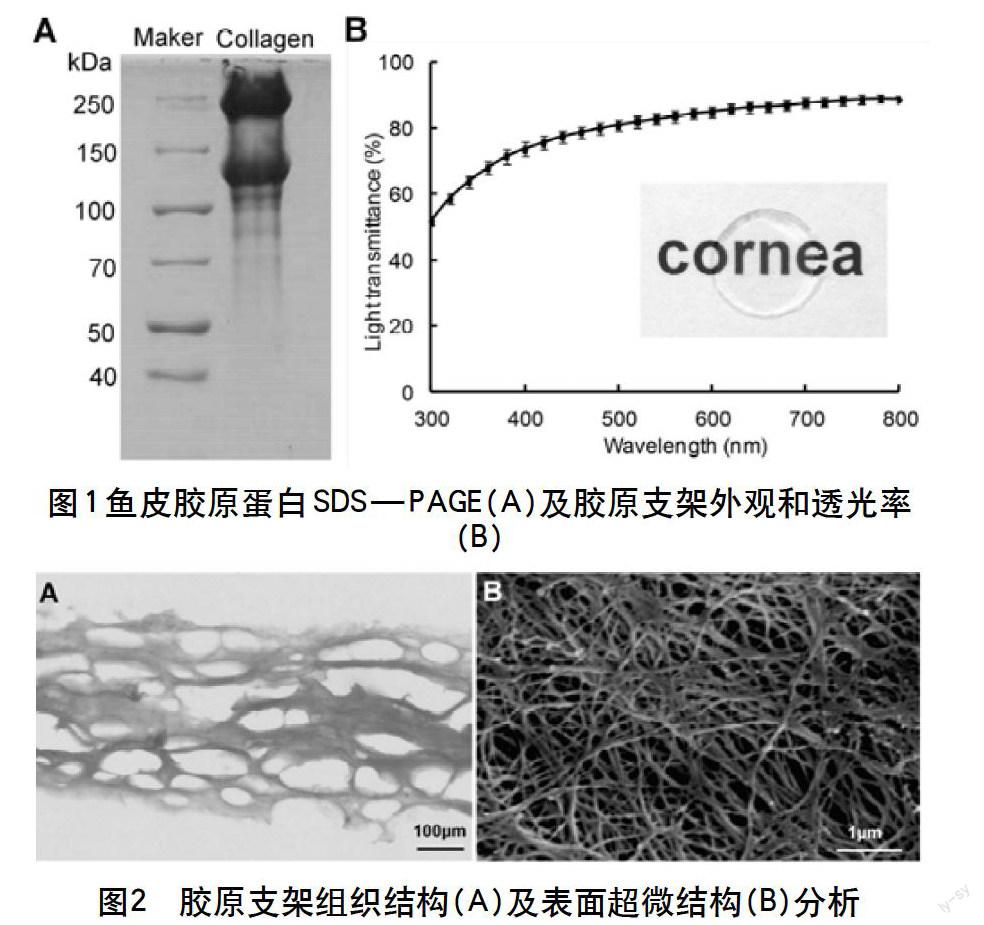
胶原的SDS-PAGE结果(图1A)显示,提取的鳗鲡鱼皮胶原蛋白含有两条不同的α链,即α1链和α2链,同时可观察到其二聚体β链。该结果表明提取的鱼类胶原蛋白纯度较高,符合I型胶原蛋白的特征,且在提取过程中胶原蛋白并没有发生降解。
2.2 胶原支架的透明度和透光率
胶原支架的外观和透光率(图1B)结果表明,支架表面平整且具有较高的透明度。胶原支架的透光率随波长的增加而增大,胶原支架的透光率为88.95±1.28%。
2.3 胶原支架的结构观察
胶原支架冰冻切片的HE染色结果(图2A)表明,经EDC/NHS交联后的胶原蛋白纤维交错成网,胶原支架呈多孔网状结构。胶原支架内部孔隙较多且孔隙较为均匀。扫描电镜结果(图2B)显示了胶原支架表面的超微结构,胶原支架表面致密,胶原纤维紧密排列,孔隙直径在0.1~1μm之间。
3 讨论
该文初步探索了鳗鲡鱼皮胶原蛋白作为一种支架材料,用于角膜组织工程的可行性。以50 mg/mL的鳗鲡鱼皮胶原蛋白冻干成一定形状的胶原海绵,通过EDC/NHS交联构建组织工程角膜载体支架,检测胶原支架的理化性质及生物学性能。实验结果表明以该文方法构建的组织工程角膜载体支架具有良好的透明度,透光率能达到88.95±1.28%,与正常人角膜的透光率相近。
该文采用冻干后交联的方法制备出了胶原载体支架,HE染色和扫描电镜结果表明,胶原蛋白相互交联形成胶原纤维束,在支架内部相互交错排列形成多孔的网状结构,有利于细胞的迁入。以上结果证明该文所构建的胶原支架具有良好的生物相容性,符合组织工程角膜载体支架的要求。
4 结论
该研究以鳗鲡鱼皮胶原蛋白为材料构建了组织工程角膜载体支架,该支架具有良好的透明度和透光率,呈孔隙较均一多孔网状结构,支架表面致密均一。因此,鱼皮胶原蛋白可以作为一种新材料用于组织工程角膜的研究,且该文构建的胶原载体支架可以进一步用于组织工程角膜体外构建的研究。
(致谢:该课题为山东省优秀中青年科学家科研奖励基金(BS2012YY040)资助。)
参考文献
[1] Schneider AI,Maier-Reif K,Graeve T.Constructing an in vitro cornea from cultures of the three specific corneal cell types[J].In Vitro Cell Dev Biol Anim,1999,35(9):515-526.
[2] Schermer A,Galvin S,Sun TT.Differentiation-related expression of a major 64K corneal keratin in vivo and in culture suggests limbal location of corneal epithelial stem cells [J].J Cell Biol,1986,103(1):49-62.
[3] Xiaojie H,Wei L,Lei C,et al.Tissue Engineering of Nearly Transparent Corneal Stroma.Tissue Engineering, 2005,11(11):1710-1717.

