孟鲁司特钠对COPD 急性发作患者肺功能及炎性介质的影响
屈 磊,龚传明,章 涛,李 翔,胡海涛
慢性阻塞性肺疾病(COPD)是一种常见的慢性呼吸系统疾病,以不完全可逆气流受限、进行性发展为主要特征。 近年来,COPD发病率呈逐年上升趋势,Kelly 等[1]预计,2020 年COPD的致死率将仅次于心脑血管疾病而位居疾病死因第2 位。 该病常出现反复急性发作, 严重影响患者的生存和生活质量。近年研究发现,白介素6(IL-6)、白介素8(IL-8)、肿瘤坏死因子(TNF-α)等炎性介质的产生及其所参与的气道、肺实质和肺血管的慢性炎症反应,是COPD发生、发展的重要病理生理学基础之一[2]。 本研究观察布地奈德联合孟鲁司特钠对COPD 急性期患者肺功能、炎性介质的影响,探讨二者联用治疗COPD急性发作的机理,结果报道如下。
1 资料与方法
1.1 病例资料 2011 年6 月~2014 年12 月我院共收治COPD 急性发作患者132 例,均符合中华医学会呼吸病学分会制定的《慢性阻塞性肺疾病诊治指南》中COPD 急性发作的诊断标准[3],并排除合并恶性肿瘤、糖尿病、严重心肝肾疾病、肺结核等其他严重呼吸系统疾病及免疫系统疾病患者。 本研究通过医院伦理委员会批准,所有患者及其家属均知情同意并签署同意书。
按患者入院顺序对其进行编号,以随机数字表法将患者随机分入对照组和治疗组, 每组均为66例,两组在性别、年龄、病程、病情等方面比较均无统计学差异(P >0.05,表1)。
1.2 治疗方法 对照组给予止咳、平喘、抗炎、祛痰、吸氧和支气管扩张等常规治疗,同时雾化吸入布地奈德混悬液,2 mg/次,2 次/d。 治疗组在对照组基础上,加用孟鲁司特钠片(杭州默沙东制药有限公司生产,国药准字J20070058)治疗,每晚睡前口服10 mg,1 次/d。 所有患者均持续治疗2 w。
1.3 检测项目 在治疗开始前1 d 及治疗结束后次日清晨,取患者空腹静脉血2~3 ml。 离心后取上清液, 以双抗体夹心法酶联免疫吸附实验(ELISA法)检测IL-6、IL-8、TNF-α 等的浓度。 IL-6、TNF-α 等检测试剂盒由北京方程生物科技有限公司提供,人IL-8 检测试剂盒由上海西唐生物科技有限公司提供,严格按照试剂盒使用说明操作。并同时使用ST-75 型肺功能检测仪(日本福田产业株式会社)检测患者第1 s 用力呼气量(FEV1)、用力肺活量(FVC)和FEV1 占FVC 的百分比(FEV1/FVC%)等肺功能指标。
1.4 统计学方法 所有数据采用SPSS 16.0 软件进行处理,计量资料以±s 表示,组间比较采用成组t 检验,组内比较采用配对t 检验;计数资料组间比较采用χ2检验、Wilcoxon 秩和检验,P <0.05 为差异有统计学意义。
2 结果
2.1 两组治疗前后炎性介质表达水平比较 治疗前,两组血清IL-6、IL-8、TNF-α 表达水平的差异无统计学意义(P >0.05);治疗后,两组血清IL-6、IL-8、TNF-α 表达水平均比其治疗前有显著降低(P <0.05),且治疗组比对照组降低更显著(P <0.05,表2)。
2.2 两组治疗前后肺功能比较 治疗前, 两组FEV1、FVC、FEV1/FVC 相比,差异无统计学意义(P >0.05);治疗后,对照组FEV1、FVC、FEV1/FVC 与治疗前相比无显著变化(P >0.05),但治疗组FEV1 及FEV1/FVC 较自身治疗前有显著增加(P <0.05),且明显高于对照组治疗后水平(P <0.05)。 见表3。

表1 两组一般资料比较(n=66)

表2 两组治疗前后血清lL-6、lL-8、TNF-α表达水平的比较(n=66)
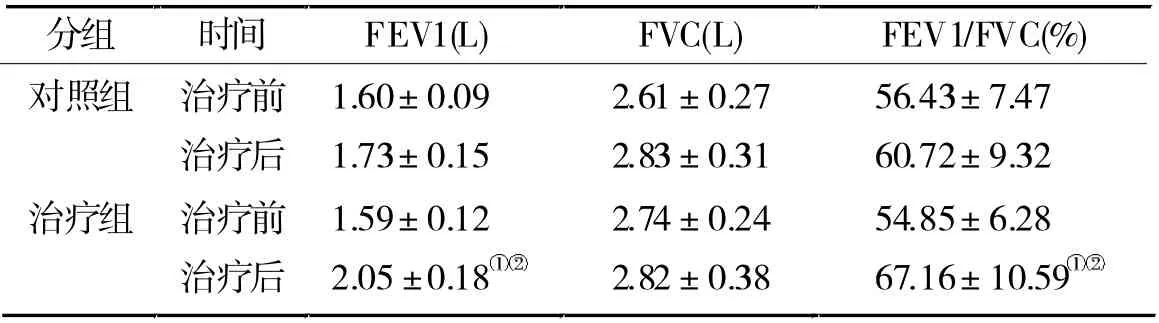
表3 两组治疗前后肺功能的比较(n =66)
3 讨论
COPD 本质上是气道、 肺实质和肺血管的慢性炎症反应, 激活的炎症细胞释放白三烯、IL-6、IL-8、TNF-α 等多种炎性介质。 该病确切的发病机制尚未明了,但一般认为COPD 急性期气道炎症的持续存在、肺组织结构的破坏、气道的重塑以及肺功能的下降均与炎症细胞及其所释放的多种细胞因子有关[4]。 研究[5-6]表明,COPD 急性发作时,血清中IL-6、IL-8、TNF-α 等炎性介质增多。
IL-6 可促进T 细胞与单核细胞释放干扰素-γ及TNF-α 等促炎因子, 致使气道和肺组织直接受损;可刺激成纤维细胞增殖和胶原蛋白沉积,引起气道纤维结缔组织形成、平滑肌增生,导致气道重塑和气道的闭塞[7]。 IL-8 可趋化中性粒细胞、T 淋巴细胞等,活化的中性粒细胞又反过来诱导IL-8 的生成,形成“炎性循环”和炎症级联放大反应[8];还可促进肥大细胞及嗜碱性粒细胞脱颗粒释放组胺和白三烯,引起支气管痉挛、气道阻塞[4]。TNF-α 可刺激单核- 巨噬细胞产生IL-6、IL-8、白三烯等,并促进炎性细胞黏附、迁移和浸润,诱发过度炎症反应和组织纤维化,还可释放溶酶体酶,损伤血管内皮细胞和肺组织,加重肺水肿[9-10]。
糖皮质激素是强效抗炎类药物,能够抑制炎症介质释放、 炎性细胞浸润和嗜酸性细胞的分化增殖。研究[11]表明,糖皮质激素治疗COPD 急性发作疗效确切,可有效降低血液中IL-6、IL-8、TNF-α 等炎性介质的水平,改善患者肺功能,减少COPD 急性发作频率。 布地奈德是一种具有高效局部抗炎作用的糖皮质激素,可增强内皮细胞、溶酶体膜等的稳定性,减少组胺及IL-6 等炎性介质释放,并降低其活性,减轻平滑肌的收缩反应。 本研究显示,对照组在常规疗法基础上雾化吸入布地奈德混悬液治疗2 w后,患者血清IL-6、IL-8、TNF-α 表达水平比其治疗前有显著降低 (P <0.05), 说明布地奈德治疗COPD急性发作时确可显著降低患者的炎症反应,但结果同时显示治疗后患者肺功能指标FEV1、FVC、FEV1/FVC 与治疗前相比无显著变化(P >0.05),提示单独使用布地奈德治疗COPD 急性发作疗效尚不够理想。
本研究中,治疗组在常规疗法基础上,雾化吸入布地奈德混悬液并加用孟鲁司特钠2 w 后, 患者血清IL-6、IL-8、TNF-α 表达水平显著低于对照组(P <0.05),且肺功能指标FEV1、FEV1/FVC 较自身治疗前也有显著增加(P <0.05),并明显高于对照组治疗后水平(P <0.05),提示布地奈德与孟鲁司特钠联用治疗COPD 急性发作、抗炎及改善肺功能的效果优于单独使用布地奈德, 这可能与白三烯有关。白三烯是一种重要的炎症细胞趋化剂, 可引起中性粒细胞、巨噬细胞等聚集和激活,吸引中性粒细胞到达气道,引起气道高反应[12]。 研究[13]证实,白三烯与COPD 的发生、发展存在密切联系。 孟鲁司特钠是一种口服的白三烯受体拮抗剂,能特异性抑制气道中的半胱氨酰白三烯(CysLT1)受体,降低白三烯活性,减轻白三烯所致的血管通透性增加、气道嗜酸粒细胞增多浸润及支气管的痉挛收缩、 黏膜水肿,从而达到抑制气道炎症,改善肺功能的作用。
上述研究结果提示,孟鲁司特钠作为非激素类抗炎药,与糖皮质激素药物布地奈德联用,具有较好的协同作用,二者联用不但可发挥更强效的抗炎作用,还可显著改善肺功能。 当然,本研究观察时间较短,对治疗后患者急性发作频率、生活质量尚未进行追踪和比较,这些都有待于进一步的全面随访观察。
[1] Kelly E, Owen CA, Pinto-Plata V, et al. The role of systemic inflammatory biomarkers to predict mortality in chronic obstructive pulmonary disease [J]. Expert Rev Respir Med, 2013,7(1):57-64.
[2] 杨慧. 孟鲁司特钠联合N-乙酰半胱氨酸对慢性阻塞性肺疾病缓解期的临床疗效观察[J]. 中国现代医学杂志, 2013, 23(29):96-99.
[3] 中华医学会呼吸病学分会慢性阻塞性肺疾病组. 慢性阻塞性肺疾病诊治指南[J]. 中华结核和呼吸杂志,2007, 30(1): 8-17.
[4] 王红阳, 付爱双, 王袁. 慢性阻塞性肺疾病急性加重期患者血清中CRP、TNF-α、IL-6、IL-8 的检测及临床意义[J]. 中国现代医学杂志, 2014, 24(26): 109-112.
[5] Gao J, Zhan B. The effects of Ang-1, IL-8 and TGF-β1 on the pathogenesis of COPD [J]. Molecular Medicine Reports, 2012, 6(5): 1155-1159.
[6] Shaw JG, Vaughan A, Dent AG, et al. Biomarkers of progression of chronic obstructive pulmonary disease (COPD)[J]. Journal of Thoracic Disease, 2014, 6(11): 1532.
[7] 陈宁, 徐燕, 张永红, 等. 慢性阻塞性肺病大鼠外周血中Foxp3+ 调节性细胞及IL-17、IL-6 水平的变化[J]. 中国现代医学 杂 志, 2014, 24(27): 24-28.
[8] Feng E, Wan R, Yang S, et al. Expression levels of induced sputum IL-8 and IL-10 and drug intervention effects in patients with acute exacerbated COPD complicated with chronic corpulmonale at high altitude [J]. Experimental and Therapeutic Medicine, 2013, 6(3): 747-752.
[9] Feng T, Yunfeng N, Jinbo Z, et al. Single immunoglobulin IL-1 receptor-related protein attenuates the lipopolysaccharide-induced inflammatory response in A549 cells [J]. Chemico-biological Interactions, 2010, 183(3): 442-449.
[10] Dima E, Rovina N, Gerassimou C, et al. Pulmonary function tests, sputum induction, and bronchial provocation tests:diagnostic tools in the challenge of distinguishing asthma and COPD phenotypes in clinical practice[J]. International Journal of Chronic Obstructive Pulmonary Disease, 2010, 5: 287.
[11] Samarzija M, Jakopovic M, Pavicic F, et al. Montelukast in asthma treatment in Croatia[J]. Collegium Antropologicum, 2005,29(2): 683-688.
[12] Ko FWS, Leung TF, Wong GWK, et al. Measurement of tumor necrosis factor-α, leukotriene B4, and interleukin 8 in the exhaled breath condensate in patients with acute exacerbations of chronic obstructive pulmonary disease[J]. International Journal of Chronic Obstructive Pulmonary Disease, 2009, 4: 79.
[13] Birke FW, Meade CJ, Anderskewitz R, et al. In vitro and in vivo pharmacological characterization of BIIL 284, a novel and potent leukotriene B4 receptor antagonist [J]. Journal of Pharmacology and Experimental Therapeutics, 2001, 297(1): 458-466.

