胃癌细胞herg mRNA、HERG蛋白表达及HERG电流强度变化
邵晓冬,张永国,陈江,王金玲,郭晓钟,任丽楠(沈阳军区总医院,沈阳110016)
·论著·
胃癌细胞herg mRNA、HERG蛋白表达及HERG电流强度变化
邵晓冬,张永国,陈江,王金玲,郭晓钟,任丽楠(沈阳军区总医院,沈阳110016)
摘要:目的探讨胃癌细胞herg mRNA、HERG蛋白表达及HERG电流强度的变化的临床意义。方法培养胃癌细胞(胃癌细胞系SGC7901、MGC803、AGS、MKN45)及永生化胃上皮细胞(GES),取对数生长期细胞用于实验。采用RT-PCR法检测herg mRNA表达,Western blot法检测HERG蛋白表达,采用全细胞膜片钳技术测定SGC7901及GES的HERG电流强度。结果herg mRNA及其蛋白在4种胃癌细胞系中均有表达,AGS中HERG蛋白表达量低于其他三种细胞系(P均<0.05);GES中无herg mRNA及其蛋白表达。在SGC7901中检测到HERG电流, GES中未记录到HERG电流。结论herg mRNA及其蛋白在胃癌细胞系SGC7901、MGC803、AGS、MKN45表达增高,SGC7901中存在HERG电流。HERG蛋白可能参与了胃癌的发生,并与胃癌恶性程度有关。
关键词:胃肿瘤,胃癌;herg基因;HERG蛋白;HERG电流;延迟整流钾通道;肿瘤形成过程
胃癌的发病机制目前尚未清楚,化疗和生物治疗效果不理想。近年来,关于钾离子通道与肿瘤发病关系的研究较多[1~3],其中电压门控性钾通道与恶性肿瘤的关系已成为肿瘤研究领域的新热点。HERG蛋白构成延迟整流性钾通道的α亚单位,已有研究表明,多种不同组织起源的恶性肿瘤细胞中均可检测到HERG蛋白及其功能性电流,而正常组织细胞则无HERG蛋白表达[4]。2005年1月~2010年12月,我们对胃癌细胞中herg mRNA及其蛋白进行检测,并观察细胞中HERG电流强度的变化,探讨HERG蛋白与胃癌发生发展的关系。
1材料与方法
1.1细胞培养永生化胃上皮细胞(GES)引自北京肿瘤研究所。胃癌细胞系SGC7901、MGC803、AGS、MKN45引自军事医学科学院。细胞接种于含10% FBS、100 μg/mL青霉素和100 μg/mL链霉素的RPMI1640培养液,于37 ℃、5% CO2、95%空气中常规培养,取对数生长期细胞用于实验。
1.2检测项目
1.2.1herg mRNA采用RT-PCR法。引物由上海生工生物工程公司合成。herg上游序列为5′-TCCAGCGGCTGTACTCGGGC-3′,下游序列为5′-TGGACCAGAAGTGGTCGGAGAACTC -3′;以β-actin为内参,上游序列为 5′-GTGGGGCGCCCCAGGCACCA-3′,下游序列为5′-CTCCTTAAGTCACGCACGATTTC-3′。Trizol提取细胞总RNA,验证所提取RNA的质量,紫外分光光度仪测RNA浓度。反应体系共20 μL:总RNA 1~2 μg,oligo(dT)18 1 μL,无RNA酶的去离子水12 μL,5×反转录酶缓冲液4 μL,10 mM dNTPS 2 μL,RNA酶抑制剂1 μL,M-MuLV反转录酶 1 μL,获得cDNA产物。PCR反应体系:cDNA模板1 μL,10×PCR反应缓冲液(含镁) 5 μL,Taq 酶0.5 μL,10 mM上游引物1 μL,10 mM下游引物1 μL,dNTPs 1 μL,去离子水40.5 μL。反应条件:94 ℃ 10 min,94 ℃ 90 s,65 ℃ 180 s,72 ℃ 90 s,共进行43个循环, 72 ℃延伸10 min。1%琼脂糖凝胶电泳分离PCR产物。
1.2.2HERG蛋白采用Western blot法。制备细胞总蛋白,分装后储于-70 ℃备用;以牛血清白蛋白作为标准品,测定样品蛋白质浓度。将样品转移到经缓冲液浸泡的SDS-PAGE凝胶(0.8 mA/cm2,时间90 min);用丽春红染液对滤膜进行染色,标记蛋白分子量标准条带,去离子水洗去染料;滤膜经8%脱脂奶粉于室温封闭2 h,与4%脱脂奶粉稀释的抗体(抗HERG 1∶1 000,抗β-actin 1∶5 000)4 ℃孵育过夜,TBST摇洗4次×15 min;与4%脱脂奶粉稀释的HRP标记的兔抗羊IgG室温孵育4 h,TBST摇洗4次×15 min;等量混合ECL显色系统中A+B液,滴加至硝酸纤维素膜;X线胶片感光。以β-actin作为内参,采用Quantity-one软件计算各样品HERG蛋白表达水平,进行相对表达量分析。
1.2.3HERG电流检测前2 h将处于对数生长期的SGC7901及GES细胞消化,接种到剪裁好的载玻片备用。采用全细胞膜片钳技术测定,pClamp8.0软件控制反应参数,通过A/D和D/A转换器与放大器连接。步骤:将电极液灌充到硼硅酸盐玻璃管,使其电极尖端阻抗为3~5 MΩ,由电极尾部灌充经0.2 μm滤膜过滤的电极内液;在微推进器帮助下,向膜片电极施加正压同时使电极尖端接近细胞表面;将电位固定在0 mV,连续给予强度为1 mV、间期为10~20 ms的去极化脉冲波,监测电流变化;电极尖端到达细胞表面时,减小应答脉冲波电流,将电极内压从正压转变为弱负压,使电流进一步减小,即在电极尖端和细胞膜之间形成高阻抗(3~20 GΩ)封接;在细胞吸附状态下,施加负压吸引破膜或予电击破膜;钳制电位0 mV,将膜电位从-120 mV阶梯式改变到20 mV,阶跃升幅为20 mV,刺激持续1 s,间歇1 s,刺激频率为0.2 Hz;记录跨膜电流,观察电流变化。通过检测在细胞培养液中加入HERG蛋白特异阻断剂cisapride后的电流变化,确定细胞中是否存在HERG电流。

2结果
2.1herg mRNA表达RT-PCR结果显示,在所检测的四种人胃癌细胞系MGC803、AGS、MKN45和SGC7901中均有herg mRNA表达,而GES中无herg mRNA表达(见图1)。
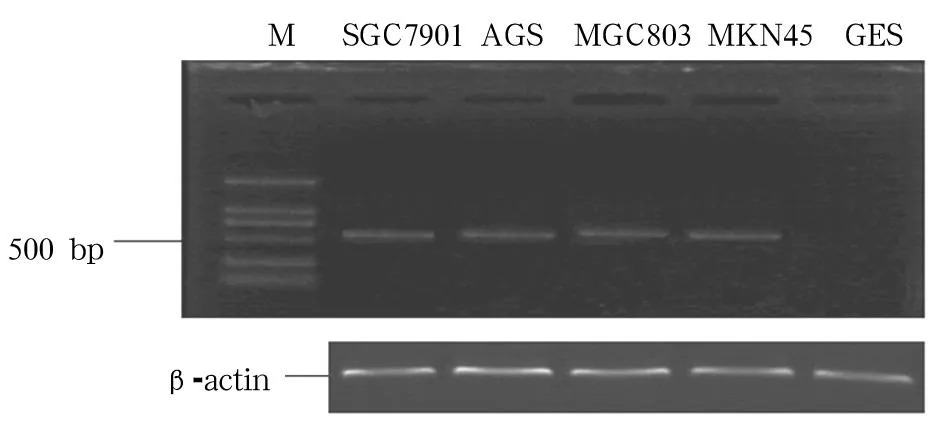
图1 不同细胞中herg mRNA表达
2.2HERG蛋白表达Western blot结果显示,GES中无HERG蛋白表达,AGS、SGC7901、MKN45、MGC803中HERG蛋白相对表达量分别为646.33±54.39、1 369.33±40.29、1 335.67±63.62、1 087.33±24.36,AGS中HERG蛋白相对表达量低于其他三种胃癌细胞系(P均<0.05)。
2.3HERG电流SGC7901检测到HERG电流,GES中则未检测到HERG电流。
3讨论
herg基因定位于7号染色体长臂,含16个外显子,编码含1 159个氨基酸的多肽,分子量约127 kD。herg基因的表达产物为HERG蛋白,组成延迟整流性钾通道的α亚基,该通道电流具有以下特点:①依赖去极化的活化门控开放,快速、超极化依赖的通道失活,导致电导降低,产生内向整流;②对Ⅲ型抗心律失常药物敏感;③最大电导的细胞外钾浓度依赖性[5~7]。研究表明,小鼠胎心细胞中HERG电流占绝对优势,而在成熟心肌细胞则丧失了优势地位,但当成熟心肌细胞去分化或癌变时,HERG电流则重新占优势。同样,在小鼠神经嵴神经元的发育过程中,HERG电流仅在神经元发育极早阶段有瞬时表达,而后即被内向整流性钾电流所取代[8]。HERG电流的上述变化趋势与临床常用的胚胎基因相关肿瘤标志物如甲胎蛋白(AFP)、癌胚抗原(CEA)的表达变化具有相似性。有研究发现HERG蛋白表达于多种恶性肿瘤细胞[4],该分子可能对恶性肿瘤的早期诊断具有一定价值。

我们前期研究在三种人白血病细胞中检测到HERG电流,且电流强度与蛋白丰度相关,证实HERG电流在白血病细胞系增殖中发挥一定作用。本研究观察了胃癌细胞与GES中herg基因、蛋白表达及HERG电流的变化,结果显示,herg基因及其蛋白在四种胃癌细胞系中均有表达,在GES中不表达,表明herg基因及其蛋白可能与胃癌发病有关。我们还发现,4种胃癌细胞系中,以致瘤性较低的AGS中HERG蛋白表达量最低,而在分化程度较低的MKN45、MGC803及源于胃癌转移淋巴结的SGC7901中表达较强,同时在SGC7901中检测到了HERG电流,提示HERG蛋白可能与胃癌恶性程度及侵袭性有关,这将在后续研究中加以证实。
参考文献:
[1] Huang X, Jan LY. Targeting potassium channels in cancer [J]. J Cell Biol, 2014,206(2):151-162.
[2] Pardo LA, Stuhmer W. The roles of K channels in cancer [J]. Nat Rev Cancer, 2014,14(1):39-48.
[3] Than BL, Goos JA, Sarver AL, et al. The role of KCNQ1 in mouse and human gastrointestinal cancers [J]. Oncogene, 2014,33(29):3861-3868.
[4] Cherubini A, Taddei GL, Crociani O, et al. HERG potassium channels are more frequently expressed in human endometrial cancer as compared to non-cancerous endometrium[J]. Br J Cancer, 2000,83(12):1722-1729.
[5] Warmke JW , Ganetzky B. A family of potassium channel genes related to eag in Drosophila and mammals [J]. Proc Natl Acad Sci Usa, 1994,91(8):3438-3442.
[6] Splawski I, Shen J, Timothy KW, et al. Genomic structure of three long QT syndrome genes: KVLQT1, HERG, and KCNE1 [J]. Genomics, 1998,51(1):86-97.
[7] Trudeau MC, Warmke JW, Ganetzky B, et al. HERG, a human inward rectifier in the voltage-gated potassium channel family [J]. Science, 1995,269(5220):92-95.
[8] Wang H, Zhang Y, Cao L, et al. HERG K+channel, a regulator of tumor cell apoptosis and proliferation [J]. Cancer Res, 2002,62(17):4843-4848.
[9] Wei X, Sun H, Yan H, et al. ZC88, a novel 4-amino piperidine analog, inhibits the growth of neuroblastoma cells through blocking hERG potassium channel[J]. Cancer Biol Ther, 2013,14(5):450-457.
[10] Staudacher I, Jehle J, Staudacher K, et al. HERG K+channel-dependent apoptosis and cell cycle arrest in human glioblastoma cells[J]. PLoS One, 2014,9(2):88164.
[11] Smith GA, Tsui HW, Newell EW. Functional up-regulation of HERG K channels in neoplastic hematopoietic cells[J]. J Biol Chem, 2002,277(21):18528-18534.
[12] Pillozzi S, Brizzi MF, Balzi M, et al. HERG potassium channels are constitutively expressed in primary human acute myeloid leukemias and regulate cell proliferation of normal and leukemic hemopoietic progenitors [J]. Leukemia, 2002,16(9):1791-1798.
[13] Zheng F, Li H, Liang K,et al. Imatinib has the potential to exert its antileukemia effects by down-regulating hERG1 K+channels in chronic myelogenous leukemia[J]. Med Oncol, 2012,29(3):2127-2135.
[14] Fiore A, Carraresi L, Morabito A, et al. Characterization of hERG1 channel role in mouse colorectal carcinogenesis[J]. Cancer Med, 2013,2(5):583-594.
[15] Li G, Hu Z, Yin H, et al. A novel dendritic nanocarrier of polyamidoamine-polyethylene glycol-cyclic RGD for "smart" small interfering RNA delivery and in vitro antitumor effects by human ether-à-go-go-related gene silencing in anaplastic thyroid carcinoma cells[J]. Int J Nanomedicine, 2013,8(2):1293-1306.
[16] Glassmeier G, Hempel K, Wulfsen I, et al. Inhibition of HERG1 K+channel protein expression decreases cell proliferation of human small cell lung cancer cells[J]. Pflugers Arch, 2012,463(2):365-376.
[17] Asher V, Warren A, Shaw R, et al. The role of Eag and HERG channels in cell proliferation and apoptotic cell death in SK-OV-3 ovarian cancer cell line[J]. Cancer Cell Int, 2011,11(3):6.
[18] Cicek MS, Koestler DC, Fridley BL, et al. Epigenome-wide ovarian cancer analysis identifies a methylation profile differentiating clear-cell histology with epigenetic silencing of the HERG K+channel[J]. Hum Mol Genet, 2013,22(15):3038-3047.
[19] Wang Y, Zhang Y, Yang L, et al. Arsenic trioxide induces the apoptosis of human breast cancer MCF-7 cells through activation of caspase-3 and inhibition of HERG channels[J]. Exp Ther Med, 2011,2(3):481-486.
[20] 尚伯杨,商悦,甄永苏,等.力达霉素对钾离子通道HERG高表达肿瘤细胞的增殖抑制及其与化疗药物的协同作用[J].药学学报,2011,46(11):1321-1325.
[21] Ouadid-Ahidouch H, Ahidouch A. K(+) channels and cell cycle progression in tumor cells[J]. Front Physiol, 2013,4(8):220.
·作者·编者·读者·
《山东医药》参考文献著录要求
每篇论文须标引参考文献10~20条。正文中引用的文献采用顺序编码制,以引用文献的先后顺序连续编码,并将序号置于方括号中。文后参考文献按GB/T7714-2005《文后参考文献著录规则》采用顺序编码制标注,序号置于方括号中,排列于文后。内部刊物、未发表资料、个人通信等请勿作为文献引用,确需引用时,可将其在正文相应处注明。引用文献(包括文字和表达的原意)务请作者与原文核对无误。日文汉字请按日文规定书写,勿与我国汉字及简化字混淆。参考文献中的作者前1~3名全部列出,3名以上只列前3名,后依文种加表示“,等”的文字。作者姓名一律姓氏在前,名字在后,外国人的名字采用首字母缩写姓氏,缩写名后不加缩写点;不同作者之间用“,”隔开。外文期刊名称用缩写,以Index Medicus中的格式为准;中文期刊用全名。论文题目后加文献类型及标识,如专著[M]、期刊文章[J]等。每条参考文献均须著录卷、期及起止页。作者必须自行核对参考文献原文,无误后将其按引用顺序(用阿拉伯数字)排列于文末。举例:
[1] 杜贾军,孟龙,陈景寒,等.手辅助电视胸腔镜食管切除胃食管胸内吻合术[J].山东医药,2004,44(27):1-3.
[2] Takano M, Mizuno K, Okamatsu K, et al. Mechanical and structural characteristics of vulnerable plaques: analysis by coronary angioscopy and intravascular ultrasound[J]. J Am Coll Cardiol, 2002,38(1):99-104.
[3] 叶任高,陆再英.内科学[M].5版.北京:人民卫生出版社,2000:277-280.
Expression of herg gene, protein and changes of HERG current in gastric cancer cells
SHAOXiao-dong,ZHANGYong-guo,CHENJiang,WANGJin-ling,GUOXiao-zhong,RENLi-nan
(GeneralHospitalofShenyangMilitaryCommandArea,Shenyang110016,China)
Abstract:ObjectiveTo investigate the expression of herg gene, HERG protein and HERG current in gastric cancer cells. MethodsGastric cancer cells and gastric epithelial (GES) cells were cultured to logarithmic phase. The expressions of herg mRNA and HERG protein in gastric cancer cells and GES cells were measured by using RT-PCR and Western blot, respectively. The whole cell configuration of the patch-clamp technique was employed to record HERG currents in various cells. ResultsHERG mRNA and protein were positively expressed in four gastric cancer cell lines. Expression level of HERG protein in AGS cells was lower compared with the other three gastric cancer cell lines (P<0.05). There was negative expression of herg mRNA and HERG protein in GES cell line. HERG current was detected in gastric cancer cell, whereas there was no HERG current in GES cell. ConclusionHerg gene and HERG protein were highly expressed in gastric cancer cells and HERG current was exclusively detected in gastric cancer cells. HERG protein was associated with carcinogenesis of gastric cancer and may serve as a diagnostic marker for gastric cancer.
Key words:stomach neoplasms; human ether-a-go-go-related gene; HERG protein; HERG current; delayed rectifier potassium channel; neoplastic processes
(收稿日期:2014-08-09)
通信作者简介:任丽楠(1973-),女,副主任医师,研究方向为胃肠道恶性肿瘤的发生机制。E-mail: ren_li_nan@hotmail.com
作者简介:第一邵晓冬(1970-),男,副主任医师,研究方向为胃癌发生机制。E-mail: sxdsys608@sohu.com
基金项目:国家自然科学基金资助项目(30400204)。
中图分类号:R735.2
文献标志码:A
文章编号:1002-266X(2015)02-0001-04
doi:10.3969/j.issn.1002-266X.2015.02.001

