水疱性口炎病毒荧光R T-PC R 鉴别检测方法的建立与应用
臧京帅,高志强,王丽萍,郭金玉,傅 毅,牛建蕊,刘文晓,张乐萃,张鹤晓
(1.青岛农业大学动物科技学院,山东 青岛266109 ;2.北京出入境检验检疫局,北京 朝阳100026;3.北京森康生物技术开发有限公司,北京 怀柔101400)
水疱性口炎(Vesicular stomatitis,VS)是由水疱性口炎病毒(Vesicular stomatitis virus,VSV)引起的动物病毒性传染病,VSV 可感染马及其他多种动物,其中马的易感性最强。其临床特征为短期发热,口腔黏膜、乳头上皮、蹄冠部出现丘疹和水疱。VSV 有2 个血清型,即印第安纳型(VSVIND)和新泽西型(VSV-NJ)。VS-NJ 主要发生在美洲,法国和南非曾有该病的报道[1],VSV-IND 在巴西和阿根廷呈周期性发生。水疱性口炎是目前我国重点防范的外来疫病之一。随着我国与国外的动物及动物产品贸易增长,VS 传播的风险不可忽视,建立可靠的检测技术对严防该病的传播意义重大。
水疱性口炎常规诊断方法主要包括病毒分离和血清学方法。病毒分离需进行细胞接毒培养,不仅耗时费力,且野毒常常难于在体外培养细胞中增殖[2]。由于国内缺乏水疱性口炎病毒标准血清等诊断试剂,血清学方法的建立和应用,由于国内水泡性口炎病毒标准血清等诊断试剂的缺乏而受到限制,同时,血清学方法检测抗体不利于感染早期快速诊断。常规RT-PCR 方法检测VSV 并鉴别血清型的研究已有报道[2-3],但基于凝胶电泳的RT-PCR,需要在扩增结束后进行凝胶电泳分析,易污染。
序列分析表明,VSV 两个血清型的L 基因存在差异,可以用来鉴别分型。本研究针对L 基因设计1对通用引物,理论上可以扩增所有VSV-NJ 和VSVIND 病毒核酸,然后针对VSV-NJ 和VSV-IND 分别设计TaqMan 探针,用于两个血清型病毒核酸的分型鉴别。方法建立后,应用两个血清型的病毒核酸以及其他一些马病病原核酸对方法进行验证,结果显示,建立的方法特异性良好,对两个型病毒核酸的分型检测中未见交叉反应,初步表明,建立的方法可用于VSV 的快速分型检测。
1 材料与方法
1.1 病毒与细胞 VSV-IND 核酸,中国农业大学动物医学院提供;VSV-NJ,美国NVSL 提供;东部马脑脊髓炎病毒ssp. North American variant 株核酸,西部马脑脊髓炎病毒McMillan 株核酸,由军事医学科学院提供;马动脉炎病毒CVL Bucyrus 核酸,由美国NVSL 提供。马疱疹病毒1 型核酸,马流感病毒H3N8 核酸,口蹄疫病毒核酸,VERO 细胞均由本实验室保存。
1.2 主要试剂及仪器设备 TRIZol,购自Invitrogen公司;M-MLV 反转录酶、Taq DNA 聚合酶、RNA 酶抑制剂、dNTP、DL-2 000 Marker 等,购自Promega 公司。
主要仪器有荧光定量PCR 仪(Roche LightCyclerⅡ),台式冷冻高速离心机(Eppendorf Centrifuge 5417R)。
1.3 病毒半数感染量(TCID50)的滴定 将两血清型病毒参照邵振华等[5]的方法,计算TCID50,按Reed Muench 方法计算TCID50/50 μL。
1.4 引物探针设计 对GenBank 中登录的两个型的VSV 病毒株序列进行多重比对后,选择L 基因进行引物探针设计,利用Oligo6.71 设计1 对通用引物和分别针对两型病毒的MGB 探针,引物探针序列见表1。
1.5 标准质控品制备与初步定值 使用通用引物VSV1和VSV2扩增水疱性口炎病毒印第安纳型(VSVIND)和新泽西(VSV-NJ)的基因片段(与荧光定量RT-PCR 扩增区域相同),引物序列见表1,将扩增片段纯化回收后分别克隆于pMD20-T 载体中,命名为VSV-IND-L 和VSV-NJ-L,转化Top10 大肠杆菌感受态细胞并进行蓝白斑筛选。挑取白色菌落经菌落PCR 鉴定为阳性单菌落后,用3~5 mL 液体LB 培养基分别培养,用试剂盒提取质粒。质粒线性化后,用RiboM-AXTMLarge Scale RNA Production Systems-SP6 试剂盒进行体外转录。转录产物经无RNase 的Dnase 消化除去其中的DNA 模板后,75 ℃10 min 将DNase 灭活,再次抽提纯化制备出所需cRNA,分别按照20 μL/管分装,保存于-80 ℃备用。
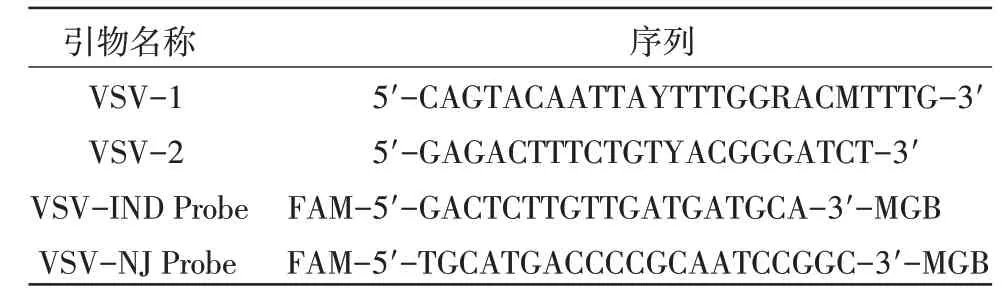
表1 VS V 荧光R T-PC R 检测分型引物探针序列
取制备的cRNA 作1∶100 稀释,测定其260 nm和280 nm 的吸光度值(A260 和A280)并计算拷贝数,用75% TRIZol 水溶液(TRIZol:水=3∶1)稀释至1.0×108拷贝数/mL。然后进行分装,1.0 mL/管。
1.6 荧光RT-PCR 反应条件的优化
1.6.1 引物和探针浓度的优化 将引物浓度以0.1 μM 为间距从0.1 μM 至0.8 μM 递增,探针浓度以0.025 μM 为间距从0.025 μM 至0.2 μM 递增。将不同浓度配比的引物和探针进行比较。
1.6.2 Mg2+浓度的优化 应用筛选好的引物探针,将Mg2+的浓度以0.5 mM 为间距从1.5 mM 至6.0 mM 递增。并将调整后不同浓度Mg2+扩增结果进行比较。
1.6.3 其他条件的优化 引物探针及Mg2+的浓度筛选好后,对Taq DNA 聚合酶用量,反应参数和循环数等条件做进一步的优化。
1.7 灵敏度试验 将已知TCID50的两血清型病毒分别进行10 倍梯度稀释,提取RNA 用建立的方法进行荧光RT-PCR 测定;将已知拷贝数的两血清型RNA 作系列稀释,用建立的检测方法进行荧光RT-PCR 测定,分别确定其检测极限。
1.8 特异性试验 用所建立的方法对VSV-NJ,VSV-IND,东部马脑脊髓炎病毒核酸,西部马脑脊髓炎病毒核酸,马动脉炎病毒核酸,马流感病毒H3N8 核酸,马疱疹病毒1 型核酸,口蹄疫病毒核酸进行检测,以及30 份已知阴性样品的呼吸道拭子进行检测,以验证该方法的特异性。
1.9 重复性试验 对3 份不同TCID50的病毒核酸用所建立的检测方法分别检测3 次,根据其各自的CT 值求出变异系数,以验证该方法的重复性及稳定性。
1.10 临床送检样品的检测 用上述建立的方法和文献报道的普通RT-PCR 方法对所采集的257份马血样品和85 份牛OP 液样品进行检测,验证方法的临床实用性。
2 结果
2.1 TCID50测定结果 参考邵振华等[4]的方法,测得VSV-IND 的TCID50为10-6.2/50 μL,VSV-NJ 的TCID50为10-3.65/50 μL。
2.2 反应条件的优化结果 经多次试验优化最终建立如下体系,见表2。
2.3 荧光定量RT-PCR 反应参数的优化 经多次重复性试验,我们发现该检测方法的最适循环参数为42 ℃30 min,92 ℃3 min,92 ℃15 s,55 ℃25 s,65 ℃30 s,42 ℃2 min,40 个循环,60 ℃时收集荧光。

表2 VS V-IND 和VS V-NJ 检测分型反应体系优化结果
2.4 灵敏度试验 将已知TCID50的两血清型的病毒分别进行10 倍系列稀释,提取RNA,用建立的方法进行检测,IND 型水疱性口炎荧光定量RT-PCR 检测方法结果显示,检测极限可达0.158 TCID50。NJ 型水疱性口炎荧光定量RT-PCR 检测方法结果显示,检测极限可达0.0045 TCID50。
图1 为IND 型水疱性口炎病毒RNA(TCID50=10-6.2/50 μL)的荧光RT-PCR 结果。图2 为NJ 型水疱性口炎病毒RNA(TCID50=10-3.65/50 μL)的荧光RT-PCR 结果。
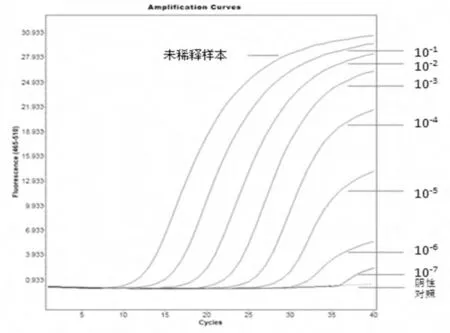
图1 IND 型水疱性口炎病毒R NA 的荧光R T-PC R 结果
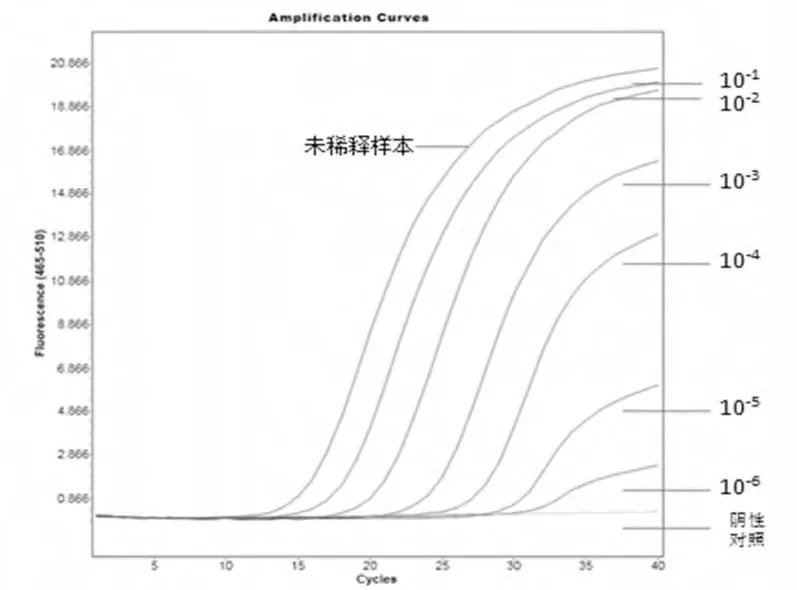
图2 NJ 型水疱性口炎病毒R NA 的荧光R T-PC R 结果
采用建立的方法分别对106~101拷贝数VSVIND cRNA 和VSV-NJ cRNA进行荧光RT-PCR 检测,确定灵敏度。结果显示,本方法的分析灵敏度对于VSV-IND 以及VSV-NJ 均可达10 拷贝/反应。见图3。

图3 VS V-IND 和VS V-NJ cR NA 荧光R T-PC R 检测极限测定
2.5 特异性试验 利用本试验所建立的荧光定量RT-PCR 检测方法对1.1 所列的病毒核酸进行检测,结果显示,建立的方法能很好鉴别VSVIND 和VSV-NJ,但不能检出其他病原和已知阴性的样品。表明所建立的检测方法特异性好。
2.6 重复性试验 对不同浓度TCID50两血清型的病毒核酸用所建立的检测方法重复检测3 次的结果如表3,对通用检测方法不同试验获得的Ct 值标准差分别位于0.34~0.54(IND)、0.19~0.29(NJ),变异系数分别为2.4%~2.8%(IND)、0.9%~1.4%(NJ);证实所建立的方法具有良好的重复性和稳定性,可以满足检测的需要。见表3。

表3 重复性试验结果
2.7 临床样品检测结果 用所建立的方法对257份进出口马血样品和85 份牛OP 液进行了检测,结果显示均为VSV 阴性,并与文献报道的RTPCR 方法进行了比较,二者符合率100%。结果见表4。
表4 临床样品检测结果
3 结论与讨论
荧光定量RT-PCR 是近几年一种新型的核酸定性、定量技术,极大地简化了定量检测过程,而且真正地实现了绝对定量。其自动化操作提高了工作效率,反应快速、灵敏度高、特异性强、重复性好、结果清晰,是目前病毒、细菌检测技术发展的一个新领域。本研究在鉴别水疱性口炎病毒印第安纳型和新泽西型时,针对L 基因(编码病毒聚合酶)设计一对通用引物,可同时扩增这2 个型的病毒核酸,然后使用TaqMan 探针鉴别这2 个型的毒株。本研究对两个血清型检测所用探针标记的荧光发光基团相同,采用两步法进行鉴别检测,下一步将对两种血清型的探针分别标记不同荧光发光基团,这样可以一步鉴别两种血清型病毒,达到快速、简便、经济的目的,这也是本研究设计通用引物的原因所在。运用建立的方法,所需的检测时间包括处理样品、PCR 扩增反应、标准曲线的分析可在3 h 左右完成,试验结果表明,本方法的灵敏度可达10 拷贝/反应,与已报道的荧光探针RT-PCR 检测方法相当。
通用引物是利用不同核酸序列之间存在的高度保守区来设计的。本试验针对VSV 两血清型L基因的保守区域设计的通用引物与普通的引物相比可以简便、快捷的同时扩增出VSV 两血清型的目的片段。
由TCID50测定结果和荧光RT-PCR 标准曲线对比可得,VSV-NJ 型毒株TCID50值较低,但荧光RT-PCR 检测病毒含量并不低,分析可能是NJ 型毒株与IND 型毒株相比对VERO 细胞致病力较低,虽然病毒增殖明显,但病理反应不明显。
此外,通过特异性、敏感性、重复性试验证明了该方法有较好的特异性、敏感性和重复性,利用建立的荧光定量RT-PCR 方法检测临床样品342 份,结果均为阴性。与已知其他方法检测结果一致,表明本方法检测结果可信程度高,为VSV 的分型鉴别检测以及防治奠定了重要的基础。
[1] Office International des Epizooties(OIE).Vesicular Stomatitis[A].Manual of diagnostic tests and vacciners for terrestrial animals,Chapter 2.1.2[EB].http://www.oie.int.
[2] Hofner M C,Carpenter W C,Ferris N P,et al.A hemi-nested PCR Assay for the detection and identification of vesicular stomatitis virus nucleic acid [J].J Viro Method,1994,50:11-20.
[3] Rodriquez L L,Letchworth G J,Spriropoulou C F,et al.Rapid detection of vesicular stomatitis virus New Jersery serotype in clinical samples by using polymerase chain reaction[J].J Clin Microbiol,1993,31:2016-2 012.
[4] 邵振华,田海燕.猪瘟免疫荧光细胞中和试验的研究[J]. 中国兽医科技,1988,18(10):13-16.

