RP-HPLC法测定术苦芩颗粒中黄芩苷和苦参碱含量
邱 洪,朱兆荣,刘 娟,凌榕镔,罗艺晨
(西南大学荣昌校区动物医学系,重庆 荣昌402460)
术苦芩是根据中兽医理论和临床辨证的原则,选用黄芩、苦参、白术、金银花、藿香等多味中药组成的复方制剂[1]。临床试验证明,其能有效改善犬细小病毒病所致的免疫力下降,对犬细小病毒病具有一定预防和治疗作用[2-3],同时能对细小病毒病犬的各种组织器官起到较好的保护作用[4-7]。鉴于方中清热解毒的黄芩,燥湿、利水的苦参,补脾健胃的白术,均为术苦芩的君药;金银花、白头翁、黄芪及藿香等具有清热解毒、止痢,补气升阳、利水消肿,芳香化湿、行气和中等功效,共为臣、佐药。此方诸药合用,可清热燥湿,利水止痢,治湿热泄泻之症等[8]。术苦芩颗粒剂主要含有黄芩苷、苦参碱,而其活性成分具有抗感染、免疫调节、抗心律失常、降压、抗肿瘤、抗过敏、抗病毒及解热镇痛等作用[9-11],因此选定黄芩苷和苦参碱作为日后工业化生产术苦芩颗粒提供有效质量控制标准之一。本试验建立了术苦芩颗粒剂HPLC色谱法测定其中主要有效成分黄芩苷和苦参碱的含量方法,为其质量控制奠定基础。
1 材料与方法
1.1 主要试药与试剂 术苦芩颗粒(1 g生药/g,西南大学荣昌校区动物医学系兽医科学研究中心中药创新实验室研究,重庆市天龙牧业科技有限公司生产,批号:20110820,20110829,20110910);黄芩苷标准品(中国药品生物制品检定所,批号:110423);苦参碱标准品(中国药品生物制品检定所,批号:110805-200508);乙腈(Honeywell Burdick&Jackson Ulsan,批号:N6QA1H,色谱级);甲醇(SKChemicals,批号:AH230-4,色谱级);磷酸(川东化工有限公司,批号:20121001,分析级);三乙胺(上海实验试剂有限公司,批号:20131211,分析级)。
1.2 主要仪器设备 SPD-20A紫外检测器(日本岛津公司);DGU-20A3脱气机(日本岛津公司);LC-20AD型泵(日本岛津公司);CTO-20A柱温箱(日本岛津公司);AB135-S电子分析天平(梅特勒—托利多仪器有限公司);纯水仪;SB-25-12型超声波清洗机(宁波新芝生物科技股份有限公司);C18柱4.6mm×250mm,5μm(岛津公司);4.6mm×150mm,5μm,WelchWaterials公司。
1.3 试药准备与检测方法
1.3.1 对照品溶液制备 分别取黄芩苷对照品和苦参碱对照品适量,精密称定,加各自的流动相制成每毫升含黄芩苷60μg的溶液和每毫升含苦参碱50μg的溶液,即得。
1.3.2 供试品溶液制备 取术苦芩颗粒适量,研细,过七号筛。黄芩苷供试品:取0.5 g细粉于具塞锥形瓶中,精密加入100mL甲醇,密塞,称重,超声(250 W,35 kHz)30min,称重,用甲醇补足减失重量,滤过,精密量取滤液10mL至100mL容量瓶中,即得。苦参碱供试品:取3 g细粉于具塞锥形瓶中,精密加入28.8mL氯仿和1.2mL氨水,密塞,称重,在超声(250W,35kHz)20min,称重,用三氯甲烷补足减失重量,滤过,精密量取滤液10mL至蒸发皿,水浴蒸干,残渣用流动相溶解后转移至10mL容量瓶中,用流动相定容即得。
1.3.3 色谱条件 均以十八烷基硅烷键合硅胶为填充剂;柱温:30℃;进样10μL;流速:1mL/min。黄芩苷色谱条件以甲醇-0.4%磷酸溶液(用三乙胺调节pH值至3.0)(52∶48)为流动相,检测波长为274 nm。
苦参碱色谱条件以乙腈-甲醇-0.2%磷酸溶液(用三乙胺调节pH值至7.0)(22∶13∶65)为流动相,检测波长为220 nm。
1.3.4 线性关系 取黄芩苷对照品储备液 200μg/mL,用流动相依次稀释为150μg/mL、100μg/mL、50 μg/mL、25μg/mL、10μg/mL。取苦参碱对照品储备液400μg/mL,用流动相依次稀释为200μg/mL、150 μg/mL、100μg/mL、50μg/mL、25μg/mL、10μg/mL。按1.3.3色谱条件方法分别进行测定,进样10μL,测定结果以对照品浓度为横坐标,峰面积为纵坐标,用最小二乘法进行线性回归分析。
1.3.5 专属性 分别取等份的不含黄芩的术苦芩颗粒、不含苦参的术苦芩颗粒和术苦芩颗粒适量,按1.3.2方法配置阴性对照供试品溶液和供试品溶液。用1.3.3色谱条件进行测定,考察此方法的专属性。
1.3.6 精密性和重复性 用1.3.2方法制备供试品溶液,用1.3.3色谱条件测定,平行测定6次,计算结果的相对标准偏差RSD,来考察仪器精密性。精密称取同一批术苦芩颗粒6份,按1.3.2方法制备供试品溶液,分别进样,记录黄芩苷峰面积和苦参碱峰面积,计算结果的相对标准偏差RSD,来考察样品测定的重复性。
1.3.7 加样回收率 精密量取术苦芩颗粒1.25 g于锥形瓶中,电子天平精密加入黄芩苷对照品10.0mg。精密量取术苦芩颗粒3.0 g于锥形瓶中,电子天平精密加入苦参碱对照品1.8 mg。按照
1.3.2 方法和1.3.3色谱条件分别进行处理和测定,计算加样回收率,重复6次。
1.3.8 定量限 分别准确称取5份不含苦参的术苦芩颗粒,按1.3.2样品处理方法进行处理,测得基线噪音平均值。用流动相稀释供试品溶液成不同浓度的供试液,依1.3.3色谱条件进行测定,以响应信号和噪音之比(S/N)为10的最低稀释浓度作为定量限。
1.3.9 耐用性 在原方法基础上,分别改变如下条件。黄芩苷耐用性考察:样品处理时间(20min、30 min、40min)、流动相配比(50∶50、52∶48、54∶46)、pH值(2.8、3.0、3.5)、温度(25℃、30℃、35℃),以及色谱柱规格(4.6μm×150mm、4.6μm×250mm)。苦参碱耐用性考察:样品处理时间(10min、20min、30 min)、流动相配比(25∶15∶60、22∶13∶65、18∶12∶70)、pH值(6.5、7.0、7.5)、温度(25℃、30℃、35℃),以及色谱柱规格(4.6μm×150mm、4.6μm×250mm),再对测定结果的色谱图的分离度,拖尾因子进行评测,考察该色谱方法的耐用性。
2 结果
2.1 线性关系 用建立的含量测定方法分别测定系列黄芩苷对照品溶液和苦参碱对照品溶液,其浓度与峰面积的线性回归方程分别为Y=5.56763×10-8X-2.79465×10-3(r=0.99991)和Y=3.4334×104X-2.0406×103(r=0.99994),说明在黄芩苷和苦参碱分别在浓度为10μg/mL~150μg/mL和10μg/mL~400μg/mL范围内与峰面积均呈良好线性关系。

2.2 专属性 测定结果色谱图见图1,在黄芩苷对照品和苦参碱对照品峰的保留时间上供试品显示,按供试品配置方法制备供试品溶液,室温下放置,分别于0、2、4、6、8、12 h,进行测定得出术苦芩中黄芩苷和苦参碱峰面积的相对标准偏差分别为0.096%和0.280%。精密试验结果显示,对同一供试品溶液平行测定6次,测得黄芩苷和苦参碱的峰面积的相对标准偏差分别为0.023%和0.653%,精密性符合2010年版兽药典含量测定方法RSD<2.0%的规定,此法的精度性符合含量测定的要求。重复性试验结果显示,计算黄芩苷均有相应的色谱峰出现,阴性对照无对应色谱峰,表明用此法在测定术苦芩颗粒中黄芩苷含量和苦参碱含量时均具有较好的专属性。
2.3 稳定性、精密性和重复性 稳定性试验结果和苦参碱峰面积的RSD分别为0.228%和0.997%,表明重复性良好。
2.4 加样回收率 分别精密称取6份术苦芩颗粒3.0 g于锥形瓶,精密加入黄芩苷对照品10.0mg和苦参碱对照品1.8mg,其他按照1.2.3方法制备,分别测定。测得结果为术苦芩中黄芩苷和苦参碱的平均回收率分别为99.22%(RSD为0.641%)和98.33%(RSD为1.257%),结果见表1。
2.5 定量限 根据5个阴性对照的基线噪音平均值分别为噪音值N1(黄芩苷)和N2(苦参碱),术苦芩颗粒供试品检测黄芩苷峰信号和苦参碱峰信号为信号值(S1和S2),以S/N≥10作为定量标准,测得此法测定术苦芩颗粒中黄芩苷含量和苦参碱含量的定量限分别为2μg/mL和4μg/mL。
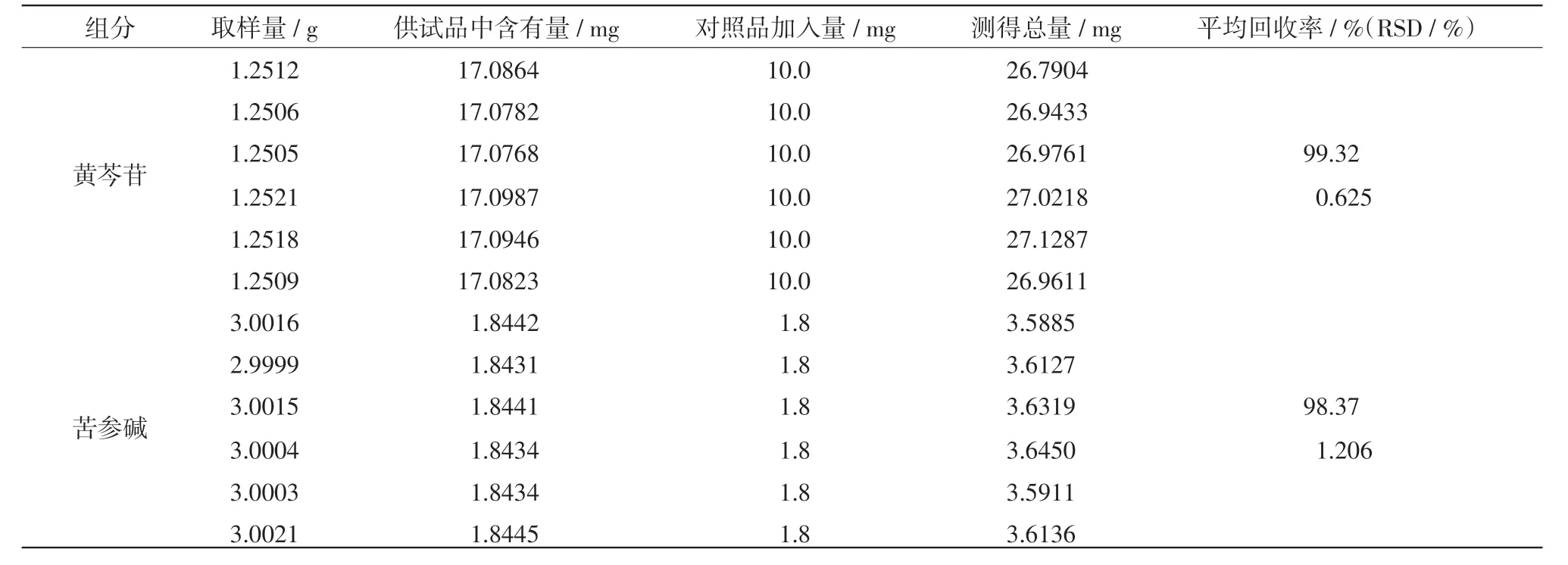
表1 加样回收率试验结果
2.6 样品测定 取不同批的术苦芩颗粒样品6份,精密称定,按1.3.2方法制备供试品溶液,进样10μL,记录色谱峰,计算苦参碱的含量,结果见表2。

表2 术苦芩颗粒中黄芩苷和苦参碱的含量 (n=6)
2.7 耐用性 试验通过改变样品处理时间、色谱条件中流动相的配比、流动相的pH值、柱温、色谱柱类型以考察此法的耐用性。试验结果显示,在条件改变的情况下,样品中黄芩苷波峰和苦参碱波峰的分离度均>2、拖尾因子均介于0.95~1.05之间、理论塔板数均在10 000以上。
3 讨论
3.1 样品提取方法考察 采用超声法处理供试样品,其超声震荡作用均加大了黄芩苷和苦参碱的溶出度及溶出速度[13];同时,利用三氯甲烷增加苦参碱溶出率[14-17]。在超声提取方法中,考察了超声不同时间(黄芩苷:20min、30min、40min,苦参碱:10min、20min、30min)的提取效果,结果表明,在分别超声30min后和20min后提取的黄芩苷和苦参碱经测定均无显著变化,因此提取黄芩苷和苦参碱分别选取超声30min和20min。
3.2 检测波长的选择 取黄芩苷对照溶液和苦参对照品溶液作紫外光谱扫描,结果可见黄芩苷在274 nm和苦参碱在220.1 nm波长处有最大吸收,且在分别在(273.2±3)nm和(219.2±2)nm波长范围内吸收稳定,基线较好,对测定无干扰。因此,参考2010年版《中国药典》(一部)中关于黄芩药材中黄芩苷和苦参药材中苦参碱的检测标准中的最大吸收波长,并结合本研究,最终选用274 nm和238 nm作为本试验的检测波长。
3.3流动相的选择 C18为填充物的反向色谱柱作为分析柱,黄芩苷的流动相有机相组分为甲醇,无机相选择0.4%磷酸溶液(用三乙胺调节pH值至3.0)。苦参碱的流动相有机相组分为乙腈和甲醇,无机相选择0.2%磷酸溶液(用三乙胺调节pH值至7.0)。黄芩苷的峰形和苦参碱的峰形均较好,且与相邻杂质峰都能达到较好的分离,保留时间适中。
3.4 本试验建立了术苦芩颗粒中黄芩苷和苦参碱含量高效液相色谱检测方法 分别以甲醇和三氯甲烷作为溶剂用超声法对颗粒剂进行处理,C18色谱柱作为分析柱,紫外检测器检测。所建立的方法的专属性、稳定性、准确性、检测灵敏度及方法的耐用性能满足术苦芩颗粒中黄芩苷含量和苦参碱含量测定的要求。
[1] 中国兽药典委员会.中华人民共和国兽药典一部[M].北京:中国农业出版社,2010:95-96.
[2]朱兆荣,刘娟,聂晨睿.复方苦芩注射液对人工感染犬细小病毒病的防治[J].中兽医医药杂志,2010(6):34-37.
[3]朱买勋,刘娟,杜林林,等.复方参芩感染心肌炎型细小病毒犬血象和血液生化指标的影响[J].黑龙江畜牧兽医,2013(7):108-109.
[4]李梁,刘娟,诸葛证,等.复方苦芩对细小病毒病犬组织结构影响[J].中国兽医杂志,2010,46(4):49-51.
[5]刘俊玮,刘娟,杜林林,等.复方参芩对犬细小病毒致心肌组织Bcl-2和Bax mRNA的影响[J].畜牧兽医学报,2013,44(1):122-128.
[6]杜林林,李梁,刘娟,等.复方苦芩对犬细小病毒致肠黏膜细胞凋亡及相关基因表达的影响[J].中国兽医学报,2012,32(10):1511-1515
[7]诸葛证,朱兆荣,刘娟.复方苦芩对细小病毒病犬红细胞及血红蛋白变化的影响[J].内江科技,2009,30(12):25-25.
[8]程士德,郭霞珍,王庆其,等.内经[M].2版.北京:人民卫生出版社,2006:16-20:266-584.
[9]刘凯,张会波,武昌学,等.苦参碱对兔尿道狭窄形成的影响研究[J].现代中西医结合杂志,2012,21(4):366-368.
[10]Xiaolei Pan,LiWang,Dirk Gründemann,et al.Inhibition of human organic cation transporters by the alkaloidsmatrineand oxymatrine[J].Fitoterapia,2014,92:206-210.
[11]Wenchung Huang,Chengchi Chan,Shuju Wu,et al.Matrine attenuates allergic airway inflammation and eosinophil infil-tration by suppressing eotaxin and Th2 cytokine production in asthmatic mice[J].Journal of Ethnopharmacology,2014,151(1):470-477.
[12]Zhijun Dai,Jie Gao,Zongzheng Ji,et al.Matrine induces apoptosis in gastric carcinoma cells via alteration of Fas/FasL and activation of caspase-3[J].Journal of Ethnopharmacology,2009,123(1):91-96.
[13]晏芸,黄小梅,肖国民,等.新技术在中药提取中的应用研究[J].化工时刊,2012,26(1):49-53.
[14]杨美玲,曹新录,崔东亚,等.苦参碱的提取与含量测定[J].浙江农业科学,2011(2):413-415.
[15]王丹,吕佳,张振秋,等.正交试验优选苦参生物碱提取工艺研究[J].中国中医药信息杂志,2011,18(1):51-52.
[16]钟彩娜,钟文,伍严利.正交试验优选苦参中苦参碱的提取工艺[J].医学信息:上旬刊,2011,24(18):6038-6039.
[17]中国兽药典委员会.中华人民共和国兽药典二部[M].北京:中国农业出版社,2010:270-780.

