气体交换与荧光同步测量估算植物光合电子流的分配
康华靖, 李 红, 陶月良, 张海利,权 伟, 欧阳竹
1 中国科学研究院地理科学与资源研究所生态网络观测与模拟重点实验室,北京 100101 2 中国科学研究院禹城综合试验站,北京 100101 3 中国科学研究院研究生院,北京 100049 4 温州科技职业学院, 温州 325006 5 温州大学生命与环境科学学院, 温州 325026
气体交换与荧光同步测量估算植物光合电子流的分配
康华靖1,2,3,4, 李 红4, 陶月良5, 张海利4,权 伟4, 欧阳竹1,2,3,*
1 中国科学研究院地理科学与资源研究所生态网络观测与模拟重点实验室,北京 100101 2 中国科学研究院禹城综合试验站,北京 100101 3 中国科学研究院研究生院,北京 100049 4 温州科技职业学院, 温州 325006 5 温州大学生命与环境科学学院, 温州 325026
光合电子流分配是植物光合控制的一个重要环节。然而,传统电子流分配的计算方法存在诸多问题尚未引起人们的注意,如:(1)低估了光呼吸每释放一个CO2分子所消耗的电子数;(2)混淆了相对电子传递速率和绝对电子传递速率;(3)忽略了除碳同化和光呼吸外的其他电子流分配途径;(4)难以准确获取光下暗呼吸速率值,从而导致碳同化电子流(JC)及光呼吸速率(Rp)的不准确估算等。以小麦和大豆气体交换与荧光同步测量数据为例,结果表明大豆电子传递速率与碳同化两者对光强的响应一致性较好,同时达到最大值;而小麦的一致性相对较差,说明电子传递速率和碳同化并非完全一致,推测认为有可能与作物对同化产物输出的模式不同有关。通过光呼吸速率换算出的电子流(12×Rp)与实际测量电子流(ΔJO)之间存在较大的差异;另外,传统方法估算出的光呼吸速率(估算值)与光呼吸测量值之间也存在较大差异,分析认为这主要是由于绝对光合速率与相对电子传递速率之间差异造成。
气体交换; 荧光; 电子流分配; 碳同化; 光呼吸; 光下暗呼吸
光合电子流分配是植物光合控制的一个重要环节[1]。植物光合电子流除参与碳同化和光呼吸外,还参与硝酸还原、草酰乙酸还原、Mehler反应、围绕PSⅠ的循环电子流等[2]。如果分配在光化学反应上的光合电子流是一定的,不同电子流分配途径之间便存在相互竞争,其中一条途径对光合电子流的利用增加,其他途径对光合电子流的利用就会相应减少[3]。深入研究不同植物种类及其在不同环境条件下光合电子流传递分配规律将有助于阐明“光合控制”的特点、模式和机理[4]。
植物体内发出的叶绿素荧光信号包含了丰富的光合信息,可快速、灵敏和非破坏性的分析叶片光能的分配方向[5- 6]。20世纪90年代,Genty等[7]和Valentini等[8]研究表明,光系统Ⅱ(PSⅡ)的电子传递效率(ΦPSⅡ)与光合电子流(Φe)成线性相关,光合电子流(Φe)又可通过无光呼吸的情况下CO2同化的表观量子产量(ΦCO2)来估算,从而为气体交换参数与荧光参数有机结合而深入探讨光合过程提供了思路。目前,气体交换和荧光同步测量在研究植物光能利用效率、碳同化和光抑制之间的关系等越来越受重视。Long等[9]通过叶片气体交换和荧光同步测量提供了确定叶肉导度值的精确方法;Yin等[10]通过叶片气体交换和荧光同步测量对光下暗呼吸等光合参数进行了估算;康华靖等[11]对植物气体交换和荧光测量数据拟合的方法进行了比较研究,认为利用植物叶片的气体交换和荧光测量数据,再结合直角双曲线修正模型拟合的方法可作为研究光合特性和光系统Ⅱ(PSⅡ)动力学的一种有效手段。然而,将气体交换和荧光参数结合而估算植物电子流分配的方法存在诸多问题,目前尚未引起人们的重视。为此,本文首先从生化过程对其缺陷进行了论述,然后以小麦和大豆气体交换与荧光同步测量数据为例进行验证,旨在为植物光合电子流分配探讨提供参考。
1 材料与方法
1.1 实验设计
实验于中国科学院禹城综合试验站的试验田中进行。小麦(Triticumaestivumcv. Z39- 118)和大豆(Glycinemax)种子分别播于2011年10月和2012年5月。常规管理。数据测量分别于2012年5月和6月进行(均为晴天)。此时植株处于旺盛的营养生长期。随机选取5至7株长势较为一致的健壮植株,大豆挑选每株苗自下而上第5片复叶的顶叶作为测量对象,小麦选择其旗叶作为测量对象。
不同氧浓度的控制为:2%O2为山东禹城新建气体厂提供的混合气体(2%O2和98%N2)。气体通过减压阀流入长2 m,宽1.5 m的密封的塑料缓冲袋,袋中注入少量自来水以保证气体的相对湿度,最后通过进气管接入Li- 6400,以保证持续稳定的低氧环境;大气中的O2浓度视为21%。
1.2 数据测量
数据测量时,在自然光下诱导1.5—2 h后,采用开放式气路,设定温度为(30±1.3) ℃ (小麦)和(33±1.3) ℃ (大豆),流速为400 μmol/s,空气相对湿度控制在45%—70%,应用CO2注入系统提供稳定的CO2浓度(380 和0 μmol/mol); Li- 6400- 40荧光探头提供不同光合有效辐射强度(PAR),分别为2000、1800、1600、1400、1200、1000、800、600、400、200、150、100、80、50、0 μmol m-2s-1,采用自动测量程序(Flr Light curve),同时记录21%和2%O2浓度下叶片的气体交换和叶绿素荧光等参数。每次记录最小等待时间为2 min,最大等待时间为3 min,数据记录之前仪器均自动进行参比室和样品室之间的匹配。
1.3 数据统计分析
植物的光合作用对光的响应曲线用直角双曲线的修正模型拟合(以下简称直角双曲线修正模型)[12- 13]。光呼吸速率(Rp)等于两种O2浓度 (21%和2%)下表观光合速率的差值。两种O2浓度下的电子传递速率(ETR)之差为电子流降低(ΔJO),即ΔJO=ETR21%-ETR2%。根据5至7株的测定数据(即5—7次重复),求其平均值。采用SPSS11.5进行方差差异显著性分析,Excel2010作图。
2 模型分析
目前,国内外关于光合电子流的计算主要采用Valentini等[8]和Epron等[14]所介绍的方法(简称传统方法):
JT=ETR=ΦPSⅡ×PAR×0.5×0.84
(1)
式中,PAR是光合有效辐射,ΦPSⅡ是PSⅡ的电子传递效率,由(Fm-Fs)/Fm计算而得[15,7],0.84为叶片的光吸收系数[7,16],0.5为光能在PSⅡ和PSI两个光系统中分配的比例[17]。
其中光呼吸电子流分配(JO)和碳还原电子流分配(JC)的表达式分别为:
JO=4×(2×Rp)
(2)
JC=4×(A+Rd+Rp)
(3)
式中,A为表观光合速率;Rd为光下暗呼吸速率;4为每同化1个CO2分子需要的电子数;2为每消耗2个O2分子释放出一个CO2分子[18- 19]。
同时,传统方法认为植物叶片中来自PSⅡ的电子除了参与碳同化和光呼吸外,其他途径可以忽略或至少为常数[8,14, 20],即总电子流(JT)等于碳还原电子流分配(JC)和碳氧化(JO)所分配的电子流之和:
JT=JC+JO
(4)
据此,光呼吸速率(Rp)的估算表达式为:
Rp=[JT-4×(A+Rd)]/12
(5)
然而,该传统方法存在的缺陷以下缺陷:首先,该方法只考虑了叶绿体内的1,5-二磷酸核酮糖(RUBP)耗氧,而忽略了乙醇酸在过氧化物酶体中的耗氧。根据物质守恒,可知C2氧化光合循环消耗3mol的氧分子(2mol在叶绿体中用于氧化RUBP,1mol在过氧化物酶体中),最后在线粒体中释放1mol CO2、消耗2mol还原力(2Fdred+2H+),完成2-C骨架返回到卡尔文循环[21]。因此,光呼吸速率(Rp)与耗O2速率(Vo)的比例关系应为:
Vo=3×Rp
(6)
光呼吸所分配的电子流(Jo)则为:
Jo=4×Vo=4×(3×Rp)=12×Rp
(7)
其次,植物叶片中来自PSⅡ的电子除了参与碳同化和光呼吸外,其他途径所分配的电子流(Ja),如氧的还原(Mehler反应)、氮代谢等途径,不能忽略或者不为常数[22],那么则有:
JT=JC+JO+Ja
(8)
另外,传统方法中碳还原所分配的电子流(JC)以及光呼吸速率的计算均需用到参数——光下暗呼吸速率(Rd)。然而,目前关于光下暗呼吸速率的估算方法存在较大争议,一些学者假设光下暗呼吸速率(Rd)不受光强或CO2浓度影响,而通过光响应曲线[23]或者CO2响应曲线[24]来估算;一些学者根据经验值进行换算[25];一些学者将其等同于暗呼吸速率[26]。这均将严重影响碳还原电子流分配及光呼吸速率的准确估算。
3 结果与讨论
3.1 荧光光曲线
由图1可知,直角双曲线修正模型不仅可以很好地拟合光响应曲线,也可较好地拟合快速光响应曲线(图1)。表1给出了拟合小麦和大豆的光响应曲线、快速光曲线的拟合参数所得到的光合参数,以及这些光合参数相应的测量值,其拟合值均与实测值较为一致。其中,由表观光合速率和电子传递速率分别估算出的饱和光强,在大豆中分别为1938.11和1945.16 μmol m-2s-1,说明在大豆叶片中电子传递速率与碳同化两者对于光强的响应一致性较好;而在小麦中分别为2289.38 和1649.55 μmol m-2s-1,两者之间差异显著(P<0.05),分析认为有可能与作物对同化产物输出的模式不同有关。
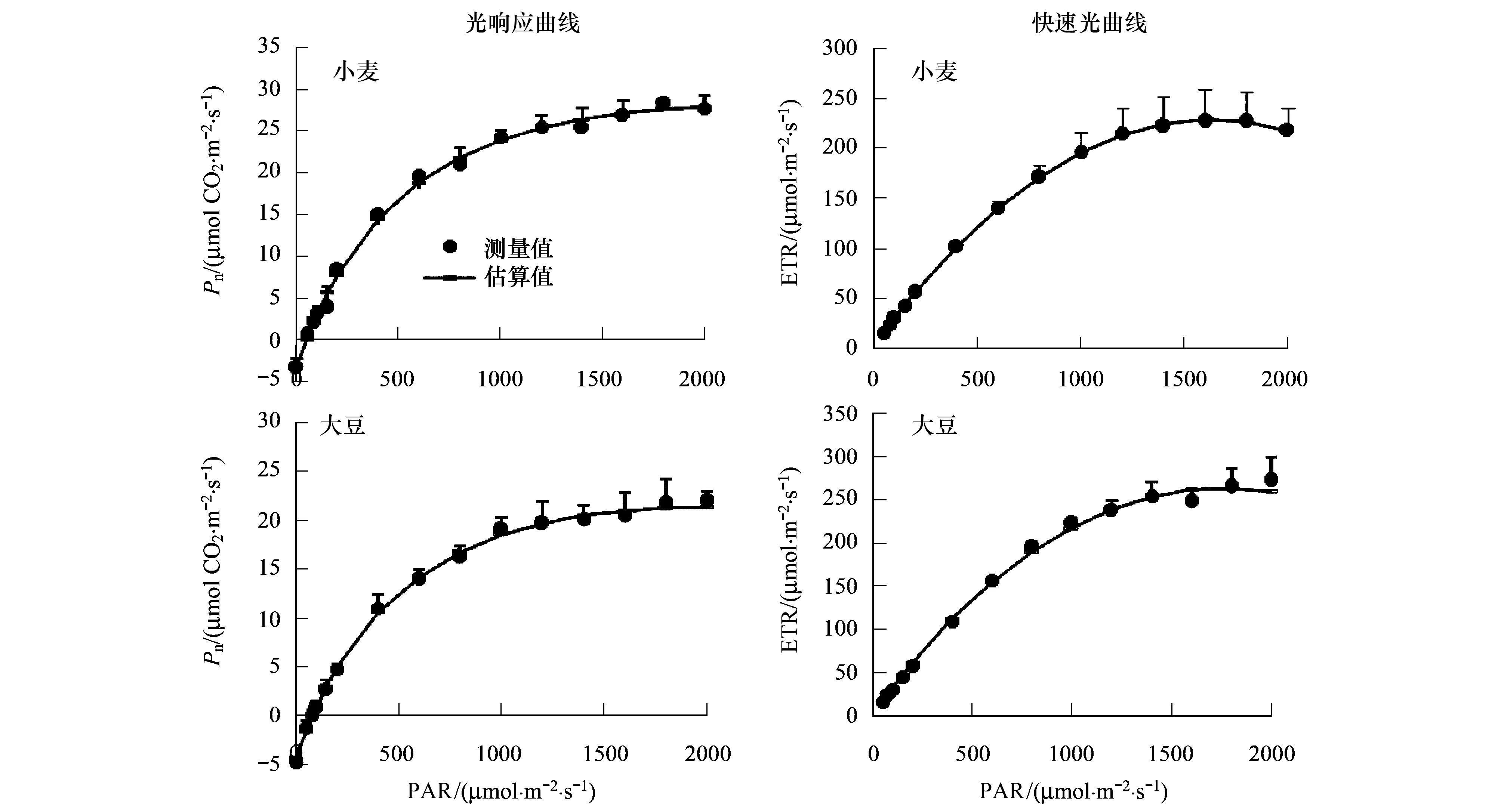
图1 21% O2浓度小麦和大豆叶片光响应曲线和快速光曲线Fig.1 Light response curve and Rapid light curve of photosynthesis for Soybean at 21%O2Pn为表观光合速率,PAR为光合有效辐射,ETR为电子传递速率
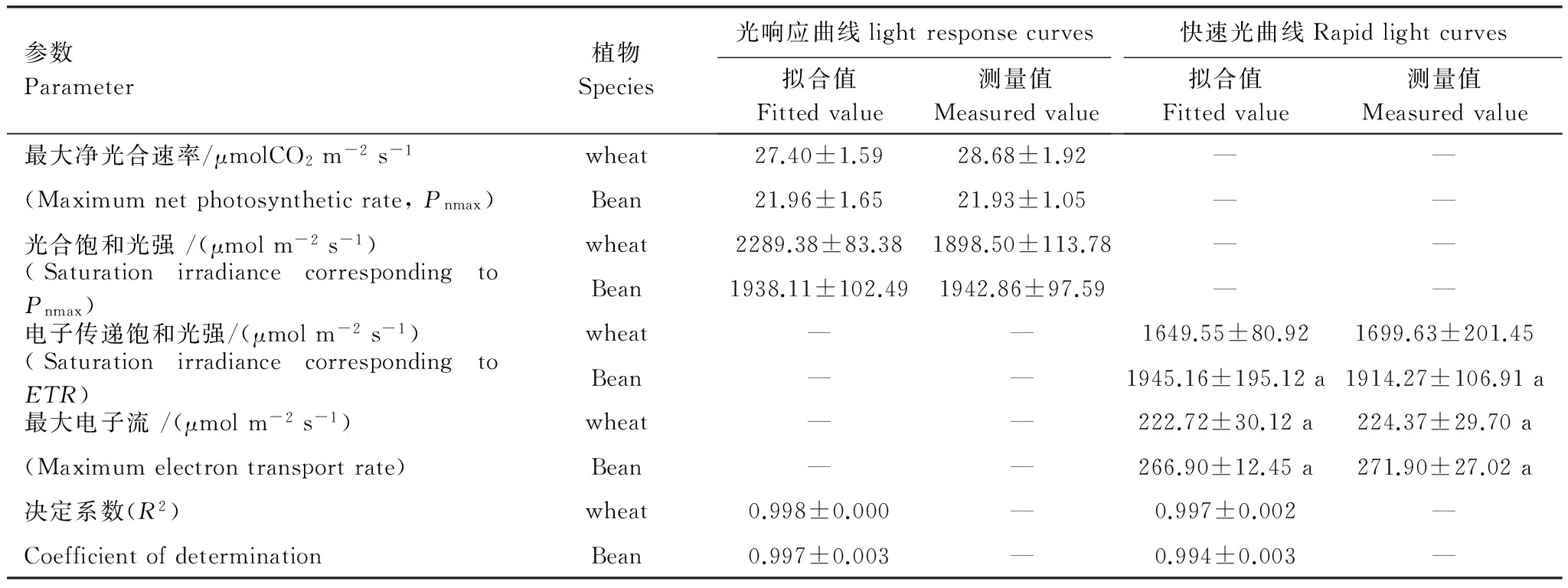
表1 21% O2浓度下,小麦和大豆叶片的光响应曲线与快速光曲线拟合参数Table 1 Fitted result of light response curves and Rapid light curves for Wheat and Soybean at 21% O2
所有的数均表示为平均值加减标准差
3.2 光下暗呼吸速率(Rd)
光下,C3植物的碳代谢主要包括碳同化、光呼吸和暗呼吸。2%O2抑制了光呼吸,0 μmol/mol CO2则又抑制了光合碳同化(如果不考虑CO2的回收利用),而此时暗呼吸可正常进行[27]。因此,有光条件下,2%O2和0 μmol/mol CO2时的表观光合速率可视为此时的光下暗呼吸速率(Rd)(图2)。由图2可知,0 μmol/mol CO2下,叶片的Rd随着光强的升高而降低:从50 到2000 μmol m-2s-1,小麦的Rd从3.416 下降到2.230 μmolCO2m-2s-1(P<0.05);而大豆的Rd则从 3.230 下降到1.861 μmol CO2m-2s-1(P<0.05)。
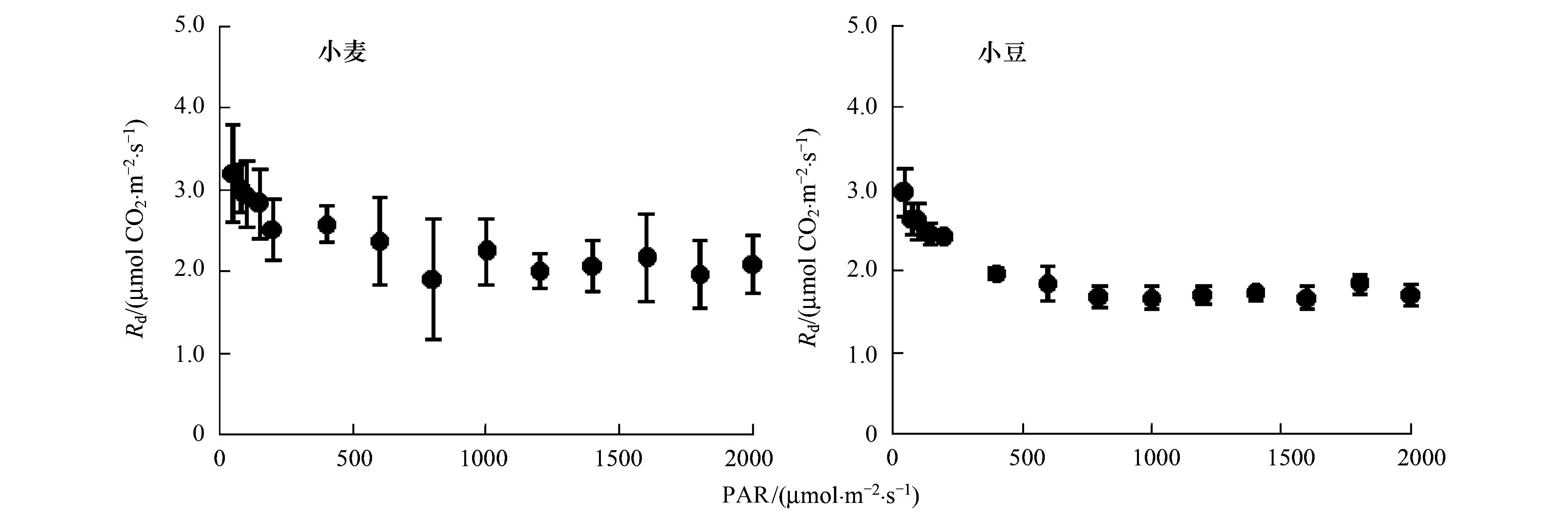
图2 在2% O2和0 μmol/mol CO2条件下,小麦和大豆不同光强下的光下暗呼吸(Rd)Fig.2 The rate of mitochondrial respiration in the light (Rd) of wheat and beans response to PAR at 2% O2 and 0 μmol/mol CO2
目前,光下暗呼吸的估算主要有基于气体交换数据测量的Kok[23]法和Laisk[24]法,也有结合叶绿素荧光参数对其进行估算的报道[28]。然而,现有的估算方法均假设光下暗呼吸速率不受光强影响,并认为光下暗呼吸速率小于其暗呼吸速率是由于光强抑制所致[29]。Tcherkez等[30]认为抑制步骤有可能发生在己糖分子进入糖酵解途径和柠檬酸循环,但该抑制机理至今尚不清楚。然而本文的试验结果表明,0 μmol/mol CO2下的Rd随着光强的变化而变化,这说明现有关于光下暗呼吸的估算方法均存在一定的缺陷。
另外,也有实验结果表明光下暗呼吸释放的CO2大部分被光合作用直接回收利用,该回收利用的部分与释放量之和接近暗呼吸速率,从而认为光强并没有抑制暗呼吸速率[31- 32]。由此可见,目前关于光下暗呼吸速率下降的原因及其准确估算均尚无定论。这将严重影响光合电子流分配及光呼吸速率(公式3)等参数的计算。
3.3 光呼吸电子流分配
在C3植物中,光呼吸是非环式光合电子流分配的主要途径[12];特别在CO2限制的情况下,光呼吸能保持相当的线性电子传递和光能利用[33]。因此,对光呼吸所分配电子流的定量研究对探讨电子流的分配显得尤为重要。比较公式(2)和(7),可以看出传统方法(8×Rp)低估了光呼吸所分配的电子流,从而低估了光呼吸对光合作用的保护作用。
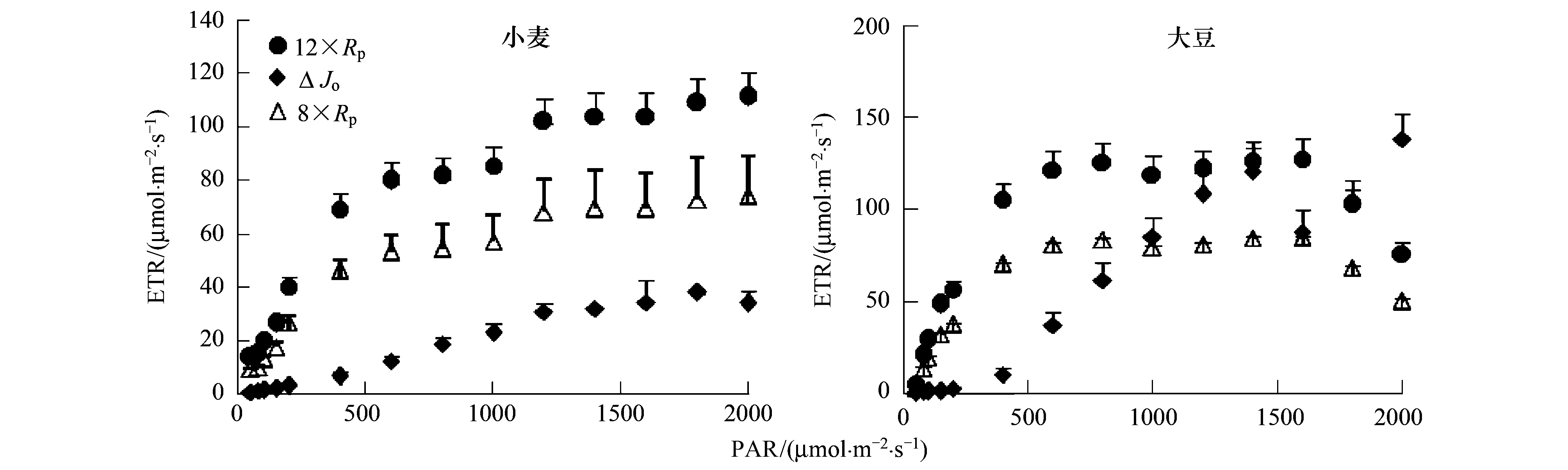
图3 两种方法对小麦和大豆不同光强下光呼吸分配电子流(ETR)的计算结果比较Fig.3 The electron allocation of photorespiration of wheat and bean by two methods12×Rp为新思路下光呼吸所分配的电子流,8×Rp为传统思路下光呼吸所分配的电子流,ΔJO为21%和2% O2下电子流之差
然而,根据光呼吸测量值计算出的光呼吸电子流(12×Rp),与两种氧浓度下的电子传递速率差值(ΔJO)存在较大差异(图3)。另外,根据公式(5)计算出的光呼吸速率(估算值)与光呼吸测量值(即低氧法测量的光合速率差值)也存在较大差异:不同光强下小麦的光呼吸测量值显著高于其估算值(P<0.05);而大豆的光呼吸测量值在较低光强(<1000 μmol m-2s-1)下大于其估算值,在较高光强(≥1000 μmol m-2s-1)下则小于其估算值(图4)。综合图3和图4的试验结果,推测其原因是由于相对电子传递速率和绝对电子传递速率之间的差异造成。
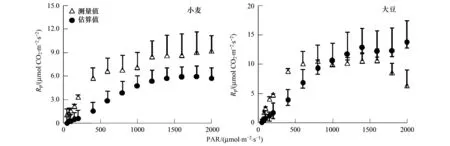
图4 传统方法对小麦和大豆光呼吸速率(Rp)的估算结果(估算值)与低氧法测量值之间的比较Fig.4 Comparisons of photorespiration rate (Rp) of wheat and bean between estimated value and measured value
传统仪器,如Li- 6400给出的电子传递速率是基于PAR拟合的(公式1)。PAR通常指400—700 nm的范围,以μmol photons s-1m-2为单位[34]。Rappaport等[35]认为该光强单位很少有实际的实验意义,因为如果不知道样品的实际吸收率就无法被可靠地转换为光化学速率。因此,采用类似方法得到的是相对电子传递速率,与叶绿素含量无关,本质上是在描述PSⅡ反应中心电荷分离的相对频率,而通过气体交换参数换算而来的电子传递速率则为绝对电子传递速率。两者在数量关系上势必会存在差异。本次实验结果显示,通过气体交换算出的(12×Rp)绝对电子传递速率整体上大于Li- 6400测量出的相对电子传递速率(ΔJO),如果光呼吸CO2存在回收利用,其差值还会更大。Schreiber等[36]以藻类为例的研究结果也显示绝对电子传递速率远大于相对电子传递速率。
3.4 其他电子传递速率
植物的光合作用是光合能量和底物相互偶联的氧化还原反应[4]。光合电子流主要用于碳同化和光呼吸外,其他途径分配的电子流是否为常数或者可以忽略目前尚存在争议[2,22]。Edwards等[37]认为氮代谢所需的能量非常小,而Turpin等[38]认为植物的氮同化过程对ATP和NADPH 的需求量要远远大于CO2的同化过程对它们的需求量。迄今为止,尚没有建立一种绝对有效的定量方法来分析用于其他途径的电子流分配。
总之,传统计算电子流分配的方法主要存在以下问题:(1)低估了光呼吸每释放一个CO2分子所消耗的电子数;(2)混淆了相对电子传递速率和绝对电子传递速率;(3)忽略了除碳同化和光呼吸外的其他电子流分配途径;(4)难以准确获取光下暗呼吸速率值;另外,还存在气体交换和叶绿素荧光的发生部位不一[39]、光合速率与电子传递速率并非完全同步等问题均影响基于气体交换和荧光同步测量对光合电子流分配的准确估算。因此,植物光合电子流分配的准确估算尚需进一步研究。
[1] Logan B A, Demmig-Adams B, Adams WW Ⅲ, Grace S C. Antioxidants and xanthopyll cycle-dependent energy dissipation inCucurbitapepoL. andVincamajorL. allimated to four growth PPFDs in the field. Journal of Experimental Botany, 1998, 49(328): 1869- 1879.
[2] Robinson J M. Does O2photoreduction occur within chloroplasts in vivo? Physiologia Plantarum, 1988, 72(3): 666- 680.
[3] Huppe H C, Turpin D H. Interaction of carbon and nitrogen metabolism in plant and algal cells. Annual Review of Plant Physiology and Plant Molecular Biology, 1994, 45(1): 577- 607.
[4] 林植芳, 彭长连, 孙梓健, 林桂珠. 光强对4种亚热带森林植物光合电子传递向光呼吸分配的影响. 中国科学: C辑, 2000, 30(1): 72- 77.
[5] Sayed O H. Chlorophyll fluorescence as a tool in cereal crop research. Photosynthesis Research, 2003, 41(3): 321- 330.
[6] 关义新, 林葆, 凌碧莹. 光氮互作对玉米叶片光合色素及其荧光特性与能量转换的影响. 植物营养与肥料学报, 2000, 6(2): 152- 158.
[7] Genty B, Briantais J M, Baker N R. The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence. Biochimica et Biophysica Acta (BBA)- General Subjects, 1989, 990(1): 87- 92.
[8] Valentini R, Epron D, de Angelis P, Matteucci G, Dreyer E.Insituestimation of net CO2assimilation, photosynthetic electron flow and photorespiration in Tukey oak (Q.cerrisL.) leaves: diurnal cycles under different levels of water supply. Plant Cell and Environment, 1995, 18(6): 631- 640.
[9] Long S P, Bernacchi C J. Gas exchange measurements, what can they tell us about the underlying limitations to photosynthesis? Procedures and sources of error. Journal of Experimental Botany, 2003, 54(392): 2393- 2401.
[10] Yin X Y, Struik P C. Theoretical reconsiderations when estimating the mesophyll conductance to CO2diffusion in leaves of C3plants by analysis of combined gas exchange and chlorophyll fluorescence measurements. Plant Cell and Environment, 2009, 32(11): 1513- 1524.
[11] 康华靖, 陶月良, 王立新, 叶子飘. 对植物气体交换和荧光测量数据进行拟合的方法比较——以大狼把草为例. 生物物理学报, 2011, 27(10): 890- 901.
[12] Ye Z P. A new model for relationship between intensity and the rate of photosynthesis inOryzasativa. Photosynthetica, 2007, 45(4): 637- 640.
[13] Ye Z P, Yu Q. A coupled model of stomatal conductance and photosynthesis for winter wheat. Photosynthetica, 2008, 46(4): 637- 640.
[14] Epron D, Godard D, Cornic G, Genty B. Limitation of net CO2assimilation rate by internal resistances to CO2transfer in the leaves of two tree species (FagussylvaticaL. andCastaneasativaMill.). Plant, Cell and Environment, 1995, 18(1): 43- 51.
[15] Krall J P, Edward G E. Relationship between photosystem Ⅱ activity and CO2fixation in leaves. Physiologia Plantarum, 1992, 86(1): 180- 187.
[16] Ehleringer J, Pearcy R W. Variation in quantum yield for CO2uptake among C3and C4plants. Plant Physiology, 1983, 73(3): 555- 559.
[17] Major K M, Dunton K H. Variations in light-harvesting characteristics of the seagrass,Thalassiatestudinum: evidence for photoacclimation. Journal of Experimental Marine Biology and Ecology, 2002, 275(2): 173- 189.
[18] Peterson R B. Partitioning of non-cyclic photosynthetie electron transport to O2-dependent dissipative processes as probed by fluorescence and CO2exchange. Plant Physiology, 1989, 90(4): 1322- 1328.
[19] Zelitch I. Control of plant productivity by regulation of photorespiration. Bioscience, 1992, 42(7): 510- 516.
[20] Cornic G, Briantais J M. Partitioning of photosynthetic electron flow between CO2and O2reduction in a C3leaf (PhaseolusvulgarisL.) at different CO2concentrations and during drought stress. Planta, 1991, 183(2): 178- 184.
[21] Taiz I, Zeiger E. 植物生理学 (第四版). 宋纯鹏, 王学路, 译. 北京: 科学出版社, 2009: 108- 145.
[22] 康华靖, 陶月良, 王立新, 叶子飘, 李红. 玉米和高粱用于碳同化和光呼吸的电子效率估算. 作物学报, 2011, 37(11): 2039- 2045.
[23] Kok B. A critical consideration of the quantum yield ofChlorella-photosynthesis. Enzymologia, 1948, 13: 1- 56.
[24] Laisk A K. Kinetics of photosynthesis and photorespiration in C3plants. Nauka: Moscow, 1977: 76- 23.
[25] Larcher W. Physiological Plant Ecology. Berlin: Springer-Verlag, 1983: 105- 127.
[26] 李海东, 高辉远. 不同施氮量对杂交酸模叶片光合电子流分配的影响. 植物生理与分子生物学学报, 2007, 33(5): 417-424.
[27] Andersen I H, Dons C, Nilsen S, Haugsad M K. Growth, photosynthesis and photorespiration ofLemnagibba: response to variations in CO2and O2concentrations and photon flux density. Photosynthesis Research, 1985, 6(1): 87- 96
[28] Yin X Y, Sun Z P, Struik P C, Gu J F. Evaluating a new method to estimate the rate of leaf respiration in the light by analysis of combined gas exchange and chlorophyll fluorescence measurements. Journal of Experimental Botany, 2011, 62(10): 3489- 3499.
[29] Zou D H, Gao K S, Xiao J R. Dark respiration in the light and in darkness of three marine macroalgal species grown under ambient and elevated CO2concentrations. Acta Oceanologica Sinica, 2011, 30(1): 106- 112.
[30] Tcherkez G, Cornic G, Bligny R, Gout E, Ghashghaie J.Invivorespiratory metabolism of illuminated leaves. Plant Physiology, 2005, 138(3): 1596- 1606.
[31] Loreto F, Velikova V B, di Marco G. Respiration in the light measured by12CO2emission in13CO2atmosphere in maize leaves. Australian Journal of Plant Physiology, 2001, 28(11): 1103- 1108.
[32] Pinelli P, Loreto F.12CO2emission from different metabolic pathways measured in illustrated and darkened C3and C4leaves at low, atmospheric and elevated CO2concentration. Journal of Experimental Botany, 2003, 54(388): 1761- 1769.
[33] Kozaki A, Takeba G. Photorespiration protects C3 plants from photooxidation. Nature, 1996, 384(6609): 557- 560.
[34] Sakshaug E, Bricaud A, Dandonneau Y, Falkowski P G, Kiefer D A, Legendre L, Morel A, Parslow J, Takahashi M. Parameters of photosynthesis: definitions, theory and interpretation of results. Journal of Plankton Research, 1997, 19(11): 1637- 1670.
[35] Rappaport F, Béal D, Joliot A, Joliot P. On the advantage of using green light to study fluorescence yield changes in leaves. Biochimica et Biophysica Acta (BBA) - Bioenergetics, 2007, 1767(1): 56- 65.
[36] Schreiber U, Klughammer C, Kolbowski J. High-end chlorophyll fluorescence analysis with the MULTI-COLOR -PAM. I. Various light qualities and their applications. PAM Application Notes, 2011, 1: 1- 19.
[37] Edwards G E, Baker N R. Can CO2assimilation in maize leaves be predicted accurately from chlorophyll fluorescence analysis?. Photosynthesis Research, 1993, 37(2): 89- 92.
[38] Turpin D H, Bruce D. Regulation of photosynthetic light harvesting by nitrogen assimilation in the green algaSelenastrumminutum. FEBS Letters, 1990, 263(1): 99- 103.
[39] Riichi O, Douwstra P, Fujita T, Chow W S, Terashima I. Intra-leaf gradients of photoinhibition induced by different color lights: implications for the dual mechanisms of photoinhibition and for the application of conventional chlorophyll fluorometers. New Phytologist, 2011, 191(1): 146- 159.
Discussion on simultaneous measurements of leaf gas exchange and chlorophyll fluorescence for estimating photosynthetic electron allocation
KANG Huajing1,2,3,4, LI Hong4, TAO Yueliang5, ZHANG Haili4, QUAN Wei4, OUYANG Zhu1,2,3,*
1KeyLab.ofEcosystemNetworkObservationandModelingInstituteofGeographicSciencesandNaturalResourcesResearchChineseAcademyofSciences,Beijing100101,China2YuchengComprehensiveExp.StationChinaAcademyofScience,Beijing100101,China3ChinaGraduatesUniv.ofChineseAcademyofSciences,Beijing100049,China4WenzhouVocational&TechnicalCollege,Wenzhou325006,China5CollegeofLife&EnvironmentalScience,WenzhouUniversity,Wenzhou325026,China
The thylakoid electron (e-) transport chain in plant chloroplasts is pivotal in coordinating the fluctuating supply of absorbed light energy with the varying demands of the photosynthetic metabolism. Photosynthetic electron allocation plays a key role in regulation of the photosynthetic metabolic processes. However, according to the biochemical process, there are some deficiencies in the current method: (1) the electron number required for one oxygenation cycle was underestimated; (2) the relative electron transport rate and the absolute electron transport rate were confused; (3) some electronsviaPSⅡ were used to CO2assimilation and photorespiration, whereas others associated with electron-consuming processes (e.g. O2acceptor cycle or water-water cycle) were ignored; (4) mitochondrial respiration in the light (Rd) was difficult to obtain, which led to inaccurate estimation of carboxylative reaction electron flow (JC) and photorespiration rate (Rp). Simultaneous measurements of leaf gas exchange and chlorophyll fluorescence for wheat and bean were measured in this study. The results revealed that the electron transport rate and CO2assimilation synchronously reached the maximum values through fitting the rapid light curves and light response curve of plant photosynthesis in bean, but not in wheat. It′s concluded that the difference seemed to be attributed to assimilation product output pattern. The difference of the electron allocations between the calculated values from photorespiration rate (12×Rp) and the measured ones (ΔJO), and the difference of photorespiration rate between the estimation by traditional method (Eq.5) and the measurement, were all demonstrated that the difference between the relative electron transport rate and absolute electron transport rate.
gas exchange; fluorescence; electron allocation; carbon assimilation; photorespiration; mitochondrial respiration in the light
国家高技术研究发展计划(863计划)项目(2013AA102903); 中国科学院地理科学与资源研究所“一三五”战略科技计划项目(2012ZD004); 浙江省教育厅项目(Y201327619)
2013- 04- 22;
日期:2014- 04- 03
10.5846/stxb201304220774
*通讯作者Corresponding author.E-mail: ouyz@igsnrr.ac.cn
康华靖, 李红, 陶月良, 张海利,权伟, 欧阳竹.气体交换与荧光同步测量估算植物光合电子流的分配.生态学报,2015,35(4):1217- 1224.
Kang H J, Li H, Tao Y L, Zhang H L, Quan W, Ouyang Z.Discussion on simultaneous measurements of leaf gas exchange and chlorophyll fluorescence for estimating photosynthetic electron allocation .Acta Ecologica Sinica,2015,35(4):1217- 1224.

