中国亚洲玉米螟发育历期的地理变异
涂小云,夏勤雯,陈 超,何海敏,薛芳森,*
1. 江西师范大学生命科学学院, 南昌 330022 2. 江西农业大学昆虫研究所, 南昌 330045
中国亚洲玉米螟发育历期的地理变异
涂小云1,2,夏勤雯2,陈 超2,何海敏2,薛芳森2,*
1. 江西师范大学生命科学学院, 南昌 330022 2. 江西农业大学昆虫研究所, 南昌 330045
广布种昆虫可调节其生活史以适应栖息地的条件变化,如可以通过调节自身的生长发育和繁殖期,使其发生与栖息地的物候(如食料、气温和降雨等)同步,这对昆虫在栖息地的繁衍具有十分重要的意义。亚洲玉米螟Ostriniafurnacalis为玉米主要害虫,在中国从南到北都有分布,栖息地气候也不同,不同地理种群生活史发生了分化,如化性、临界光周期、滞育后羽化时间、体重和体型、繁殖力和抗寒力等均不同。然而该虫发育历期的地理变异尚未见系统报道。为此,详细比较了来自5个亚洲玉米螟不同地理种群即广西阳朔(YS)、江西南昌(NC)、山东泰安(TA)、河北廊坊(LF)和黑龙江哈尔滨(HEB)在20—31℃下卵、幼虫、蛹发育历期及其与栖息地纬度的关系。结果表明:不同温度下的不同地理种群的卵期不存在显著差异,在20、22和25℃下,卵期从南到北稍有延长,卵期与其栖息地纬度呈正相关;但在28℃下,不同地理种群的卵期基本相等,与纬度相关性不显著。在31℃下,不同地理种群的幼虫期不存在显著差异,而在其他温度下,不同地理种群的幼虫期存在显著差异;在22、25和28℃下,幼虫期与其栖息地纬度呈正相关,而在20和31℃下,幼虫期与其栖息地纬度呈负相关,在20、22和25℃下,最北的哈尔滨种群的幼虫期变幅不大,而其他4个种群的幼虫期随着温度的升高明显缩短。各地理种群20℃下的雌蛹、28℃下的雄蛹和31℃下的雌雄蛹期差异均不显著,其他雌或雄蛹期差异显著;各温度下的雌雄蛹期与其栖息地纬度存在正相关关系。这些研究结果揭示了广布种昆虫可以调节其自身发育历期以适应栖息地环境条件。
亚洲玉米螟;地理变异;发育历期;卵;幼虫;蛹
生物体在应对环境变化时形成了其内在的发育策略,广布种昆虫可调节其生活史以适应栖息地的条件变化,如可以通过调节自身的生长发育和繁殖期,使其发生与栖息地的物候(如食料、气温和降雨等)同步[1- 2],这对昆虫在栖息地的繁衍具有十分重要的意义。全发育时间(从产卵至成虫羽化)反映了卵的发育和孵化、幼虫的取食和生长及幼虫或蛹变态至成虫的速率,是环境条件如温度、可利用的食物、光周期与生理等相互作用的体现。资料表明,在相同温度下,同种昆虫高纬度和低纬度种群发育历期长短因种类不同而异。有的昆虫北方种群发育快,而南方种群发育慢,如甘蓝夜蛾Mamestrabrassica在光周期为L15:D9条件下,南方种群的幼虫期明显长于北方种群[3];中欧山松大小蠹Dendroctonusponderosae(Hopkins)[4]、黄脸油葫芦Teleogryllusemma[5]和蜜蜂Exoneurarobusta的幼蜂[6]等均是北方种群发育更快;蟋蟀Dianemobiusnigrofascia若虫的发育历期由南到北逐渐缩短[5]。而有的昆虫北方种群发育却慢,发育历期长于南方种群。如一化性蟋蟀modicogryllussiamensis若虫期明显长于二化性的[7- 8],舞毒蛾Lymantriadispar北方种群的蛹期亦长于南方种群[9]。草地血黑蝗Melanoplussanguinipes/devastator胚胎发育时间与采集地年平均温度呈正相关[10],而年平均温度显然与纬度有关。尚有昆虫的发育历期与栖息地经度有关,如蚱蜢Romaleamicroptera从孵化至4龄的发育历期由西到东逐渐延长[11]。更多昆虫发育历期虽存在地理变异,但与栖息地纬度无相关性或相关性不明确,如不同种类的果蝇Drosophila[12]、大眼长蝽Geocorispunctipes[13]、普通草蛉Chrysoperlacarnea[14]、莎草粘虫Spodopteraexempta[15]、蟋蟀Dianemobiusnigrofasciatus[5]和小红蚁Myrmicarubr[16]等。还有些昆虫发育历期的地理种群间差异会随实验条件下饲养的时间延长而减小,如李锦华将棉铃虫Heliothisarmigera(Hübner)安阳种群和四川种群放在相同条件下饲养,两个种群的幼虫期和蛹期第一代差异显著,第二、三代差异不显著[17]。这些研究结果揭示了昆虫的发育历期地理变异的不同模式,也反映了昆虫生活史对策的多样性。
亚洲玉米螟Ostriniafurnacalis(Guenée)是中国玉米的主要害虫,分布广,南自海南三亚,北至黑龙江的黑河均有分布,分布区跨越的纬度很大,地理环境差异也很大。对亚洲玉米螟不同地理种群生活史特性的研究表明,该虫的临界光周期[18- 23]、越冬幼虫复苏后的发育历期[24- 28]、化性(年发生的世代数)和幼虫的抗寒力[29]、体重和体型[30]、繁殖力[31]、暗期干扰的滞育反应[32]等特性均发生了相应的地理变异。不同化性亚洲玉米螟的有效积温、发育起点温度和各虫态发育历期也有些报道[22, 25, 33- 35],但主要局限于北方种群。本实验较系统比较了5个不同地理种群亚洲玉米螟在不同温度下的各虫态的发育历期,旨在探明亚洲玉米螟发育历期地理变异的特点,以期为不同地区准确预测预报亚洲玉米螟的发生提供参考,也为深入了解昆虫生活史的进化提供基础资料。
1 材料与方法
1.1 供试虫源
亚洲玉米螟分别于2010年6—7月采自广西阳朔、江西南昌、山东泰安、河北廊坊和黑龙江哈尔滨玉米地,前四个采集地采集的虫源主要为大龄幼虫或蛹,哈尔滨采集的虫源为越冬代成虫。采集地经纬度见表1。采集虫源在人工气候箱(LRH- 250-GS, 广东医疗器械厂)中(28±1)℃、RH (75±2)%、光周期L16∶D8条件下用人工饲料[36]饲养,供实验用。
种群代码为采集地汉语拼音的缩写
1.2 卵发育历期的测定
将5个地理种群的室内第1代成虫置于保鲜袋中用10%蔗糖水饲喂、产卵,收集当天卵块置于培养皿中,用湿滤纸保湿。观察并记录孵化时间。温度设置20、22、25和28℃,光周期为L16∶D8。每种群测定的卵块数不少于10个。
1.3 幼虫和蛹发育历期的测定
将5个地理种群当日孵化的幼虫(室内繁殖的第1代)接入透明的圆形塑料盒(直径12 cm,高15 cm) 中用人工饲料饲养,15d后(约4龄),转入24孔板中单头饲养,观察其化蛹、羽化,逐个记录化蛹和羽化时间。温度设置20、22、25、28和31℃,光周期设置L16∶D8。每处理接虫两盒,每盒不少于50头。
1.4 数据统计与分析
实验数据采用SPSS13.0数据处理系统进行分析。用one-way ANOVA进行方差分析,结果用平均值±标准差(mean ±SD)表示,线性回归用Linear-regression。
2 结果
2.1 不同地理种群亚洲玉米螟卵发育历期的地理变异
不同地理种群卵的发育历期见表2。由表2可知,同一温度下,不同地理种群卵的发育历期差异不显著(在20℃下:F=2.224, df=4,49,P﹥0. 05;在22℃下:F=12.178,df=4, 55,P﹥0. 05;在25℃下:F=1.435,df=4, 64,P﹥0. 05;在28℃下:F=0.781,df=4, 64,P﹥0. 05 )。
在20、22和25℃下,卵期从南到北稍有延长,与栖息地纬度间存在着显著的正相关关系(P<0. 01);但在28℃下,不同地理种群的卵期基本相等,与栖息地纬度间存在弱正相关关系(P﹥0. 05 ) (图1)。

表2 不同地理种群亚洲玉米螟卵期Table 2 Egg duration in different geographic populations of Ostrinia furnacalis
括号中为测量样本数; 表中数据为平均值±标准差, 同一行数据后不同字母表示差异显著(Duncan多重比较,P< 0.05)

图1 亚洲玉米螟卵发育历期的地理变异Fig.1 Geographic variation in duration of egg of Ostrinia furnacalis
2.2 不同地理种群亚洲玉米螟幼虫期发育历期的地理变异
不同地理种群不同温度下幼虫期见表3。在20、22、25和28℃下,雌雄幼虫期均差异显著 (在20℃下雌幼虫:F=7.834, df=4, 220,P<0.05;雄幼虫:F=3.490, df=4, 137,P<0.01;在22℃下雌幼虫:F=52.275, df=4, 227,P<0.05;雄幼虫:F=34.415, df=4, 178,P<0.05; 在25℃下雌幼虫:F=89.539, df=4, 352,P<0.05;雄幼虫:F=74.876, df=4, 281,P<0.05;在28℃下雌幼虫:F=10.070, df=4, 382,P<0.05;雄幼虫:F=7.372, df=4, 220,P<0.05)。在31℃下,不同地理种群雌雄幼虫期差异均不显著 (雌幼虫:F=0.283, df=4, 318,P> 0.05;雄幼虫:F=0.468, df=4, 259,P> 0.05)。有趣的是,在20℃下,幼虫期与其栖息地纬度存在弱负相关关系,31℃下雄虫幼虫期也显示相似的结果(图2)。在22、25和28℃下,幼虫期与其栖息地纬度呈正相关(图2)。还值得提及的是,在20、22和25℃下,最北的哈尔滨种群的幼虫期变幅不大,如雌性幼虫期分别是43.5、40.9和39.5 d;而其他4个种群的幼虫期随着温度的升高明显缩短,如阳朔雌性幼虫期分别是47.9、28.4和22.5 d,南昌雌性幼虫期分别是42.7、35.1和24.3 d,泰安雌性幼虫期分别是42.0、38.3和25.0 d。
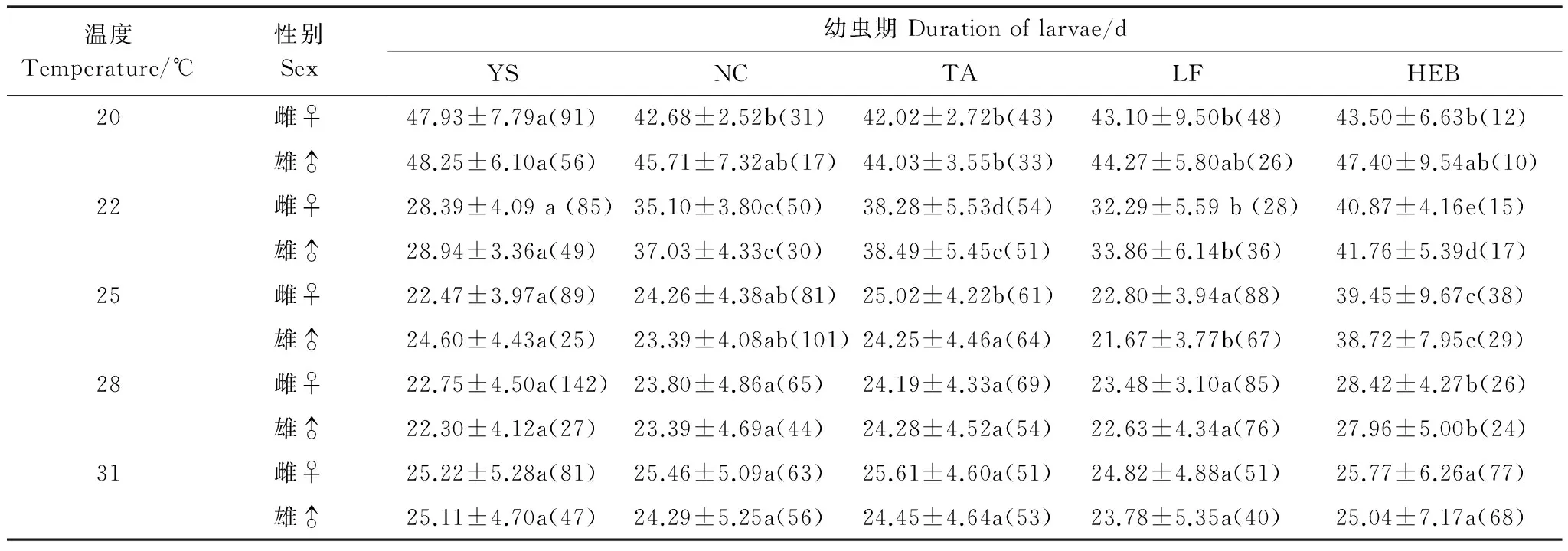
表3 不同地理种群亚洲玉米螟幼虫期Table 3 Duration of larvae in different geographic populations of Ostrinia furnacalis
2.3 不同地理种群亚洲玉米螟蛹发育历期的地理变异
不同地理种群不同温度下蛹期见表4。由表4可知,在20℃下,不同地理种群雌蛹期差异不显著,雄蛹期差异显著且随纬度上升逐渐延长 (雌蛹:F=0.405, df=4, 214,P> 0.05;雄蛹:F=4.630, df=4, 135,P<0.05)。在22和25℃下,雌雄蛹期差异显著 (在22℃下:雌蛹F=64.423, df=4, 221,P<0.05;雄蛹F=37.131, df=4, 178,P<0.05;在25℃下:雌蛹F=2.556, df=4, 341,P<0.05;雄蛹:F=2.977, df=4, 276,P<0.05)。在28和31℃下,除28℃雌虫蛹期差异显著外,其他雌雄蛹期差异均不显著 (在28℃下雌蛹:F=3.567, df=4, 321,P<0.05;雄蛹:F=2.283, df=4, 194,P>0.05;在31℃下雌蛹:F=2.152, df=4, 275,P>0.05;雄蛹:F=0.983, df=4, 242,P>0.05)。图3表明,蛹期与其栖息地纬度存在正相关关系。

表4 不同地理种群亚洲玉米螟蛹期Table 4 Duration of pupa in different geographic populations of Ostrinia furnacalis
3 讨论
前苏联的昆虫学家Danilevskii首次报道了来自3个不同地理种群(苏肯米43°N,贝尔格拉德50°N和列宁格勒60°N)梨剑纹夜蛾Acronyctarumicis蛹的发育历期是随纬度的上升而稍有延长[37]。捷克的Honěk分析了来自热带、亚热带和温带地区335种昆虫发育起点温度和有效积温[38]。结果表明,卵、幼虫和蛹的发育起点温度是热带昆虫种类最高,亚热带昆虫次之,温带昆虫最低;而各虫态需求的有效积温则相反,温带最高,其次是亚热带和热带昆虫。本实验首次揭示了来自广泛地理纬度亚洲玉米螟在不同温度下卵、幼虫和蛹发育历期的变异。在实验温度下,卵期随纬度的增大而稍有延长,与其栖息地纬度呈正相关,但不同地理种群卵期差异不显著,特别在28℃条件下,不同地理种群卵期十分接近(表2)。这一结果表明卵的发育历期基本没有受到地理变异的影响。在22、25和28℃下,不同地理种群幼虫期与采集地纬度间呈正相关关系,处理间幼虫期差异显著;而20℃下雌雄幼虫期及31℃下雄虫幼虫期与其栖息地纬度呈负相关关系,其中20℃下幼虫期差异显著,但31℃下幼虫期差异不显著(表3,图2)。这表明幼虫发育历期出现了明显的地理变异。特别值得提及的是,在20、22和25℃下,最北的哈尔滨种群的幼虫期变幅不大,而其他四个种群的幼虫期随着温度的升高明显缩短,这可能反映了亚洲玉米螟生活史对策的进化。在哈尔滨,其有效积温和作物生长季节只允许亚洲玉米螟繁殖1代。不同地理种群蛹发育历期显示了与幼虫发育历期相似的地理变异,除31℃外,不同地理种群蛹期差异显著,蛹期与其栖息地纬度呈正相关(表4,图3)。
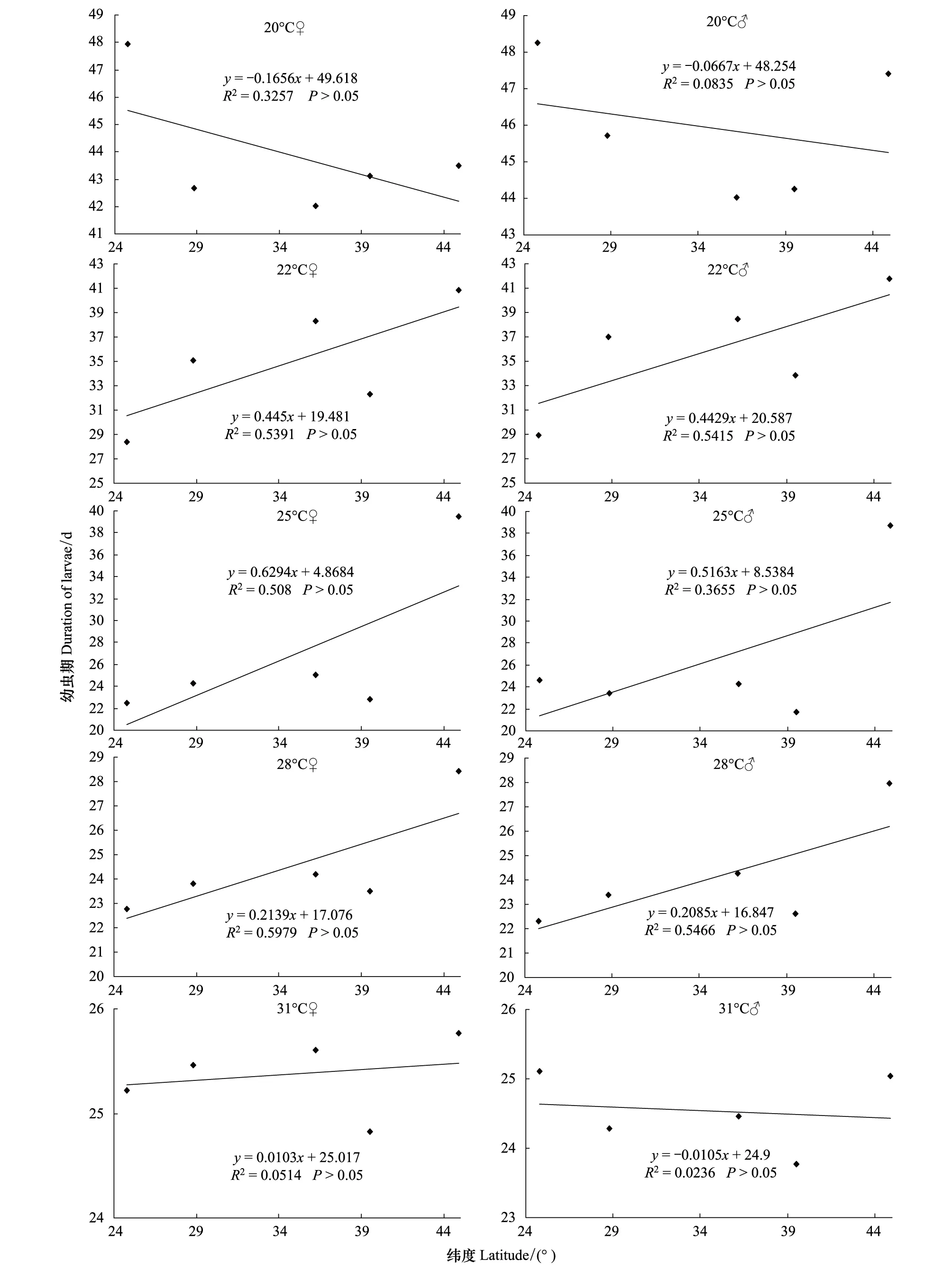
图2 亚洲玉米螟幼虫发育历期的地理变异Fig.2 Geographic variation in duration of larvae of Ostrinia furnacalis
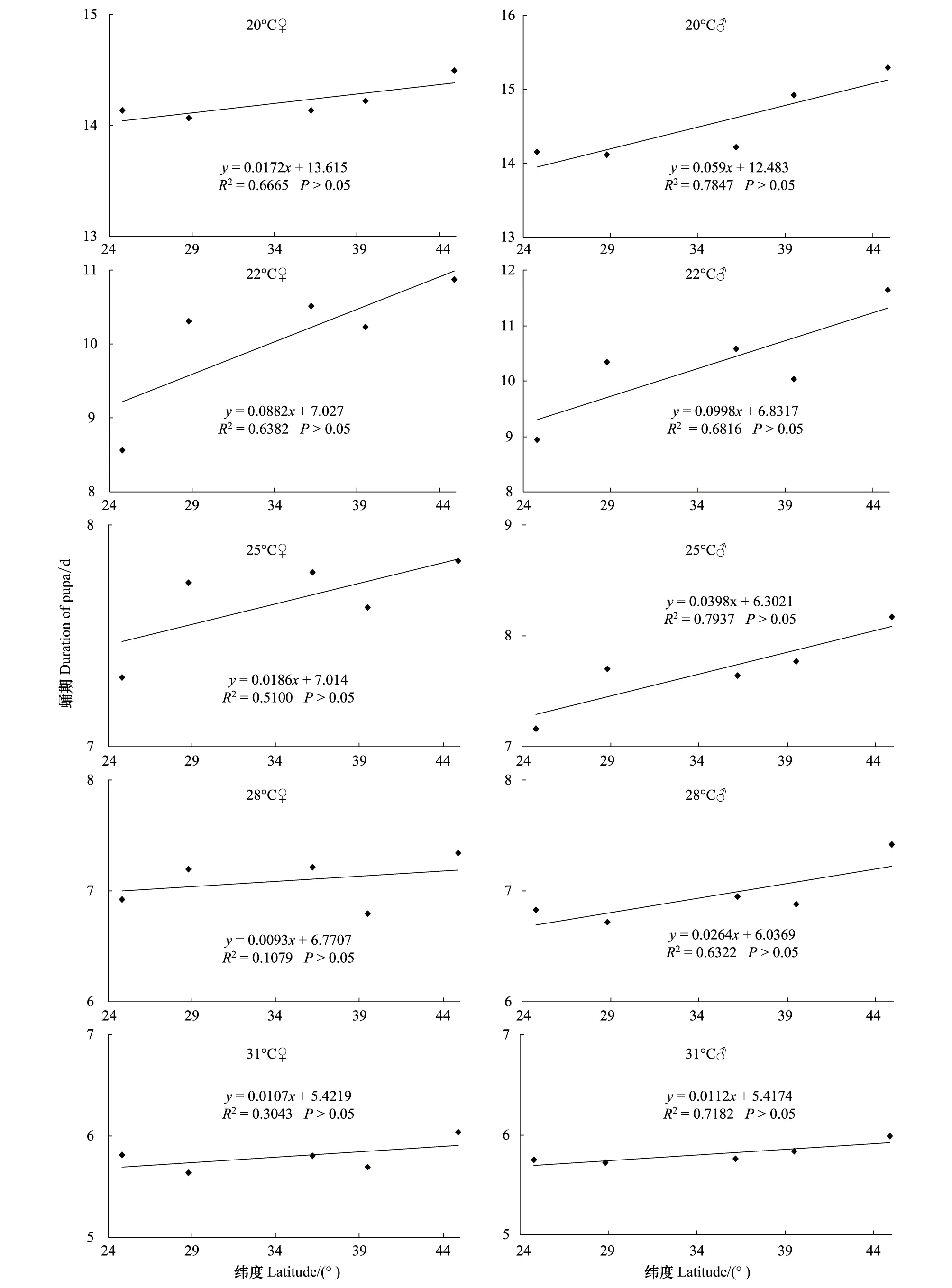
图3 亚洲玉米螟蛹发育历期的地理变异Fig.3 Geographic variation in duration of pupa of Ostrinia furnacalis
COⅠ基因和COⅡ基因分析认为亚洲玉米螟遗传分化与地理位置具有一定的相关性[39- 40]或不具有显著的相关性[41]。而亚洲玉米螟不同地理种群的遗传分化常以一些表现型的地理变异反映出来。本研究结果证实,不同地理种群亚洲玉米螟幼虫和蛹的发育历期等表现型存在显著的地理差异,但这些差异会随实验温度变化而变化,特别在高温下,发育历期的差异明显缩小。这些结果进一步揭示了即使在同一种类昆虫中,不同实验条件(如温度)下,其各个虫态发育历期的地理变异也可能不同。
[1] Tauber C A, Tauber M J. Insect seasonal cycles: genetics and evolution. Annual Review of Ecology and Systematics, 1981, 12: 281- 308.
[2] Tauber M J, Tauber C A, Masaki S. Seasonal Adaptation of Insects. New York: Oxford University Press, 1986.
[3] Masaki S. Geographic adaptation in the seasonal life cycle ofMamestrabrassice(Linné) (Lepidoptera: Noctuidae). Bulletin of Faculty of Agricultrual Hirosaki University, 1968, 14: 16- 26.
[4] Bentz B J, Logan J A, Vandygriff J C. Latitudinal variation inDendroctonusponderosae(Coleoptera: Scolytidae) development time and adult size. The Canadian Entomologist, 2001, 133(3): 375- 387.
[5] Masaki S. Geographical variation of life cycle in crickets (Ensifera: Grylloidea). European Journal of Entomology, 1996, 93: 281- 302.
[6] Cronin A L, Schwarz M P. Latitudinal variation in the life cycle of allodapine bees (Hymenoptera: Apidae). Canadian Journal of Zoology, 1999, 77(6): 857- 864.
[7] Taniguchi N, Tomioka K. Duration of development and number of nymphal instars are differentially regulated by photoperiod in the cricketModicogryllussiamensis(Orthoptera: Gryllidae). European Journal of Entomology, 2003, 100(2): 275- 281.
[8] Tanaka S, Arai T, Tanaka K. Nymphal development, diapause and cold-hardiness in a nymph-overwintering cricket. Entomological Science, 1999, 2: 173- 183.
[10] Dingle H, Mousseau T A. Geographic variation in embryonic development time and stage of diapause in grasshopper. Oecologia, 1994, 97(2): 179- 185.
[11] Jannot J E, Brinton J, Kocot K, Akman O, Juliano S A. Ontogenetic mechanisms underlying a geographic size cline in a grasshopper,Romaleamicroptera. Annals of the Entomological Society of America, 2009, 102(3): 467- 475.
[12] van der Linde K, Sevenster J G. Local adaptation of developmental time and starvation resistance in eightDrosophilaspecies of the Philippines. Biological Journal of the Linnean Society, 2006, 87(1): 115- 125.
[13] Ruberson J R, Yeargan K V, Newton B L. Variation in diapause responses between geographic populations of the predatorGeocorispunctipes(Heteroptera: Geocoridae). Annals of the Entomological Society of America, 2001, 94(1): 116- 122.
[14] Chang Y F, Tauber M J, Tauber C A, Nyrop J P. Interpopulation variation inChrysoperlacarneareproduction: implications for mass-rearing and storage. Entomologia Experimentalis et Applicata, 2000, 95(3): 293- 302.
[15] Wilson K, Gatehouse A G. Seasonal and geographical variation in the migratory potential of outbreak populations of the African armyworm moth,Spodopteraexempta. Journal of Animal Ecology, 1993, 62(1): 169- 181.
[16] Kipyatkov V, Lopatina E, Imamgaliva A. Duration and thermal reaction norms of development are significantly different in winter and summer brood pupae of the antsMyrmicarubraLinnaeus, 1758 andM.ruginodisNylander, 1846(Hymenoptera: Formicidae). Myrmecologische Nachrichten, 2005, 7: 69- 76.
[17] 李锦华. 不同地理种群棉铃虫饲养比较. 昆虫知识, 1982, 21(4): 7- 8.
[18] 杜正文, 蔡蔚琦. 玉米螟在江苏光周期的反应初报. 昆虫学报, 1964, 13(1): 129- 132.
[19] 王承纶, 张荣, 桂承明, 王蕴生. 亚洲玉米螟生物学特性研究——Ⅰ. 光周期反应对玉米螟发育的关系. 吉林农业科学, 1980, (3): 53- 58.
[20] 熊继文, 蒙黔英. 亚洲玉米螟贵阳种群的滞育及其解除的初步研究. 贵州农学院学报, 1984, (2): 50- 59.
[21] 沈荣武, 薛芳森, 朱杏芬. 玉米螟化性及田间滞育发生时间的研究. 江西植保, 1988, (1): 18- 19.
[22] 鲁新, 李建平, 王蕴生. 亚洲玉米螟化性类型的初步研究. 玉米科学, 1995, 3(1): 75- 78.
[23] Xia Q W, Chen C, Tu X Y, Yang H Z, Xue F S. Inheritance of photoperiodic induction of larval diapause in the Asian corn borerOstriniafurnacalis. Physiological Entomology, 2012, 37(2): 185- 191.
[24] 鲁新, 周大荣, 李建平. 亚洲玉米螟越冬幼虫化性与复苏后发育历期的关系. 玉米科学, 1998, (增刊): 100- 102.
[25] 鲁新, 周大荣. 吉林省亚洲玉米螟化性类型与其发育历期的关系. 植物保护学报, 1999, 26(1): 1- 6.
[26] 马瑞, 钱海涛, 董辉, 夏新, 丛斌. 不同地理种群亚洲玉米螟越冬幼虫复苏后的发育历期研究. 湖北农业科学, 2008, 47(5): 541- 543.
[27] 陈曦, 吴尊曌, 董辉, 丛斌. 3地亚洲玉米螟越冬幼虫化性与复苏后发育历期的关系. 江苏农业科学, 2009, (2): 114- 115.
[28] 鲁新, 刘宏伟, 汪洋洲, 丁岩, 张国红, 李丽娟. 亚洲玉米螟化型的主要特性及其遗传稳定性. 植物保护学报, 2009, 36(2): 183- 184.
[29] 刘宁, 文丽萍, 何康来, 王振营, 赵廷昌. 不同地理种群亚洲玉米螟抗寒力研究. 植物保护学报, 2005, 32(2): 163- 168.
[30] 涂小云, 夏勤雯, 陈超, 陈元生, 匡先钜, 薛芳森. 亚洲玉米螟体重和体型的地理变异. 昆虫学报, 2011, 54(2): 143- 148.
[31] 涂小云, 陈元生, 夏勤雯, 陈超, 匡先钜, 薛芳森. 亚洲玉米螟成虫寿命与繁殖力的地理差异. 生态学报, 2012, 32(13): 4160- 4165.
[32] 涂小云, 陈元生, 夏勤雯, 陈超, 匡先钜, 薛芳森. 亚洲玉米螟两个不同地理种群对暗期干扰的滞育应. 昆虫学报, 2011, 54(8): 943- 948.
[33] 鲁新, 田志来, 张国红, 李丽娟. 不同化性亚洲玉米螟有效积温和成虫飞翔能力的比较. 植物保护学报, 2005, 32(3): 333- 334.
[34] 夏新, 丛斌, 宋立秋, 刘洪敏. 不同地理种群和不同化性亚洲玉米螟的有效积温和存活率的研究. 安徽农业科学, 2007, 35(19): 5795, 5797.
[35] 王桂清, 忻亦芬. 沈阳地区不同化性亚洲玉米螟历期和有效积温的研究. 沈阳农业大学学报, 2000, 31(5): 444- 447.
[36] 乔利, 郑坚武, 成卫宁, 李怡萍. 不同饲料配方对亚洲玉米螟生长发育和繁殖的影响. 西北农林科技大学学报: 自然科学版, 2008, 36(5): 109- 112.
[37] Danilevskii A S. Photoperiodism and Seasonal Development of Insect. Edinburgh and London: Oliver and Boyd, 1965.
[38] Honěk A. Geographical variation in thermal requirements for insect development. European Journal of Entomology, 1996, 93(3): 303- 312.
[39] 黄丽莉, 阙海勇, 陈超, 匡先钜, 薛芳森. 亚洲玉米螟不同地理种群基于COⅠ基因序列初步分析. 应用昆虫学报, 2012, 49(6): 1508- 1512.
[40] 杨瑞生, 王振营, 何康来, 白树雄. 秆野螟属部分种的线粒体COⅡ基因序列分析及其分子系统学(鳞翅目: 草螟科). 昆虫学报, 2008, 51(2): 182- 189.
[41] 李菁, 张颖, 王振营, 何康来, 王强. 基于线粒体DNA COⅡ基因的亚洲玉米螟中国不同地理种群遗传分化及基因流研究. 昆虫学报, 2010, 53(10): 1135- 1143.
Geographic variation in developmental duration of the Asian corn borer,Ostriniafurnacalis(Guenée) (Lepidoptera: Crambidae) in China
TU Xiaoyun1, 2, XIA Qinwen2, CHEN Chao2, HE Haimin2, XUE Fangsen2,*
1CollegeofLifeSciences,JiangxiNormalUniversity,Nanchang330022,China2InstituteofEntomology,JiangxiAgricultureUniversity,Nanchang330045,China
Insect species with broad geographic distributions can phenologically adjust their life cycles to adapt to different habitats, for example by altering their growth, development, and reproduction periods to better match their emergence times with local conditions, such as food availability, optimum temperature, rainfall, etc.). These adjustments are very important for such widespread species to be able to reproduce in different habitats. The Asian corn borer,Ostriniafurnacalis(Guenée) (Lepidoptera: Crambidae) is a major pest insect ofZeamaysL., that poses a serious economic threat to corn production in China. Its distribution ranges from north to south in China, through Southeast Asia, and into Australia, and the pest has recently been found in isolated regions of the United States. Because of its wide distribution, the Asian corn borer encounters great variation in climatic conditions across its range and exhibits considerable diversity in its life-history parameters among geographic populations. Populations differ distinctly in voltinism, critical photoperiod, post-diapause emergence time, body size, fecundity, and cold hardiness. However, little is known about whether the developmental duration ofO.furnacalispopulations varies with geographic origin. In the present study, we systematically investigated the developmental duration of the egg, larval, and pupal phases at five different temperatures (20, 22, 25, 28 and 31℃) using insects collected from five different populations of the Asian corn borer. Each population inhabited a different latitude: Yangshuo, Guangxi (YS, 24.8°N, 110.5°E); Nanchang, Jiangxi (NC, 28.8°N, 115.9°E); Taian, Shandong (TA, 36.2°N, 117.1°E); Langfang, Hebei (LF, 39.5°N, 116.7°E) and Haerbin, Heilongjiang (HEB, 44.9°N, 127.2°E). Although at any given temperature the duration of the egg phase did not differ significantly among populations, the length of this phase increased slightly from south to north at 20, 22, and 25℃ and had a highly significant positive correlation with the latitudinal origin of the populations at these three temperatures. However, the egg phase lasted about the same amount of time in all populations at 28℃, with no significant correlation to latitudinal origin. The duration of the larval phase was not significantly different among the five populations at 31℃, but it differed significantly at 20, 22, 25, and 28℃. The larval-phase duration had a significant positive correlation with the latitudinal origin of the populations at 22, 25, and 28℃. However, these two parameters were negatively correlated at 20 and 31℃. The duration of the larval phase varied little with temperature in the HEB population, but it decreased significantly as temperature increased in the YS, NC, TA, and LF populations. The developmental durations of female pupae at 20℃, male pupae at 28℃, and all pupae at 31℃ did not differ significantly among populations, but all other pupal categories had significantly different durations among the five populations. The pupal-phase duration had a positive relationship with the latitudinal origin of the population at any given temperature. These results indicate that a single widespread species of insect may adapt to varying environmental conditions across its geographic range by altering the developmental duration of its life-history stages in different ways in each population.
Ostriniafurnacalis; geographic variation; developmental duration; egg; larva; pupa
国家自然科学基金项目(31260430);国家自然科学基金项目(31360327)
2013- 03- 26;
日期:2014- 03- 25
10.5846/stxb201303260512
*通讯作者Corresponding author.E-mail: xue_fangsen@hotmail.com
涂小云,夏勤雯,陈超,何海敏,薛芳森.中国亚洲玉米螟发育历期的地理变异.生态学报,2015,35(2):324- 332.
Tu X Y, Xia Q W, Chen C, He H M, Xue F S.Geographic variation in developmental duration of the Asian corn borer,Ostriniafurnacalis(Guenée) (Lepidoptera: Crambidae) in China.Acta Ecologica Sinica,2015,35(2):324- 332.

