氮添加对杨树人工林表层土壤微生物群落结构的影响1)
赵超 王文娟 阮宏华 葛之葳 徐长柏 曹国华
(南京林业大学,南京,210037) (江苏省东台市国营林场)
氮添加对杨树人工林表层土壤微生物群落结构的影响1)
赵超 王文娟 阮宏华 葛之葳 徐长柏 曹国华
(南京林业大学,南京,210037) (江苏省东台市国营林场)
以江苏东台沿海地区杨树人工林地为研究对象,建立野外模拟氮沉降试验样地,试验设置5个氮处理水平,分别为对照(0 kg·hm-2·a-1)、低氮(50 kg·hm-2·a-1)、中氮(100 kg·hm-2·a-1)、高氮(150 kg·hm-2·a-1)和超高氮(300 kg·hm-2·a-1)。于2012年5月开始在生长季(5—10月)每月进行施氮处理, 2013年8月和10月运用磷脂脂肪酸法分别分析了土壤微生物群落的变化特征。结果表明,施氮处理近2 a后,两个月份中的土壤微生物磷脂脂肪酸总量均显著下降,细菌、真菌中磷脂脂肪酸的量出现了不同程度的下降,真菌与细菌中磷脂脂肪酸的量之比没有显著变化。磷脂脂肪酸组成的主成分分析显示,除低氮处理样地外,其他水平施氮样地均使微生物群落结构显著变化,且超高氮处理样地变化格局具有季节差异性。
土壤微生物;氮添加;微生物群落结构;磷脂脂肪酸法;杨树人工林
We studied the effects of elevated nitrogen deposition on soil microbial community structure in poplar plantations by phospholipid fatty acid (PLFA) analysis in August and October 2013. Beginning in May 2012, we conducted a field experiment to simulate nitrogen deposition at Dongtai Forest Farm in Jiangsu Province. Nitrogen loadings were designed at five levels of N0 (control), low-N (50 kg·hm-2·a-1), mdeium-N (100 kg·hm-2·a-1), high-N (150 kg·hm-2·a-1), and ultrahigh-N (300 kg·hm-2·a-1). The total PLFAs, the PLFAs of bacteria and fungi decreased to some extent under nitrogen treatment in both months. But the ratios of fungal to bacterial PLFAs was not significantly changed. By principal component analysis (PCA) for microbial PLFAs data, microbial community structure in all nitrogen treatment sample plots were changed significantly except in the low-N. The pattern of soil microbial changes in ultrahigh-N treatmentplot was not changed in the same way between two months. The decline in total microbial PLFAs and microbial groups (bacteria, fungi) with the changes in microbial community structure had substantial impacts on the nutrient cycling within poplar forests ecosystem.
自工业革命以来,化石燃料的燃烧和人工化肥的使用等人类活动造成了活性氮化合物的大量排放,部分氮化物以NOx和NHy的形式沉降到地表,造成了氮沉降量的不断增加[1]。目前,全球大片区域的平均氮沉降量超过了10 kg·hm-2·a-1,大大超过了由自然活性氮源引起的氮沉降速率[2]。据估计,到2050年某些地区的氮沉降速率可能会增加1倍,达到50 kg·hm-2·a-1,森林生态系统的氮沉降情况尤为严峻[1]。我国已成为继欧洲和北美之后的第3大氮沉降区,1980—2010年,降雨形式的氮沉降增加了约60%,华北地区的氮沉降量甚至达到了80 kg·hm-2·a-1[3]。氮输入量一旦超过生态系统的临界阈值,将会对生态系统的结构和功能产生不同程度的影响。
近年来,大量研究表明,氮沉降增加会对植物光合作用、凋落物分解、细根生物量、土壤呼吸等森林生态系统碳氮循环过程产生影响[4-5]。土壤微生物参与生态系统的物质循环与转化,是碳氮循环过程的重要驱动力。近年来,氮沉降增加对土壤微生物影响的研究也在逐步开展[6]。大部分的研究表明,长期氮添加会使微生物生物量减少,真菌生物量减少,细菌生物量不变或略微减少[7]。氮沉降还会改变微生物结构,微生物群落中的某些真菌可能被氮素利用率更高的细菌所替代[8]。氮沉降对菌根真菌的负面影响几乎已达成了共识[9]。国内开展氮沉降的研究时间较晚,在氮沉降增加的背景下,对土壤微生物的研究大部分集中在对微生物生物量和功能多样性的研究,对特定微生物类群的研究较少[10]。
杨树生长迅速,是我国人工林产业化栽培的主要树种之一,种植总面积居世界首位。前期在对杨树人工林的研究中发现,短期(约1 a)高浓度氮添加使微生物生物量碳显著减少[11],但对特定微生物类群的生物量以及微生物群落结构的变化还不甚了解。在特定的森林生态系统中,土壤微生物群落的变化具有明显的季节波动性,受多种生态因子综合作用的影响[12]。夏季土壤温度、湿度、养分情况、微生物群落结构组成等与秋季有着较大差异,土壤微生物在夏季和秋季对氮素输入增加的响应可能不同。磷脂脂肪酸(PLFA)法是研究微生物群落常见的方法之一,通过提取微生物细胞膜中的具有指示性的特征磷脂,可不经过分离仅从一个样品中对不同微生物类群进行定量分析,得出不同微生物类群的相对丰度,从而达到间接识别微生物结构的目的[13]。本试验选择杨树人工林为对象,运用磷脂脂肪酸方法,在持续进行野外模拟氮沉降的基础上,研究夏季和秋季土壤微生物对氮沉降的响应。以期为预测在大气氮沉降持续增加的背景下,森林生态系统功能的变化提供依据。
1 研究区概况
试验样地位于江苏省东台市境内的东台林场,东台市地理位置为32°33′~32°57′N,120°07′~120°53′E。该地区属北亚热带季风气候。年平均气温14.6 ℃,无霜期220 d,年平均降水量1 059.8 mm,降水量季节分配不均,以6—9月为主,占全年降水量的60%以上。东台林场地处黄海之滨,占地面积2 000 hm2,森林覆盖率85%,分布的植被主要是人工种植的意杨(Populuseuramevicanacv. ‘I-214’)、水杉(MetaseguoiaglyptostroboidesHu et Cheng)、银杏(GinkgobilobaLinn.)、杉木(CunninghamialanceolataLamb.),灌木草本有罗布麻(ApocynumvenetumLinn.)、葎草(Humulusscandens(Lour.) Merr.)、野蔷薇(RosamultifloraThunb.)和蕨类植物等。土壤质地为沙质壤土,偏碱性。
2 材料与方法
东台林场模拟氮沉降样地建立于2012年5月,通过人工施氮的方式对日益增加的生态系统氮沉降进行模拟。从研究区具有立地条件和经营管理措施基本一致的杨树人工林(黑杨派无性系I35,PopulusdeltoidesCL‘35’)中选择9年生的杨树人工林。分别设置3个重复样地(样地面积为30 m×190 m),采用随机区组设计,每个样地设置5种施氮水平,分别记为空白对照(N0)、低氮处理(N1)、中氮处理(N2)、高氮处理(N3)、超高氮处理(N4),样方面积为25 m×30 m。每个样方之间保留10 m宽的缓冲带。
2.1 氮沉降模拟方法
在2012年5—10月,2013年5—10月期间,对样地进行施氮处理,氮量分别为N0(0 kg·hm-2·a-1)、N1(50 kg·hm-2·a-1)、N2(100 kg·hm-2·a-1)、N3(150 kg·hm-2·a-1)、N4(300 kg·hm-2·a-1),年施肥量平均分配到每月。将NH4NO3人工均匀洒入样地,再喷洒少量的水(每个样方喷洒量20 L,相当于0.027 mm降水)。为减少差异,对照样地喷洒等量的水。
2.2 样品采集与处理
于2013年8月和10月,分别在样方内随机选取8点,去除凋落物层,用土壤采样器(直径2.5 cm)采0~10 cm土层。除去植物残体和大石块等,装入塑料袋中充分混匀并密封保存于冰盒中取回。部分样品保存于4 ℃条件下,用于土壤化学性质的测定;部分样品在-20 ℃条件下冷冻保存并于两周内进行磷脂脂肪酸分析。
2.3 试验测定方法
4 ℃条件保存的土样过2 mm钢筛,经自然风干后进行土壤基本化学性质的分析。土壤含水量采用鲜土烘干法测定;土壤总有机碳、全氮采用元素分析仪(Elementar VarioEL,德国)测定;pH值采用电位法测定,V(水)∶V(比)=2.5∶1.0[14]。
磷脂脂肪酸(PLFA)方法采用修正的Blight-Dyer[15]法。取4.0 g新鲜土样,用V(氯仿)∶V(甲醇)∶V(柠檬酸)=1.0∶2.0∶0.8的缓冲液振荡提取总脂,经硅胶柱层析分离得到磷脂脂肪酸。甲脂化后,加入正十九烷脂肪酸甲酯作为内标,用气相色谱仪测定,应用SherlockMIS4.5系统分析鉴定微生物类群。不同类群微生物具有独特的磷脂脂肪酸特征谱图,土壤微生物磷脂脂肪酸总量和各类群微生物磷脂脂肪酸含量可根据内标C19:0计算得出。本研究磷脂脂肪酸命名规则采取通用的ω系统,前缀a、i和cy分别表示反式、顺式和环状支链构型[16]。
全部测得的磷脂脂肪酸含量之和用来指示微生物总生物量;选取常见的i14∶0、i15∶0、a15∶0、i16∶0、i17∶0、a17∶0、16∶1ω7c、18∶1ω7c、cy17∶0、cy19∶0用来指示细菌,其中i14∶0、i15∶0、a15∶0、i16∶0、i17∶0、a17∶0指示革兰氏阳性(G+)细菌,16∶1ω7c、18∶1ω7c、cy17∶0、cy19∶0指示革兰氏阴性(G-)细菌;18∶1ω9c、18∶2ω6,9c指示真菌;真菌与细菌中磷脂脂肪酸比用各真菌和细菌磷脂脂肪酸指示物的总量来计算[17]。16∶1ω5c用来指示丛枝菌根真菌(AMF)[18]。
2.4 数据处理
运用SPSS(v19.0)软件进行统计分析,各样地供试土壤的化学性质,微生物磷脂脂肪酸总量、细菌、真菌磷脂脂肪酸含量,以及真菌与细菌中磷脂脂肪酸量之比的数据进行单因素(one-way ANOVA)方差分析(LSD多重比较法,显著性水平设为0.05)。运用主成分分析(PCA)方法分析微生物结构变化。磷脂脂肪酸与土壤化学性质相关性分析采用Pearson检验法。
3 结果与分析
3.1 土壤化学性质
不同施氮处理的杨树人工林中,8月和10月各样地土壤主要化学性质见表1。8月和10月各施氮样地土壤总有机碳、全氮、w(C)∶w(N)没有显著变化(P>0.05)。施氮处理未对8月份土壤pH值有显著影响(P>0.05)。随着施氮水平的增加,10月份土壤pH值基本呈现出逐渐下降的趋势,但仅有超高氮处理的土壤pH值与N0和N1相比显著下降(P<0.05)。整体上,施氮处理对杨树人工林土壤总有机碳、全氮、w(C)∶w(N)、pH值影响不大,仅有个别样地的变化达到显著性水平。
3.2 微生物磷脂脂肪酸组成
供试土壤样品微生物含有的磷脂脂肪酸种类十分丰富。从8月份土壤样品中共检测到60种磷脂脂肪酸,从10月份土壤样品中共检测到71种磷脂脂肪酸,分别有29种和30种磷脂脂肪酸存在于当月所有的样品中。样品中优势磷脂脂肪酸主要由16∶0、a17∶1ω9c、18∶0、18∶1ω9c、16∶1ω5c、16∶1ω7c、18∶1ω7c和cy19∶0组成,总和占样品总磷脂脂肪酸含量的50%以上。虽然8月份土壤微生物磷脂脂肪酸种类比10月份少,但是各样地中的总量都分别超过了10月份。
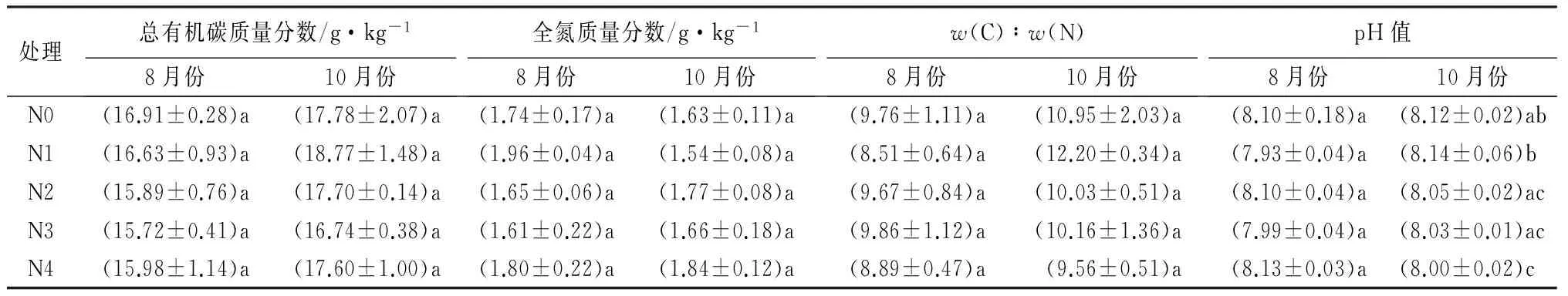
表1 不同施氮处理下土壤理化性质
注:数据为平均值±标准差;同一列不同字母表示在P<0.05水平上差异显著。
微生物磷脂脂肪酸总量能较好地反映微生物生物量水平(见表2)。在8月份,N2和N4样地与N0样地相比,磷脂脂肪酸总量显著下降(P<0.05),降幅分别为16.7%和16.9%。到了10月份,各施氮样地磷脂脂肪酸总量普遍下降,N3和N4样地达到了显著性水平(P<0.05),降幅达31.0%和31.1%。

表2 不同施肥处理下微生物磷脂脂肪酸量
注:数据为平均值±标准差;同一列不同字母表示在P<0.05水平上差异显著。
施氮处理对土壤细菌磷脂脂肪酸含量影响较大。8月份除N1样地外,其他施氮样地细菌磷脂脂肪酸含量均显著下降(P<0.05)。10月份所有施氮样地细菌磷脂脂肪酸含量均显著下降(P<0.05),排列顺序由大到小为N0、N2、N1、N3、N4。与N0样地相比,8月份N4样地真菌磷脂脂肪酸含量显著下降(P<0.05),而10月份各施氮样地真菌磷脂脂肪酸含量均显著下降(P<0.05)。在8月份,各施氮样地真菌与细菌中磷脂脂肪酸之比没有受到显著影响(P>0.05)。值得注意的是,N4与N1、N2样地相比,真菌与细菌中磷脂脂肪酸之比显著下降(P<0.05)。这说明,N4样地微生物结构与N1、N3样地相比已经发生了变化。10月份各施氮样地的真菌与细菌中磷脂脂肪酸之比没有受到显著影响(P>0.05)。
3.3 微生物磷脂脂肪酸主成分分析
为进一步分析施氮后杨树人工林土壤微生物群落结构差异,对检测出的15种典型磷脂脂肪酸进行主成分分析。在8月份土壤微生物磷脂脂肪酸组成中,第1主成分(PC1)对磷脂脂肪酸数据变异的贡献率为45.95%,第2主成分(PC2)对总磷脂脂肪酸数据变异的贡献率是26.72%,累积贡献率达到了72.67%。对PC1起主要作用的磷脂脂肪酸为18∶1ω7c、cy17∶0、cy19∶0、18∶1ω9c、16∶1ω5c,并与之成正相关关系;对PC2起主要作用的脂肪酸为i14∶0、a15∶0、i15∶0,并与之成正相关关系。在10月份土壤微生物磷脂脂肪酸组成中,第1主成分(PC1)对磷脂脂肪酸数据变异的贡献率为60.42%,第2主成分(PC2)对磷脂脂肪酸数据变异的贡献率是18.33%,累积贡献率达到了78.75%。对PC1起主要作用的磷脂脂肪酸为i14∶0、a15∶0、i16∶0、cy19∶0、18∶2ω6,9c并与之成正相关关系;对PC2起主要作用的脂肪酸为i15∶0、18∶1ω7c、16∶1ω5c,并与之成正相关关系。
8月份和10月份不同样地土壤微生物群落分布在排序空间的不同位置。8月份(见图1a),第1主成分将N0、N1与N2、N3、N4显著分开(P<0.05),第2主成分将N4与N2、N3显著分开(P<0.05)。N2、N3、N4与N0、N1相比,18∶1ω7c、cy17∶0、cy19∶0指示的G-细菌和18∶1ω9c、16∶1ω5c指示的真菌含量减少。N2、N3与N0、N1、N4相比,i14∶0、a15∶0等指示的G+细菌含量减少。10月份(见图1b),第1主成分将N0、N1与N2、N3、N4显著分开(P<0.05),而第2主成分将N0、N1与、N2、N3、N4显著分开(P<0.05),N2、N3、N4间的差异不显著(P>0.05)。这表明与N0、N1相比,N2、N3、N4微生物结构都发生了变化,且变化趋势一致。具体表现为i14∶0、a15∶0、i16∶0、i15∶0指示的G+菌,cy19∶0、18∶1ω7c指示的G-细菌,18∶2ω6,9c指示的真菌和16∶1ω5c指示的从枝菌根真菌含量减少。总体上,施氮对低氮处理微生物结构的影响不大,对其他施氮水平样地土壤微生物群落结构有显著影响。尽管8月份和10月份微生物群落可能具有不同的结构,但这两个月份的中氮、高氮处理样地和10月份超高氮处理样地微生物群落结构的变化格局相似。超高氮处理样地微生物群落结构的变化表现出了季节差异性。
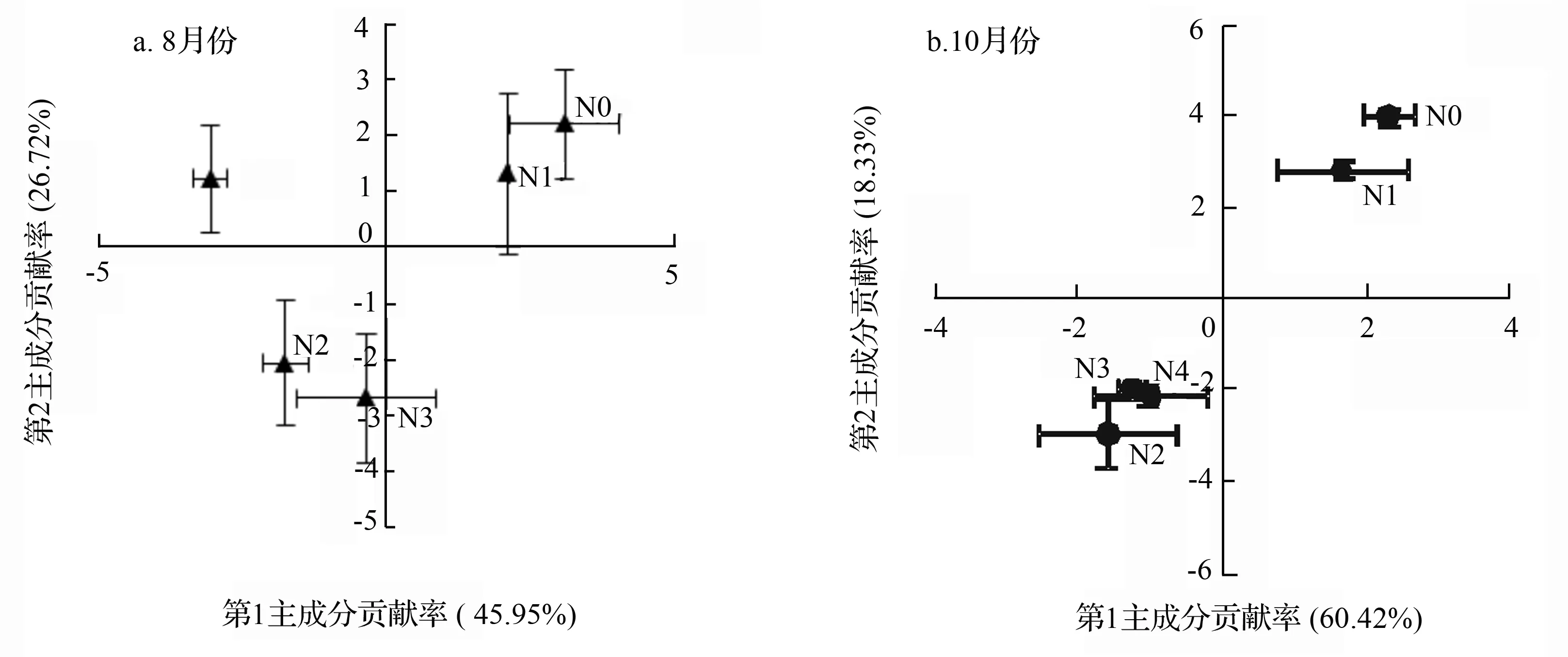
图1 不同水平氮处理微生物群落结构主成分分析
3.4 土壤化学性质与微生物磷脂脂肪酸的关系
土壤化学性质与各类群磷脂脂肪酸相关性分析见表3。在8月份,土壤磷脂脂肪酸总量与土壤pH值呈显著负相关关系(P<0.05),细菌磷脂脂肪酸含量与土壤总有机碳呈显著正相关关系(P<0.05)。在10月份,细菌与土壤pH值呈显著正相关关系(P<0.05),真菌与细菌磷脂脂肪酸比值与土壤w(C)∶w(N)呈显著负相关关系(P<0.05)。土壤总有机碳、全氮、w(C)∶w(N)、pH值综合影响了微生物群落,但在不同月份起主导作用的环境因子有所差异。

表3 土壤性质与各种微生物磷脂脂肪酸的Pearson相关分析
*表示P<0.05水平显著相关。
4 讨论与结论
土壤微生物是土壤中最具活力的部分,对土壤养分分解转化起到重要作用。本研究表明,施氮近两年后,土壤微生物磷脂脂肪酸总量,细菌中磷脂脂肪酸量、真菌中磷脂脂肪酸量出现了不同程度的下降。氮沉降增加对微生物生物量的负面影响被广泛报道。Treseder[7]综合评价了82个田间施氮试验对土壤微生物的影响,结果表明微生物生物量平均降低约15%。在Wu等[19]的研究中,模拟氮沉降使杉木人工林土壤微生物磷脂脂肪酸总量降低了21.8%,细菌与真菌中磷脂脂肪酸量也普遍下降。也有一些研究发现,氮沉降增加对土壤微生物生物量影响很小。Allison[20]等在对阿拉斯加的北方森林的研究中发现,施氮并未使微生物生物量和真菌的丰度产生显著变化。Gallo[21]等在北方温带森林中开展氮添加实验,研究表明尽管氮添加对23种主要磷脂脂肪酸中的9种有所影响,但对微生物总生物量却没有产生显著影响。
微生物对氮添加的响应与植物的生产力和碳供给密切相关。一般来说,微生物的生长是受氮限制,但当可利用的有效氮增加,土壤中可利用的碳将成为微生物的限制因素[22]。在本研究样地中,施氮使土壤细根生物量减少[23]。这意味着细根寿命很可能将会缩短,周转速率变慢,根系输入土壤中的碳减少[24]。尽管早期氮输入的增加会提高植物的生产力,增加凋落物产量,使来自地上的碳供给增加[25]。但由于本研究施氮时间较短,增加的凋落物可能还未进入到矿质土壤中。因此,土壤微生物磷脂脂肪酸总量,细菌、真菌中磷脂脂肪酸量下降很可能是因为氮添加增加了微生物的碳限制。此外,有效氮输入的增加还可能使含氮化合物与含碳化合物结合形成类黑精或者增加多酚类物质的聚合性。二者均不易分解,致使微生物可利用的碳量减少[5]。

本研究中,8月份施氮处理样地土壤微生物总磷脂脂肪酸含量下降了17%左右,而10月份则下降了30%左右。对比两个月份的细菌和真菌中磷脂脂肪酸量的变化发现,10月份细菌和真菌受到施氮的影响较大。这可能是因为受到降雨因素的影响。本研究区为北亚热带季风气候,夏季降雨量较多[11]。大量降雨导致添加的氮素流失较为严重。此外,夏季是植物生最旺盛的季节,添加到土壤表层的氮素可能较多的被林下植物吸收,从而削弱了添加的氮素对微生物群落的影响。
真菌与细菌生物量之比提供了一种能够评估微生物群落对环境变化作出响应和生态系统功能变化的度量标准,具有特定的生态学意义,近年来被广泛使用[30]。本研究结果表明,短期氮添加对土壤真菌与细菌中磷脂脂肪酸含量之比未产生显著影响,但显著影响了微生物群落结构。一般来说,长期的氮沉降增加对真菌生物量的负面影响要大于细菌,造成真菌与细菌中生物量之比下降[31]。然而也有很多类似研究未发现这种现象。Blaško等[32]在对瑞典挪威云杉林研究中发现,真菌和细菌同步下降,真菌与细菌中生物量之比没有发生显著变化,DeForest等[33]在北方阔叶林中发现,氮沉降增加使微生物生物量普遍下降,但是并未改变真菌和细菌的相对丰度。5 a后,在同样的研究样地中,Van Diepe等[34]则发现真菌与细菌中生物量之比下降了10%。可见,施氮时间的长短是微生物能否做出响应的重要因素。值得注意的是,真菌与细菌中磷脂脂肪酸量之比变化很小并不意味着微生物结构没有变化。因为在细菌、真菌或是其他微生物类群内部可能发生了结构的变化。
对典型微生物磷脂脂肪酸单体进行主成分分析发现,8月和10月份,除低氮处理样地外,中氮、高氮、超高氮处理样地微生物群落结构显著变化。两个月份中的中氮、高氮处理样地和10月份超高氮处理样地微生物群落结构的变化格局相类似,表现为i14∶0、a15∶0、i16∶0、i15∶0指示的G+细菌,cy19∶0、18∶1ω7c指示的G-细菌,18∶2ω6,9c指示的真菌和16∶1ω5c指示的丛枝菌根真菌含量相对减少。这表明尽管真菌与细菌中磷脂脂肪酸含量之比没有变化,但是氮素输入破坏了原有种群间的竞争关系。某些细菌、真菌种群的地位可能被削弱,一些生物量较低的菌群在增加。不同类型的微生物菌群对营养物质吸收的能力存在差异。氮沉降增加缓解了微生物的氮限制,一些氮素利用效率较高的贫营养型菌群在与氮素需求较高的富营养菌群的竞争中处于劣势,短期内难以适应富营养条件,其相对丰富可能会下降[34]。超高氮处理在夏季和秋季呈现出了不同的变化格局,可能是因为10月份微生物群落的变化趋势受到了其他因子如温度、湿度、土壤结构以及气候条件的综合影响。
微生物是土壤物质循环和能量流动的主要参与者。在氮沉降不断增加的背景下,研究其对土壤微生物群落结构的影响对于了解氮沉降增加对森林生态系统结构和功能的影响具有重要意义。本研究在野外定位氮添加试验近2 a后,运用磷脂脂肪酸(PLFA)分析方法,对土壤微生物结构变化进行了分析。结果表明,短期氮添加处理使微生物总磷脂脂肪酸含量显著下降,真菌、细菌中磷脂脂肪酸量出现了不同程度的下降,微生物群落结构也发生了改变。因此,在这一地区,氮沉降增加可能会使杨树林生态系统的养分循环受到影响。
[1] Galloway J N, Townsend A R, Erisman J W, et al. Transformation of the nitrogen cycle: recent trends, questions, and potential solutions[J]. Science,2008,320:889-892.
[2] Canfield D E, Glazer A N, Falkowski P G. The evolution and future of Earth’s nitrogen cycle[J]. Science,2010,330:192-196.
[3] Liu X, Zhang Y, Han W, et al. Enhanced nitrogen deposition over China[J]. Nature,2013,494:459-462.
[4] 王晶苑,张心昱,温学发,等.氮沉降对森林土壤有机质和凋落物分解的影响及其微生物学机制[J].生态学报,2013,33(5):1337-1346.
[5] 陈浩,莫江明,张炜,等.氮沉降对森林生态系统碳吸存的影响[J].生态学报,2012,32(21):6864-6879.
[6] Janssens I A, Dieleman W, Luyssaert S, et al. Reduction of forest soil respiration in response to nitrogen deposition[J]. Nature Geoscience,2010,3(5):315-322.
[7] Treseder K K. Nitrogen additions and microbial biomass: A meta-analysis of ecosystem studies[J]. Ecology Letters,2008,11(10):1111-1120.
[8] Strickland M S, Rousk J. Considering fungal: bacterial dominance in soils-methods, controls, and ecosystem implications[J]. Soil Biology and Biochemistry,2010,42(9):1385-1395.
[9] Treseder K K. A meta-analysis of mycorrhizal responses to nitrogen, phosphorus, and atmospheric CO2in field studies[J]. New Phytologist,2004,164(2):347-355.
[10] 周薇,王兵,李钢铁.大气氮沉降对森林生态系统影响的研究进展[J].中央民族大学学报:自然科学版,2010,19(1):34-40.
[11] 许凯,徐钰,张梦珊,等.氮添加对苏北沿海杨树人工林土壤活性有机碳库的影响[J].生态学杂志,2014,33(6):1480-1486.
[12] 刘纯,刘延坤,金光泽.小兴安岭6种森林类型土壤微生物量的季节变化特征[J].生态学报,2014,34(2):451-459.
[13] 颜慧,蔡祖聪,钟文辉.磷脂脂肪酸分析方法及其在土壤微生物多样性研究中的应用[J].土壤学报,2006,43(5):851-859.
[14] 国家林业局.森林土壤分析法 LY/T1253—1999[S].北京:中国标准出版社,1999.
[15] Frostegård Å, Bååth E, Tunlio A. Shifts in the structure of soil microbial communities in limed forests as revealed by phospholipid fatty acid analysis[J]. Soil Biology and Biochemistry,1993,25(6):723-730.
[16] 林黎,崔军,陈学萍,等.滩涂围垦和土地利用对土壤微生物群落的影响[J].生态学报,2014,34(4):899-906.
[17] Frostegård A, Bååth E. The use of phospholipid fatty acid analysis to estimate bacterial and fungal biomass in soil[J]. Biology and Fertility of Soils,1996,22(1/2):59-65.
[18] Olsson P A. Signature fatty acids provide tools for determination of the distribution and interactions of mycorrhizal fungi in soil[J]. Fems Microbiology Ecology,1999,29(4):303-310.
[19] Wu J, Liu W, Fan H, et al. Asynchronous responses of soil microbial community and understory plant community to simulated nitrogen deposition in a subtropical forest[J]. Ecology and Evolution,2013,3(11):3895-3905.
[20] Allison S D, Czimczik C I, Treseder K K. Microbial activity and soil respiration under nitrogen addition in Alaskan boreal forest[J]. Global Change Biology,2008,14(5):1156-1168.
[21] Gallo M, Amonette R, Lauber C. Microbial community structure and oxidative enzyme activity in nitrogen-amended north temperate forest soils[J]. Microbial Ecology,2004,48(2):218-229.
[22] DeForest J L, Zak D R, Pregitzer K S, et al. Atmospheric nitrate deposition and the microbial degradation of cellobiose and vanillin in a northern hardwood forest[J]. Soil Biology and Biochemistry,2004,36(6):965-971.
[23] 徐钰,许凯,于水强,等.不同林龄杨树细根生物量分配及其对氮沉降的响应[J].生态学杂志,2014,33(3):583-591.
[24] Nadelhoffer K J. The potential effects of nitrogen deposition on fine-root production in forest ecosystems[J]. New Phytologist,2000,147(1):131-139.
[25] 薛璟花,莫江明,李炯,等.氮沉降增加对土壤微生物的影响[J].生态环境,2005,14(5):777-782.
[26] 李娜,张利敏,张雪萍.土壤微生物群落结构影响因素的探讨[J].哈尔滨师范大学自然科学学报,2012,28(6):70-74.
[27] Bååth E, Anderson T H. Comparison of soil fungal/bacterial ratios in a pH gradient using physiological and PLFA-based techniques[J]. Soil Biology and Biochemistry,2003,35(7):955-963.
[28] Aber J D, Nadelhoffer K J, Steudler P, et al. Nitrogen saturation in northern forest ecosystems[J]. Bioscience,1989,39(6):378-286.
[29] 王晖,莫江明,鲁显楷,等.南亚热带森林土壤微生物量碳对氮沉降的响应[J].生态学报,2008,28(2):470-478.
[30] 曹志平,李德鹏,韩雪梅.土壤食物网中的真菌/细菌比率及测定方法[J].生态学报,2011,31(16):4741-4748.
[31] Demoling F, Nilsson O L, Bååth E. Bacterial and fungal response to nitrogen fertilization in three coniferous forest soils[J]. Soil Biology and Biochemistry,2008,40(2):370-379.
[32] Blaško R, Högberg P, Bach L H, et al. Relations among soil microbial community composition, nitrogen turnover, and tree growth in N-loaded and previously N-loaded boreal spruce forest[J]. Forest Ecology and Management,2013,302:319-328.
[33] DeForest J L, Zak D R, Pregitzer K S, et al. Atmospheric nitrate deposition, microbial community composition, and enzyme activity in northern hardwood forests[J]. Soil Science Society of America Journal,2004,68(1):132-138.
[34] S Diepen L T A, Lilleskov E A, Pregitzer K S, et al. Simulated nitrogen deposition causes a decline of intra-and extraradical abundance of arbuscular mycorrhizal fungi and changes in microbial community structure in northern hardwood forests[J]. Ecosystems,2010,13(5):683-695.
[35] Ramirez K S, Craine J M, Fierer N. Consistent effects of nitrogen amendments on soil microbial communities and processes across biomes[J]. Global Change Biology,2012,18(6):1918-1927.
Effects of Nitrogen Addition on Microbial Community Structure in Topsoil of Poplar Plantations
Zhao Chao, Wang Wenjuan, Ruan Honghua, Ge Zhiwei(Nanjing Forestry University, Nanjing 210037, P. R. China); Xu Changbai, Cao Guohua(State Forest Farm of Dongtai City, Jiangsu Province)//Journal of Northeast Forestry University,2015,43(6):83-88.
Soil microbes; Nitrogen addition; Microbial community structure; PLFA; Poplar plantation
赵超,女,1990年8月生,南京林业大学生物与资源环境学院,硕士研究生。E-mail:jingshuiliushen07@163.com。
阮宏华,南京林业大学生物与资源环境学院,教授。E-mail:hhuan@njfu.edu.cn。
2014年12月27日。
S741.5
1)国家重点基础研究发展计划(973计划,2012CB416904);江苏高校优势学科建设工程(PAPD);江苏高校协同创新计划。
责任编辑:潘 华。

