大鼠慢性酒精中毒性周围神经病的电生理及超微结构改变
谢春香,宋晓南
酗酒是危害公众健康的世界性问题,在美国,酒精中毒是位列心血管疾病、肿瘤之后占第3 位的公共卫生问题[1]。长期饮酒可导致脑、视网膜及视神经[2]、脊髓、肌肉、周围神经的损害,但周围神经的发病率最高[3]。本实验采用与人类饮酒模式相似的自由饮方法制备大鼠慢性酒精中毒性周围神经病模型,探讨坐骨神经电生理及超微结构改变,为酒精中毒性周围神经病的基础和临床研究提供实验依据。
1 材料和方法
1.1 动物分组和模型制备 健康、雄性、清洁级Wistar 大鼠30 只,鼠龄3~4 个月,体重250~300 g,由吉林大学医学动物实验研究中心提供。随机分为两组,对照组和酒精组各15 只。并按2 m、3 m、4 m 处死时间点分笼饲养,对照组饮水,酒精组酒浓度从6%、9%、12%各5 d 递增至20%后以该浓度维持饲养。于2 个月末、3 个月末及4 个月末分别取对照组及酒精组大鼠行电生理检查。电生理检查后处死大鼠,取坐骨神经行电镜检查。实验期间记录大鼠的一般情况,每周称体重,每两天记录饮食量及饮酒量。
1.2 电生理检查 在室温25 ℃条件下,以3%戊巴比妥钠按0.1 ml/100 g 行腹腔注射麻醉Wistar 大鼠,后肢剪毛,俯卧位固定,沿坐骨神经走行,用丹麦产Cautatata 肌电图仪检测坐骨神经运动神经传导速度,刺激电极置于近端及远端,记录电极置于远端腓肠肌,记录刺激的潜伏期和波幅,并计算运动神经传导速度。
1.3 病理检查 以3%戊巴比妥钠麻醉处死大鼠后,取一侧远端坐骨神经约0.5 cm 迅速置入4%戊二醛-磷酸缓冲液固定(4 ℃),修块后再放入锇酸2 h,超薄切片,电子双重染色(醋酸双氧铀染色和枸橼酸铅染色),透射电镜观察。
2 结果
2.1 一般资料 存活29 只,第13 周酒精组大鼠死亡1 只,饮酒1 w 开始酒精组大鼠体重增长缓慢,食量减少,1 个月后洒精组大鼠出现毛发稀疏、光泽度差,足红肿,3 个月时酒精组大鼠中有一只出现走路不稳,头向左偏。
2.2 电生理 酒精组大鼠坐骨神经运动神经传导速度减慢,CMAP 波幅降低,与对照组比较4 个月时差别具有显著性(见表1,见图1、图2)。
2.3 电镜下坐骨神经病理改变 电镜下观察2 个月酒精组与对照组相比结构无明显改变;3 个月酒精组轴索内线粒体有少量空泡形成,髓鞘改变不明显;4 个月酒精组可见有髓神经纤维轴索部分萎缩、消失,神经丝、微管、微丝数量减少,结构不清,髓鞘板层疏松增厚,折叠起皱,且可见局部板层分离、松解,无髓神经纤维数量减少(见图3、图4)。
表1 两组大鼠坐骨神经电生理变化()
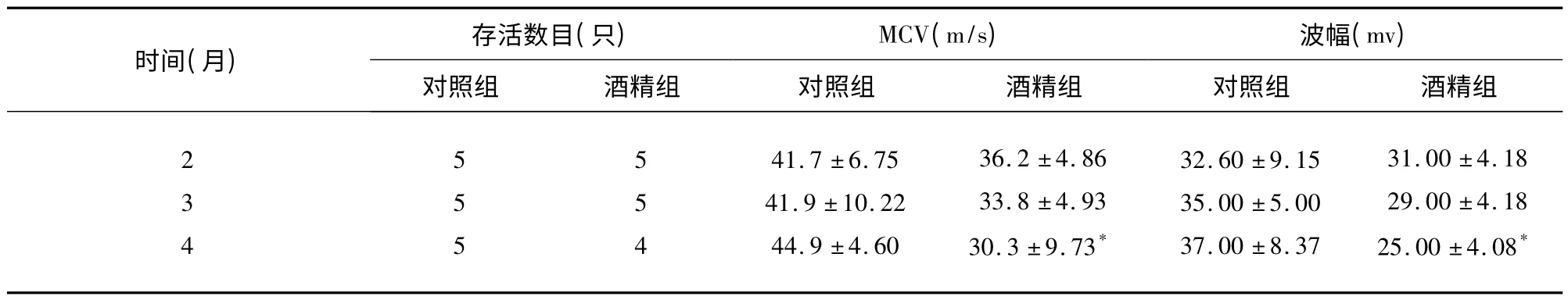
表1 两组大鼠坐骨神经电生理变化()
与同期对照组比较* P <0.05
3 讨论
酒精中毒性周围神经病的电生理所见对慢性酒精中毒性周围神经病(CAPN)的诊断较为敏感但无特异性,表现为轴索变性引起的神经源性损害伴不同程度的髓鞘脱失。主要是感觉传导速度测定中的动作电位波幅按脱失轴索的多少而减少,只要还没有严重损害最粗大纤维,传导速度还可以保持正常或只有轻微的减慢。运动传导速度测定主要是肌肉动作电位波幅减小,如果大纤维的轴索严重坏变时,传导也会减慢,其中感觉纤维比运动纤维受累严重[4]。运动神经传导速度(MCV)、感觉神经传导速度(SCV)是诊断慢性酒精中毒性周围神经病的相对敏感指标,它不但能提示病变的严重程度,还能在早期提示周围神经受损[5],其中运动神经传导速度可以反映坐骨神经的运动功能状态,可以作为慢性酒精中毒性周围神经病的实验研究方法[6]。
神经传导异常不仅出现在末端,而且在近端也可以出现,可以用H 反射、F 波以及腓肠神经传导测出。其中F 波可用于鉴别周围神经病是脱髓鞘还是轴索损害,尤其是累及近端的损害。H 反射在酒精中毒性周围神经病患者的胫神经或正中神经的潜伏期延长。肌电图有纤颤电位、正锐波、巨大的MUP,其峰峰值也比正常高大,是一种慢性神经源性损害表现[4]。国内学者[7]研究认为单纤维肌电图(SFEMG)弥补了神经传导速度(NCV)不能评价轴突特性和神经再生的缺点,其对周围性神经病变的早期诊断的敏感性高于NCV,可用于早期检测失神经及神经再支配。
本实验研究表明,酒精组2、3 个月末时坐骨神经运动神经传导速度逐渐减慢,CMAP 波幅逐渐降低,但与对照组无明显差别(P >0.05);4 个月时其两组比较差别具有显著性(P <0.05)。这种变化符合轴索型多发性周围神经病的电生理特点,与文献[8]报道一致。
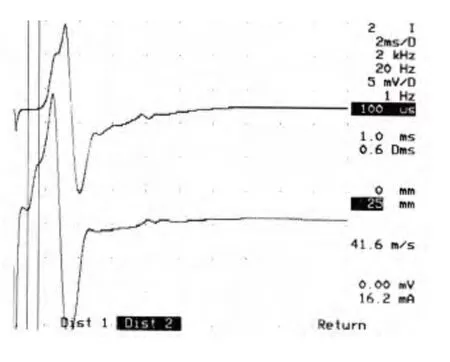
图1 4 个月对照组,坐骨神经电生理
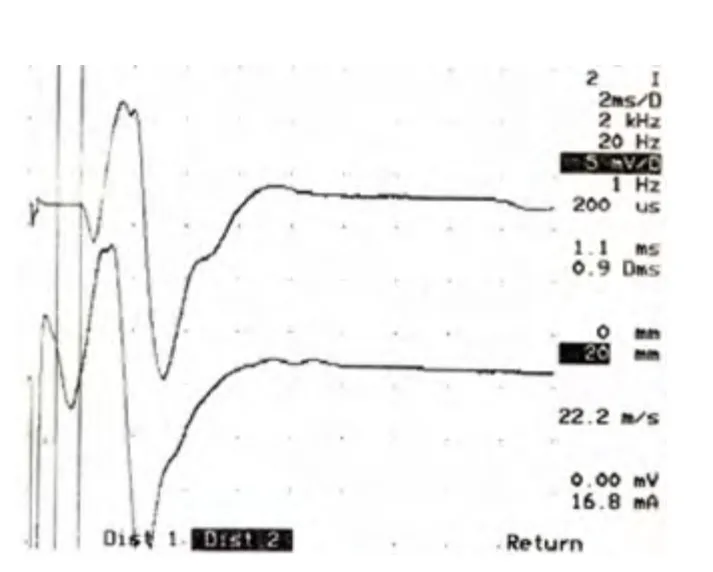
图2 4 个月酒精组,坐骨神经电生理

图3 4 个月对照组,坐骨神经形态结构正常(透射电镜×6000)
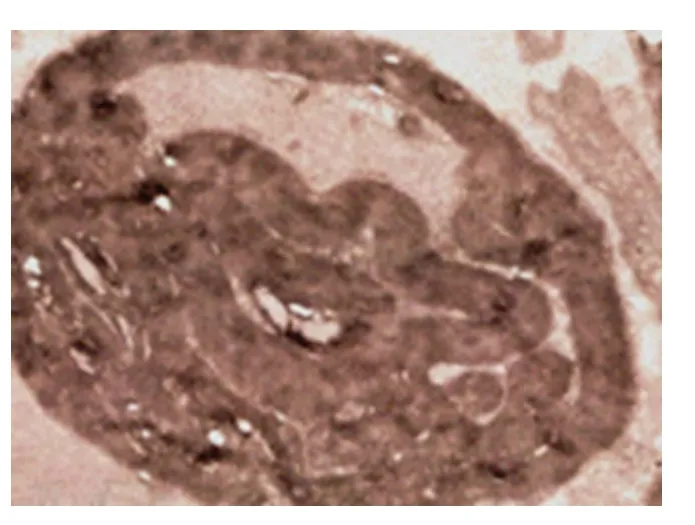
图4 4 个月酒精组,轴索部分萎缩、髓鞘增厚、板层分离、脱落(透射电镜×10000)
慢性酒精中毒性周围神经病变的主要病理改变是轴索变性,首先累及肢体远端,节段性脱髓鞘常在之后出现,也多见于远端,且较轻微[9]。电镜下可见神经内膜结缔组织明显增生,有髓神经髓鞘板层结构消失,融合增厚,排列紊乱,可见髓板脱层,朗飞节区形态异常,轴突呈细丝状或消失,轴突内线粒体嵴溶解或空泡样改变,神经丝、微管、微丝的数量减少,此外,可见无髓神经纤维变性[10]。本实验电镜下观察2 个月酒精组与对照组相比结构无明显改变;3 个月酒精组轴索内线粒体有少量空泡形成,髓鞘改变不明显;4 个月酒精组可见有髓神经纤维轴索部分萎缩、消失,微管、微丝及神经丝数量减少,结构不清,髓鞘板层疏松增厚,折叠起皱,且可见局部板层分离、松解,无髓神经纤维数量减少。本实验研究表明,电镜下神经丝、微管、微丝数量减少,而神经丝在有髓神经纤维的轴突中是最为丰富一种骨架成分,几乎充满整个轴浆,它连同微管、轴突质膜下的带状微丝网一起构成轴浆细胞骨架,这一骨架网络与轴突形态的维持和轴浆运输有密切关系[11],神经丝、微管、微丝数量的减少,使细胞骨架结构发生改变,影响轴突运输,导致坐骨神经的结构和功能损伤,发生酒精中毒性周围神经病,与文献报道一致。
综上所述自由饮方法制备的大鼠模型,其电生理及超微结构改变符合人类慢性酒精中毒性周围神经病的病变特点,这一结论为慢性酒精中毒性周围神经病的临床研究提供实验依据。
[1]Centers for Disease Control and Prevention(CDC).Alcohol attributable deaths and years of potential life lost-Unites Stateds,2001[J].MMWR Morb Mortal Wkly Rep,2004,53(37):866 -870.
[2]赵秉刚,李 昀,宋晓南,等.大鼠慢性酒精中毒自由饮模型视网膜及视神经病理改变的观察研究[J].中风与神经疾病杂志,2013,30(8):727 -730.
[3]张 虹,杜 华,李本红,等.电生理学检查对慢性酒精中毒性周围神经病的诊断何时价值[J].临床神经电生理学杂志,2002,11(4):237 -239.
[4]汤晓芙.临床肌电图学[M].北京:北京医科大学中国协和医科大学联合出版社,1995.192 -193.
[5]陈爱争.20 例慢性酒精中毒性周围神经病患者的肌电图分析[J].中国实用神经疾病杂志,2007,10(2):137 -138.
[6]牛雪茹,孙远征,罗 梅.温针结合药物治疗酒精性周围神经病大鼠的实验研究[J].针灸临床杂志,2010,26(10):58 -60.
[7]谭春艳,吴 波,王亚南,等.慢性乙醇中毒性周围神经病大鼠的单纤维肌电图研究[J].潍坊医学院学报,2008,30(1):60 -62.
[8]吕晓辉,王炳元,谢艳华,等.基质金属蛋白酶-2 和-9 在实验性酒精性肝病中的动态变化及表达[J].中华肝脏病杂志,2001,9(5):268 -270.
[9]房秋香.中西医结合治疗慢性酒精中毒性周围神经病变临床观察[J].湖北中医杂志,2011,33(7):31 -32.
[10]陈 悦,聂晓兰,徐 晓,等.大鼠慢性酒精中毒性周围神经病模型的建立[J].第四军医大学学报,2007,28(20):1845 -1847.
[11]佟向军,陈建国,翟中和.神经丝的结构与功能[J].细胞生物学杂志,1998,20(2):63 -68.

