siRNA沉默Livin基因表达在抑制裸鼠肝癌生长中的作用研究
李 庆
作者单位: 210029 江苏 南京,江苏建康职业学院 科技处
第一作者: 李 庆,女,助理研究员,研究方向:内科学基础,E-mail:450049771@qq.com
论著
siRNA沉默Livin基因表达在抑制裸鼠肝癌生长中的作用研究
李庆
作者单位: 210029江苏南京,江苏建康职业学院科技处
第一作者: 李庆,女,助理研究员,研究方向:内科学基础,E-mail:450049771@qq.com
【摘要】目的目的应用RNA干扰技术抑制人肝癌细胞株MHCC97H中凋亡抑制因子Livin的表达,研究Livin基因在抑制裸鼠肝癌细胞移植瘤生长中的作用。方法设计针对Livin基因目标序列的siRNA,将其经脂质体LipofectamineTM2000转染至肝癌细胞株MHCC97H细胞,采用RT-PCR、Westernblot方法检测转染后的MHCC97H细胞中Livin基因的mRNA和蛋白质表达。通过建立裸鼠的荧光素酶(Luciferase)标记的MHCC97H肝癌细胞移植瘤模型,监测肿瘤体积、重量,通过活体成像技术观察siRNA注射治疗移植瘤的效果。结果在Livin-siRNA转染后的MHCC97H细胞中,Livin基因的mRNA和蛋白质表达显著下降(P<0.05),siRNA注射治疗移植瘤后,肿瘤重量、体积及荧光素酶信号均显著性下降(P<0.05)。 结论通过RNA干扰技术阻断MHCC97H细胞中Livin的表达,可抑制裸鼠肝癌移植瘤的生长,提示Livin基因在肝癌的发生、发展过程中起重要作用。
【关键词】肝癌;MHCC97H细胞;Livin;RNA干扰;裸鼠
原发性肝癌是我国常见的恶性肿瘤之一,死亡率高。目前的治疗以手术和化疗为主,近年来,人们逐渐地认识到凋亡在肿瘤的发生发展以及转移中扮演着越来越重要的角色,诱导肿瘤细胞的凋亡成为人们攻克肿瘤的一个研究方向。Livin是凋亡抑制蛋白家族(inhibitors of apoptosis proteins,IAPs)的新成员, Livin基因导致的凋亡抑制与一些恶性肿瘤的发生与发展密切相关[1-4],但Livin在肝癌的发生发展过程中是否起重要作用仍然是未知的。为此,我们应用RNA干扰 (RNA interference,RNAi)技术,选用人肝癌细胞株MHCC97H作为模型,利用合成特异地针对Livin基因的小干扰RNA(small interfering RNA,siRNA),在细胞及活体水平上研究Livin-siRNA对MHCC97H细胞生长增殖的影响,为肝癌的作用机制研究和提供用药新思路。
1材料与方法
1.1材料和试剂人高转移潜能肝癌细胞株MHCC97H及荧光素酶标记的MHCC97H细胞由上海科远迪生物科技所购得。SiRNA由上海吉凯基因化学公司合成。裸鼠购自上海斯莱克实验动物有限公司。培养基DMEM购自GIBCO公司,胎牛血清购自杭州四季青公司,脂质体LipofectamineTM2000购自美国Invitrogen公司,mRNA提取及逆转录试剂盒购自Takara公司,anti-Livin、anti-GAPDH抗体和二抗购自巴傲德生物科技有限公司,BCA蛋白定量试剂盒购自美国pierce公司。
1.2细胞培养人高转移潜能肝癌细胞株MHCC97H及荧光素酶标记的MHCC97H细胞用含10%胎牛血清(fetal calf serum, FCS)的DMEM培养液于50 ml细胞培养瓶内在37℃,5% CO2的饱和湿度培养箱中进行培养,2~3 d换液,0.25%胰蛋白酶消化细胞并常规传代培养。取对数生长期MHCC97H细胞进行实验。
1.3SiRNA基因序列的设计与准备我们共合成4条引物特异性抑制Livin基因的表达。SiRNA针对的Livin目标序列为5′-GGAGAGAGGTCCAGTCTGA-3′, 5′-GGAAGAACCGGAAGACGCA-3′, 5′-GCTCTGAGGAGTTGCGTCT-3′和5′-GCTCTGAGGAGTTGCGTCTTT-3′[5]。将含SiRNA粉末的EP管进行离心,使粉末聚集在EP管底,然后在室温下用1×SiRNA缓冲液将其溶解重悬至储存浓度,并用紫外分光光度法在260nm确定其浓度。
1.4SiRNA转染MHCC97H细胞将状态良好的MHCC97H细胞于转染前24 h接种6孔细胞培养板,待其生长至80%~90%融合时利用脂质体LipofectamineTM2000介导Livin-siRNA(50 mol/L)转染,同时转染非特异性的对照control-siRNA和未转染的MHCC97H细胞作为对照。为了检测转染效率,同时MHCC97H细胞被转染了FITC标记的siRNA,6 h后用FACSan (Becton Dickson, San Jose, CA) 进行检测。
1.5RT-PCR检测mRNA的表达MHCC97H细胞转染Livin-siRNA(50mol/L),非特异性的对照control-siRNA和未转染的MHCC97H细胞作为对照。48 h后培养在6孔板中的细胞已基本长满,RT-PCR检测mRNA表达变化。吸取6孔板中的生长培养基,PBS洗涤细胞3次,每孔加入1 ml Trizol试剂,按照说明书提取RNA,按照Takara公司逆转录试剂盒操作说明书进行逆转录。Livin基因扩增片段长度为199 bp,上游引物:5-GTCAGTTCCTGCTCCGGTCAA-3; 下游引物:5-GGGCACTTTCAGACTGGACCTC-3;以GAPDH作为内参,产物长度87 bp,上游引物:5′-TGCACCACCAACTGCTTAGCC-3′,下游引物:5′-GGCATGGACTGTGGTCATGAG-3′。按照Takara公司扩增试剂盒操作步骤并进行Livin基因PCR扩增,并对Livin mRNA的表达水平进行软件分析,实验重复3次。
1.6Western blot检测蛋白的表达MHCC97H细胞转染Livin-siRNA(50 μmol/L),非特异性的对照control-siRNA和未转染的MHCC97H细胞作为对照。72 h后收集实验组和阴性对照组以及空白组细胞,常规方法提取蛋白质、BCA法进行蛋白定量,上样量50 μg,聚丙烯酰胺凝胶电泳(SDS-PAGE),电转移至PVDF膜,5%脱脂牛奶室温封闭2 h,封闭后用按一定比例的Anti-Livin及anti-GAPDH 4 ℃孵育过夜。第2日洗膜后加入辣根过氧化物酶标记的二抗,室温孵育1 h,洗膜后加入ECL发光液覆盖膜3 min后,在荧光凝胶成像系统中显像、摄片、保存记录,并应用Image J图像分析仪分析结果,计算灰度值。实验重复3次。
1.7动物模型取对数生长期MHCC97H-LUC肝癌细胞株,充分吹打至单细胞悬液,细胞冲洗液冲洗3次,DMEM调整细胞浓度为2×107/ml,予0.2 ml注射于4~6周龄的雄性裸鼠背部皮下,于层流室内饲养21 d,皮下成瘤,即造模成功。将动物模型随机分为2组,动物模型体质量及周龄组间均衡性检验无统计学差异。A组:阴性对照组(等体积PBS肿瘤内注射,n=10);B组:实验组(50 mol·L-1·kg-1肿瘤内注射,n=10),连续4周注射治疗,每周1次。为增强治疗效果,将siRNA与胶原蛋白(Atelo-Gene Systemic Use; Koken, Tokyo, Japan. 0.1% in PBS at pH 7.4)等体积摇匀混合。每周用游标卡尺对肿瘤体积进行监测,同时监测小鼠体重,用Caliper spectrum监测肿瘤荧光素酶信号强度,连续监测5周。
1.8统计学处理各组数据以平均值±标准差表示,数据分析采用Prism软件进行处理,多组间比较采用one-way ANOVA分析方法以及Newman-Keuls Multiple Comparison Test进行检验,两组比较采用配对t检验,以P<0.05表示具有统计学意义。
2结果
2.1Livin-siRNA转染肝癌细胞MHCC97H靶向Livin基因的siRNA瞬时转染肝癌细胞MHCC97H,其中实验组具有绿色荧光,以监控实验转染成功,对照组无绿色荧光。
2.2转染Livin-siRNA后沉默Livin mRNA的表达在肝癌细胞MHCC97H中转染Livin-siRNA后48 h提取细胞mRNA。RT-PCR结果显示,Livin/GAPDH值在实验组、阴性对照组和空白组分别为0.47±0.02、0.96±0.05 和0.93±0.05,实验组与空白组和阴性对照组比较,实验组转染Livin-siRNA后的Livin mRNA表达较其他组细胞明显降低(图1,P<0.05)。表明Livin-siRNA成功转染进入MHCC97H细胞,并能特异性沉默Livin mRNA的表达。
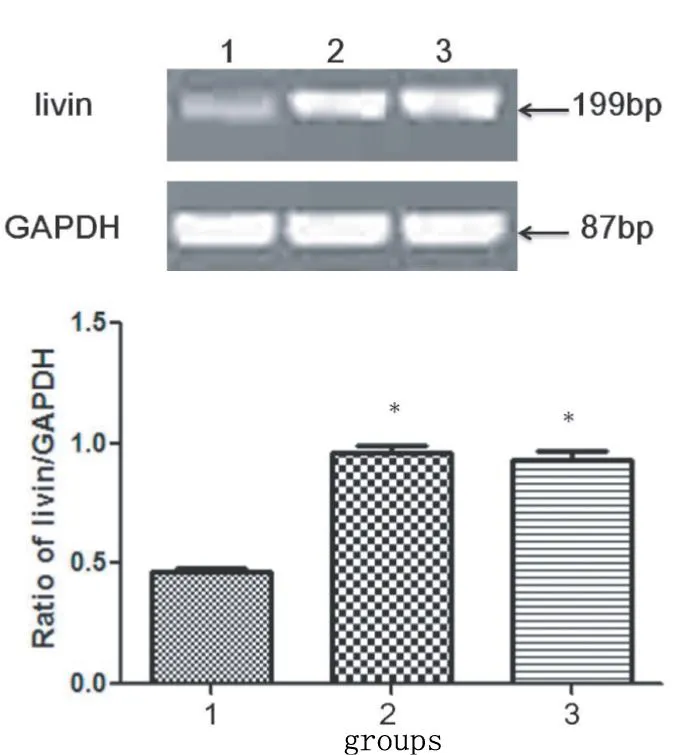
图1 转染Livin-siRNA后沉默Livin mRNA的表达。
2.3转染Livin-siRNA对Livin蛋白表达的影响Western blot结果显示,Livin蛋白表达在实验组明显低于阴性对照组及空白组(图2,P<0.05),Livin/GAPDH蛋白量的比值在实验组、阴性对照组和空白组分别为0.36±0.04、0.74±0.06 和0.713±0.04,实验组与空白和阴性对照组比较均有显著性差异(P<0.05)。进一步表明Livin-siRNA成功转染进入MHCC97H细胞,并能特异性下调Livin蛋白的表达。
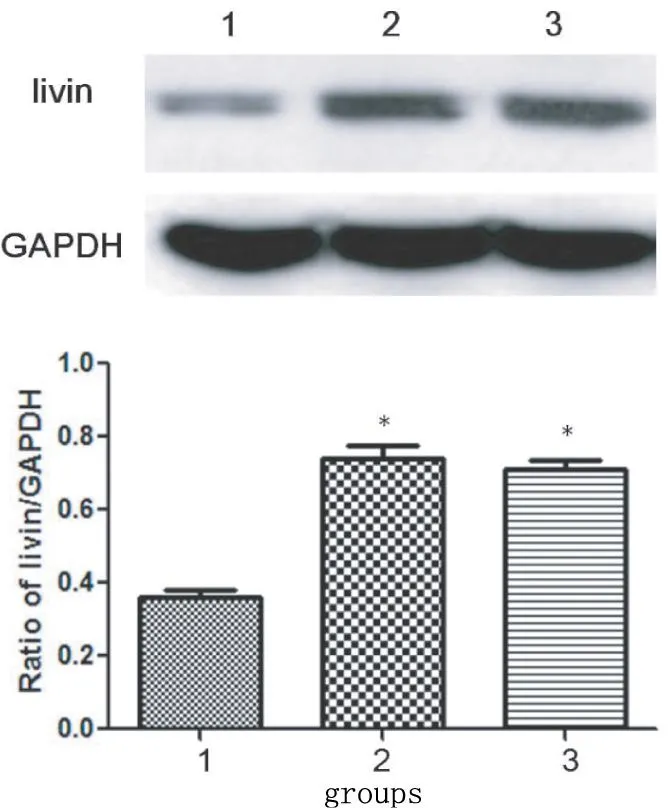
图2 转染Livin-siRNA抑制Livin蛋白表达。
2.4SiRNA治疗移植瘤后肿瘤的情况所有裸鼠皮下移植MHCC97H细胞成瘤迅速且均存活,用siRNA进行治疗5周期间,对照组有4只(40%)裸鼠死亡,实验治疗组无裸鼠死亡。5周治疗期间,每周用游标卡尺对肿瘤体积进行监测,对照组平均体积(0.82 ±0.04)cm3, 显著高于实验组的(0.44±0.07)cm3,差异有统计学意义(P<0.05)。同时监测小鼠体重,小鼠体重均轻微增加,两组之间无明显差异(P>0.05)。用Caliper spectrum监测肿瘤荧光素酶信号强度,连续监测5周。结果表明,对照组裸鼠皮下肿瘤荧光素酶信号强度显著高于实验组,差异有统计学意义(P<0.05)。见图3。
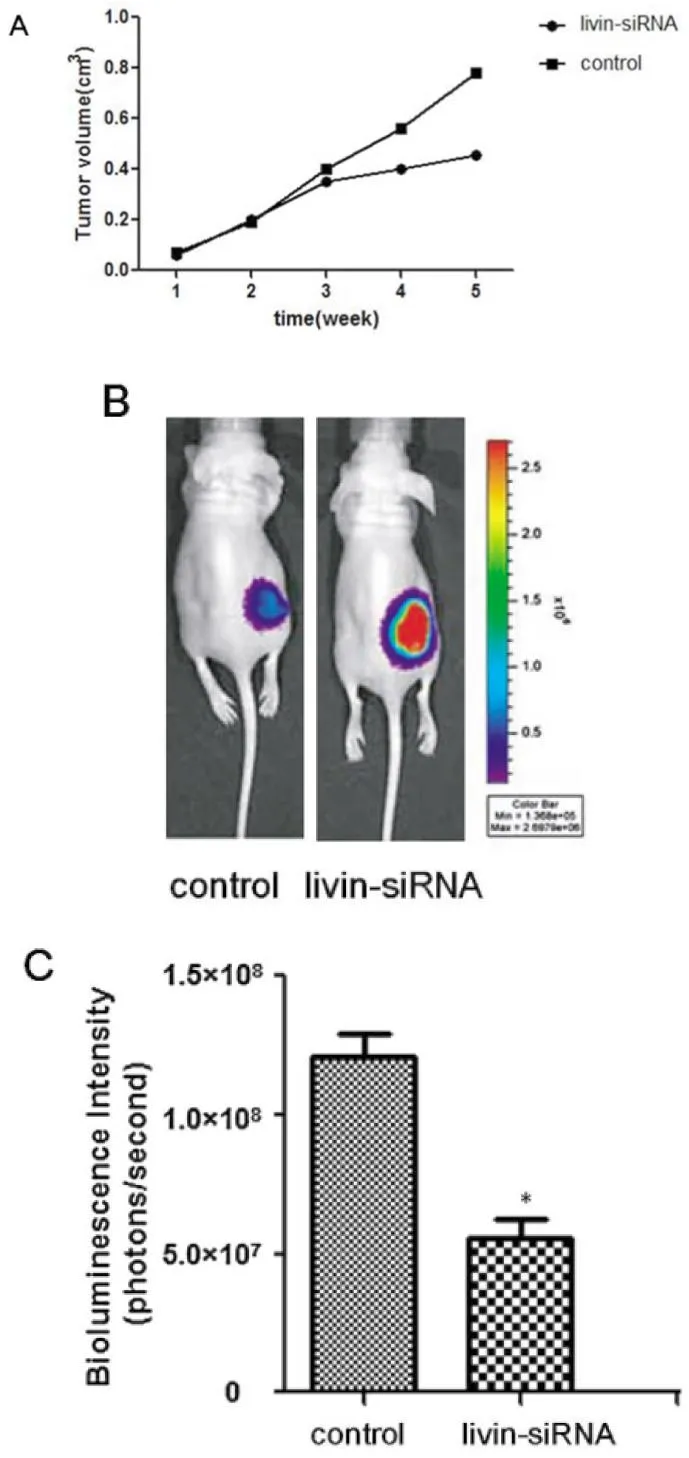
图3 SiRNA治疗抑制裸鼠移植瘤生长。
3讨论
肿瘤的发生与其过度表达引起细胞凋亡不足密切相关。IAPs在细胞凋亡的过程中起着抑制凋亡的作用,在机体内的异常表达可使细胞的正常凋亡机制受损, 导致有恶变潜能的细胞积累, 进而导致肿瘤的发生, 因此其与肿瘤的关系密切[6-7]。目前已经发现的凋亡抑制蛋白家族成员有8个,分别是NAIP、C-IAP1(MIHB、HIAP-2)、C-IAP2(MIHC、HIAP-1)、XIAP(hILP、MIHA、ILP-1)、Survivin、Apollon(Bruce)、ILP-2 和Livin(KIAP、ML-IAP)。Livin是IAPs中的最新成员,在大多数正常成人组织中不表达或低表达,但在多种恶性肿瘤组织中高表达,如黑色素瘤、膀胱癌、肺癌、宫颈癌、乳腺癌、肾癌、鼻咽癌、白血病、淋巴瘤以及胃肠道肿瘤等。Livin可使肿瘤细胞对缺血、缺氧、放射治疗及化学治疗等产生耐受,因此可能在肿瘤的发生发展中起重要的作用[1-4,8-9]。
siRNA是一种短片断双链RNA分子,能够在细胞内与其含有互补序列的mRNA识别并结合,并在特异性酶的作用下使其相应的基因沉默,这种现象被称为RNAi[10-11]。RNAi技术具有普遍、操作简单的特点,并能特异而有效地阻断靶基因的表达。近年来国内外已有在多种肿瘤中应用RNAi技术靶向沉默Livin基因的抗癌研究的报道[12-15]。文章里利用基因转染和RNA干扰技术分别在非小细胞肺癌、宫颈癌、肾癌等多种肿瘤中构建Livin特异的基因沉默体系,即针对Livin基因序列设计的特异性siRNA,导入肿瘤细胞后引起与其序列同源的Livin mRNA特异性降解,从而阻断肿瘤细胞Livin基因的表达,增强肿瘤细胞对凋亡诱导剂的敏感性,结果均显示Livin能作为诱导肿瘤细胞凋亡的分子靶点。因此,通过使Livin基因沉默靶向诱导细胞凋亡可作为手术、化疗、放疗等传统治疗的辅助手段。Livin基因抑制肿瘤细胞凋亡,并与肿瘤细胞耐药性相关,因此,降低Livin的表达不仅可直接促进肿瘤细胞的凋亡,而且增加了肿瘤组织对化疗药物的敏感性并且联合其他IAPs家族成员能获得协同效应[16-18]。
本研究应用siRNA干扰技术靶向沉默肝癌细胞MHCC97H中Livin基因表达,结果显示,实验组与空白组和阴性对照组相比,转染Livin-siRNA后,无论在mRNA水平还是在蛋白水平上其Livin基因表达量均明显降低,表明此转染可行有效,Livin基因的沉默效果明显。在活体实验中,所有裸鼠皮下移植MHCC97H细胞成瘤迅速且均存活,用siRNA进行治疗5周期间,对照组平均肿瘤体积显著高于实验组。大多数移植瘤实验是通过瘤重或肿瘤体积来评价药物的效果,本实验中利用荧光素酶标记的MHCC97H细胞,在活体里动态监测肿瘤荧光素酶信号强度。因为只有活细胞才可检测到荧光素酶的荧光强度,因此对移植瘤的荧光素酶强度变化监测可以更准确地反映肿瘤的存活情况。实验结果表明,实验组的荧光素酶发光强度与对照组相比显著下降,这与对肿瘤平均体积的检测结果一致。
综上所述,通过RNA干扰技术阻断MHCC97H细胞中Livin的表达,可抑制裸鼠肝癌移植瘤的生长,为Livin在肝癌中的治疗提供了新的作用机制和用药新思路。
参考文献:
[1]Liu B, Han M, Wen JK, et al. Livin/ML-IAP as a new target for cancer treatment[J]. Cancer Lett, 2007,250(2):168-176.
[2]Yagihashi A, Asanuma K, Tsuji N, et al. Detection of anti-livin antibody in gastrointestinal cancer patients[J].Clin Chem,2003,49(7):1206-1208.
[3]Saif MW, Zalonis A,Syrigos K.The clinical significance of autoantibodies in gastrointestinal malignancies: an overview[J].Expert Opin Biol Ther,2007,7(4):493-507.
[4]Choi J, Hwang YK, Sung KW, et al. Expression of livin, an antiapoptotic protein, is an Independent favorable prognostic factor in childhood acute lymphoblastic leukemia[J].Blood, 2007,109(2):471-477.
[5]Oh BY, Lee RA, Kim KH. siRNA targeting livin decreases tumor in a xenograft model for colon cancer[J].World J Gastroenterol,2011,17(20):2563-2571.
[6]Gyrd-Hansen M, Meier P.IAPs: from caspase inhibitors to modulators of NF-kappaB, inflammation and cancer[J].Nat Rev Cancer,2010,10(8):561-574.
[7]Srinivasula SM, Ashwell JD.IAPs: what’s in a Name?[J].Mol Cell,2008,30(2):123-135.
[8]Kasof GM,Gomes BC. Livin, a novel inhibitor of apoptosis protein family member[J].J Biol Chem,2001,276(5):3238-3246.
[9]Chang H, Schimmer AD. Livin/melanoma inhibitor of apoptosis protein as a potential therapeutic target for the treatment of malignancy[J].Mol Cancer Ther,2007,6(1):24-30.
[10]Hannon GJ.RNA interference[J].Nature,2002,418(6894):244-251.
[11]Kim DH,Rossi JJ.Strategies for silencing human disease using RNA interference[J].Nat Rev Genet,2007,8(3):173-184.
[12]Crnkovi-Mertens I, Semzow J, Hoppe-Seyler F, et al.Isoform-specific silencing of the Livin gene by RNA interference defines Livin beta as key mediator of apoptosis inhibition in HeLa cells[J].J Mol Med (Berl),2006,84(3):232-240.
[13]Crnkovic-Mertens I, Hoppe-Seyler F, Butz K. Induction of apoptosis in tumor cells by siRNA-mediated silencing of the livin/ML-IAP/KIAP gene[J].Oncogene,2003,22(51): 8330-8336.
[14]Crnkovi-Mertens I, Muley T, Meister M, et al. The anti-apoptotic livin gene is an important determinant for the apoptotic resistance of non-small cell lung cancer cells[J].Lung Cancer, 2006,54(2):135-142.
[15]Crnkovi-Mertens I, Wagener N, Semzow J, et al. Targeted inhibition of Livin resensitizes renal cancer cells towards apoptosis[J].Cell Mol Life Sci,2007,64(9):1137-1144.
[16]Wang X, Xu J,Ju S, et al. Livin gene plays a role in drug resistance of colon cancer cells[J].Clin Biochem,2010,43(7/8):655-660.
[17]Yuan D, Liu L, Xu H, et al. The effects on cell growth and chemo-sensitivity by livin RNAi in non-small cell lung cancer[J].Mol Cell Biochem,2009,320(1/2):133-140.
[18]Yang D, Song X, Zhang J, et al. Therapeutic potential of siRNA-mediated combined knockdown of the IAP genes (Livin, XIAP, and Survivin) on human bladder cancer T24 cells[J].Acta Biochim Biophys Sin (Shanghai),2010,42(2):137-144.
Effects of siRNA silencing Livin gene expression on the suppression of hepatocellular carcinoma growth in nude miceLIQing(DepartmentofScienceandTechnology,JiangsuJiankangVocationalCollege,Nanjing210029,China)
Correspondingauthor:LIQing,E-mail:450049771@qq.com
Abstract:ObjectiveTo study the effect of inhibitor of apoptosis Livin down-regulation by small interfering RNA-mediated RNA interference (RNAi) in a xenograft model of hepatocellular carcinoma cell line MHCC97H. MethodsMHCC97H cells were transfected with synthetic small interfering RNA (siRNA) targeting Livin by lipidosome LipofectamineTM2000. Expression of Livin mRNA and protein were respectively measured by reverse transcription polymerase chain reaction (RT-PCR) and Western blot. Different doses of Livin-siRNA were injected into xenografted tumors in BALB/c nude mice model in order to confirm the in vivo effect of Livin-siRNA. ResultsBoth Livin mRNA and protein expression were significantly decreased in the experimental group compared with controls (P<0.05). In vivo, the tumor size and the signal intensity of luciferase in tumor significantly decreased after Livin-siRNA injection at 50 μmol/L concentration (P<0.05). There were no significant body weight changes of mice after siRNA injection. ConclusionsSiRNA-mediated down-regulation of Livin expression can induce apoptosis in hepatocellular carcinoma in vitro and in vivo, which suggests the important role of Livin gene in hepatocellular carcinoma.
Keywords:Hepatocellular carcinoma;MHCC97H cell line;Livin;RNA interference;Nude mice
[收稿日期:][本文编辑:李筱蕾]
文章编号:1674-4136(2015)06-0351-05
doi:10.3969/j.issn.1674-4136.2015.06.003
通讯作者:李庆,E-mail:450049771@qq.com

