虎源细小病毒的分离鉴定及其VP2 基因分析
刘永相,李秀云,刘 鑫,蒋艳妹,郭冬春,田 进,仇 铮,邹希明,*,曲连东*
(1.中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室,黑龙江 哈尔滨 150001;2.北方森林动物园,黑龙江 哈尔滨 150332)
猫泛白细胞减少症病毒(Feline panleukopenia virus,FPLV)又称猫细小病毒、猫传染性肠炎病毒或猫瘟热病毒。引起的传染病主要以高热、呕吐、白细胞严重减少和肠炎为特征[1]。研究发现,FPLV在自然条件下能够感染多种野生猫科动物,如狮子、老虎、豹以及水貂等[2]。
FPLV 的主要结构蛋白为VP1 和VP2,VP2 是衣壳蛋白的主要组成成分,而正是VP2 的个别关键氨基酸决定了细小病毒不同抗原型的宿主范围和生物学特征[3],因此很有必要对VP2 基因序列进行深入研究。FPLV 的抗原变异还导致了新病毒的出现。1977 年~1978 年间开始流行的细小病毒被证明其基因遗传关系与FPLV 最为接近,核苷酸变异不到百分之一,而且变异多集中在VP2 序列中[4]。FPLV 的宿主谱正在不断的变大,2008 年,杨松涛等从腹泻猴体内分离到细小病毒,并且VP2 的10 个关键氨基酸位点中有8 个与FPLV 的相同[5]。
老虎作为濒危的珍惜野生保护动物,近年来受到越来越多病毒的威胁,目前感染虎的病毒有细小病毒[2]、犬瘟热病毒、A 型流感病毒、猫杯状病毒[6]、犬副流感病毒和朊病毒[7]等,所以保护虎免受病毒的威胁变得越来越迫切。
在东北虎源病毒生态多样性的研究中,发现从东北虎粪便样品中扩增出细小病毒基因,通过细胞分离鉴定获得了一株虎源细小病毒HRB-T2014,并且对其VP2 基因序列进行克隆及遗传进化分析。
1 材料和方法
1.1 虎粪便样品收集及处理 从哈尔滨地区某动物园采集了若干只东北虎的粪便样品,其中一部分为腹泻样品,部分为血便样品。所有样品均分为两份,分别进行单独存放并做好标记,一部分用于病毒分离鉴定,于-70 ℃冻存;另一部分用于病毒宏基因组测序。将用于病毒宏基因组测序的样品混合后,用PBS 进行10 倍稀释,反复冻融3 次,进行差速离心,上清液用0.22 μm 滤膜进行过滤。滤液进行超速离心,用5 mL PBS 重悬沉淀,分装后于-70 ℃冻存备用。
1.2 主要试剂 pMD18-T 载体、Ex Taq DNA 聚合酶、T4 DNA 连接酶、DL2000 DNA Marker 购自TaKaRa 公司;AxyPrep 体液病毒DNA/RNA 小量制备试剂盒、质粒小量抽提试剂盒和胶回收试剂盒购自康宁生命科学(吴江)有限公司;DH5α 感受态细胞购自天根生化科技(北京)有限公司。
1.3 引物设计与合成 根据文献合成肉食动物细小病毒通用鉴定引物[8],Uni-F:5'-GTAAGCTTCCA GGAGACTTT-3'/Uni-R:5'-GTAAGCTTCGTCGTGTT CTT-3',扩增片段约为660 bp。根据文献合成FPLV VP2 全基因序列的引物[9],VP2-F:5'-ATGAGT GATGGAGCAGTTC-3'/VP2-R:5'-AATATAATTTTC TAGGTGCTAG-3',扩增片段为1 755 bp。引物由哈尔滨博士生物技术有限公司合成。
1.4 病毒宏基因组测序及分析 取300 μL 超速离心虎粪悬液,依次进行酶处理,核酸提取,反转录,核酸随机扩增,PCR 纯化[10],纯化的PCR 产物由深圳华大基因科技服务有限公司进行病毒宏基因组测序。将所得序列通过GenBank 的数据库BLASTn和BLASTr 比对,并通过生物信息学分析去除无关的细菌和真核生物基因序列,获得病毒序列。
1.5 细小病毒PCR 鉴定 参考AxyPrep 体液病毒DNA/RNA 小量制备试剂盒说明书,提取虎粪样品中的核酸,利用引物Uni-F/Uni-R 进行PCR 扩增[8]。PCR 产物经琼脂糖凝胶电泳检测。
1.6 病毒的分离、纯化及电镜观察 将PCR 鉴定为细小病毒阳性的样品,采用PBS 进行10 倍稀释,反复冻融3 次,进行差速离心,上清液用0.22 μm滤膜进行过滤。将滤液与DMEM(含2 %血清)培养基按1∶10 的比例同步接种CRFK 细胞,于37 ℃5%CO2培养,待细胞出现病变后,反复冻融3 次收集病毒,进行蚀斑纯化。取1 mL 纯化后的病毒,3 000 r/min 离心15 min,取上清,12 000 r/min离心30 min,将沉淀用100 μL PBS 重悬,经磷钨酸负染后电镜观察。
1.7 VP2 基因克隆及序列分析 按照上述方法提取纯化病毒的DNA,以其为模板,用FPLV VP2 基因特异性引物VP2-F/VP2-R 进行PCR 扩增[9],并将扩增产物克隆于pMD18-T 载体中进行测序鉴定。将测序结果采用DNAStar 程序中的SeqMan 软件进行序列拼接,进行Blast 比对。利用MegAlign 软件将VP2 基因核苷酸和氨基酸序列与细小病毒参考病毒株进行同源性比对。用MEGA5.0 软件中的邻接法构建VP2 基因的系统发育树。
2 结果与讨论
2.1 病毒宏基因组测序结果 经过Illumina HiSeq2000 高通量测序,共得到3 200 000 000 条读长(Reads),并拼接出6 766 条重叠序列(Contig),contig 全长为8 451 561 bp。其中大量序列对应于细小病毒,包括犬细小病毒、猫细小病毒和貂细小病毒等。病毒宏基因组学技术作为一种研究方法,通过以某一群落全部病毒为研究对象,对所有病毒核酸进行测序和分析,能够从病原生态学水平了解一定群落的病毒组成。本研究通过对东北虎粪便样品进行病毒宏基因组学分析时发现其中存在大量细小病毒基因序列,提示病料样品中存在细小病毒。
2.2 细小病毒通用引物的鉴定 在病毒宏基因组测序结果的基础上,用肉食动物细小病毒通用检测引物对采集的样品进行PCR 验证,产物经琼脂糖凝胶电泳检测,结果显示在约660 bp 处出现特异性片段,与预期相符,表明病料样品中存在细小病毒(图略)。
2.3 病毒分离、纯化及电镜观察 将PCR 鉴定为阳性的样品接种CRFK 细胞后3 d 即出现细胞变圆,贴壁不牢,折光性加强,聚集成团,并陆续脱落。并在细胞上形成形态较小的蚀斑。纯化的病毒负染后,经透射电镜观察可见到典型的细小病毒病毒粒子,直径约为20 nm,呈球形或卵圆形。病毒命名为FPLV HRB-T2014。
2.4 细小病毒VP2 基因的克隆及序列分析 采用FPLV VP2 基因特异性引物对纯化病毒的DNA 进行PCR 扩增,产物经琼脂糖凝胶电泳检测,结果显示在约1 700 bp 出现特异性片段,与预期结果相符(图1)。对FPLV 分离株HRB-T2014 的VP2 基因核酸序列分析表明,其与中国虎源分离株FJ405225 和HT-374 相似性最高,为99.9 %,而与犬细小病毒cpvnj01-06 相似性仅为98.1 %。
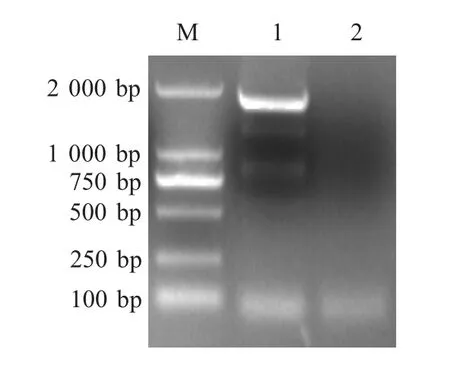
图1 VP2 基因的PCR 扩增Fig.1 PCR amplication of VP2 gene
前期研究表明VP2 蛋白有10 个关键性氨基酸位点影响细小病毒抗原型宿主范围及生物学特性,其中80、93、103、323、564 和568 位6 个氨基酸主要决定宿主差异(表1)。当80、564 和568 位分别为赖氨酸(K)、天冬酞胺(N)和丙氨酸(A)时,细小病毒只能在猫体内增殖,但当93、103 和323 位分别为N、A 和N 时,细小病毒则只能感染犬而不能感染猫,而本研究中,虎源分离株HRB-T2014 符合FPLV 的分子特征,这也恰恰符合了老虎属于猫科动物的特征。
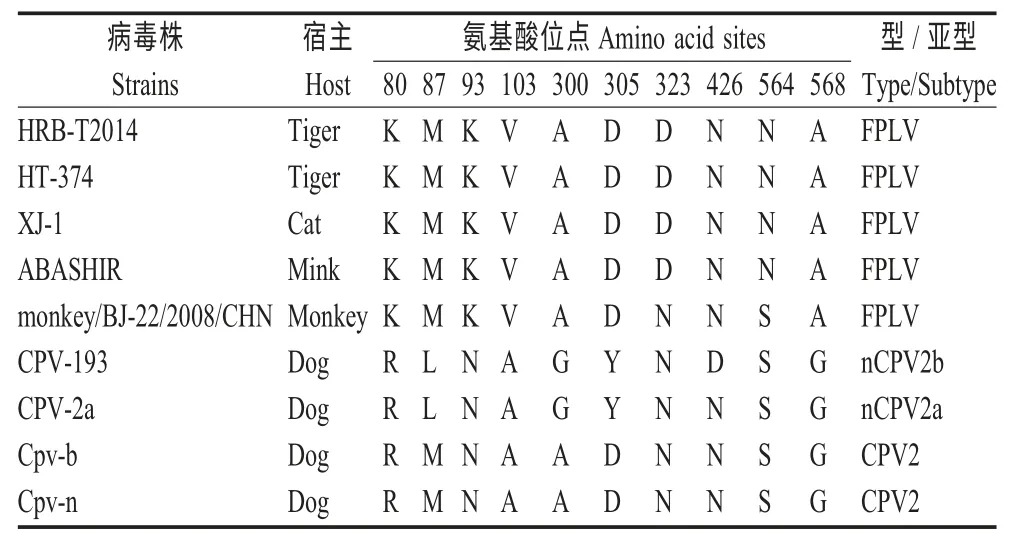
表1 VP2 蛋白中10 个关键氨基酸位点Table 1 Ten key amino acid sites of VP2
2.5 VP2 基因的进化分析 将FPLV HRB-T2014 株VP2 基因的核苷酸序列与NCBI 中登录的34 株细小病毒VP2 基因核酸序列进行比对,构建系统发育树。结果表明,FPLV HRB-T2014 株与HT-374 株和FJ405225 株进化距离最近,并与猫源、虎源和貂源细小病毒共位于FPLV 分支,而与犬细小病毒处于两个独立的分支(图2)。系统进化分析进一步证明分离株HRB-T2014 起源于FPLV。
然而,值得注意的是,当323 和564 位分别为N 和丝氨酸时,FPLV 能够感染灵长类动物[5],这表明FPLV 通过遗传变异具有了跨种间传播的潜在风险。因此,加强FPLV 的分子流行病学和遗传变异机制的研究对保护野生动物具有重要的意义。
[1]Stuetzer B,Hartmann K.Feline parvovirus infection and associated diseases[J].Vet J,2014,201(2):150-155.
[2]杨松涛,王立刚,戈锐,等.虎源猫泛白细胞减少症病毒的分离鉴定[J].兽类学报,2007,27(2):170-174.
[3]梁萌,王化磊,冯昊,等.我国2 株野生动物源细小病毒VP2 和NS1 基因序列及所编码蛋白的分析[J].中国兽医学报,2013,33(3):345-351.
[4]赵建军,闫喜军,吴威.犬细小病毒:从起源到进化[J].微生物学报,2011,51(7):869-875.
[5]Yang Song-tao,Wang Shu-jun,Feng Hao,et al.Isolation and characterization of feline panleukopenia virus from a diarrheic monkey[J].Vet Microbiol,2010,143(2-4):155-159.
[6]高玉伟,夏咸柱,扈荣良,等.猎豹与虎猫杯状病毒的分离及其超变区基因比较研究[J].中国预防兽医学报,2003,25(3):179-182.
[7]吴长德,赵德明,杨建民,等.东北虎朊病毒基因的克隆与序列分析[J].中国预防兽医学报,2007,29(3):190-193.
[8]刘维全,范泉水,江禹,等.肉食兽细小病毒通用PCR 诊断技术的建立[J].中国兽医学报,2001,21(3):249-251.
[9]许冬蕾,任常宝,张晓战,等.广州地区犬细小病毒VP2基因的序列分析[J].中国畜牧兽医,2013,40(12):38-42.
[10]He Biao,Li Zuo-sheng,Yang Fan-li,et al.Virome profiling of bats from Myanmar by metagenomic analysis of tissue samples reveals more novel Mammalian viruses[J].PLoS One,2013,8(4):e61950.

