垂盆草(Sedum sarmentosum)水提物对草鱼(Ctenopharyngodon idellus)脂肪性肝损伤治疗效果研究*
吴春艳 汪开毓 任思宇 王 均 苗常鸿
(1. 四川农业大学鱼病研究中心 四川农业大学动物疫病与人类健康四川省重点实验室 成都 611130;2. 重庆三峡职业学院动物科技系 重庆 404155; 3. 四川省动物卫生监督所 成都 610000)
自20世纪80年代以来,我国水产养殖业取得显著性发展,但随着水产养殖进入规模化和集约化模式后,促使养殖密度过高、水环境恶化及饵料营养不均衡等原因,造成了水产动物的大面积发病和死亡,严重阻碍了水产养殖业的健康发展。随着科技的发展,脂类食谱已广泛应用于鲑科鱼类的饲料中,但在一些植食性鱼类,特别是草鱼(Ctenopharyngodon idellus),由于长期摄入这种饲料后会出现肝脏脂肪代谢机能的紊乱,导致食欲下降,影响生长性能(Duet al,2005)。目前生产上主要通过在饲料中添加氯化胆碱(Choline choride)、甜菜碱(Betaine)等抗脂因子(向朝林,2011),但因此类物质仅可作为饲料添加剂而限制其用量,使得治疗效果不理想(Wilsonet al,1988),故在治疗鱼类脂肪肝疾病的领域里,开发廉价高效的新型中草药具有重要的意义。
保肝中药景天科植物垂盆草(Sedum sarmentosum)可有效抑制由 D-半乳糖苷(D-galactoside,D-GalN)、脂多糖(Lipopolysaccharide,LPS)导致的小鼠爆发性肝衰竭引起的小鼠血液谷丙转氨酶(ALT)、谷草转氨酶(AST)水平的升高,且因其可有效抑制人肝癌细胞增殖而被民间广泛应于慢性病毒性肝病的治疗(Lianet al,2010),但目前有关其对肝脏脂质代谢等方面的研究少有报道,仅有 Morikawa等(2012)和 Muraoka等(2009)报道了关于垂盆草影响人肝癌细胞内脂质代谢活性的研究中,证实了垂盆草可有效促进人肝癌细胞积累脂质的代谢并同时具有抑制脂质合成的作用,因此,本试验主要以在饲料中添加垂盆草水提物后,通过血液学指标测定、病理学观察及肝脏肉碱棕榈酰转移酶I (Carnitine Palmityl Transferase-1,CPT-1)、过氧化物酶体增殖物激活受体-α (Peroxisome Proliferatoractivated Receptor-α,PPAR-α)及 肿 瘤 坏 死 因 子 -α(Tumor Necrosis Factor-α,TNF-α) mRNA 的表达量变化来评估和研究垂盆草对草鱼脂肪肝的保护作用及机理,旨在为探索更有效的治疗草鱼脂肪肝疾病提供基础理论依据。
1 材料与方法
1.1 材料
主要试剂: 垂盆草提取物(CPC.TC10),由成都三阳科技有限公司提供(将 20kg生药,传统水提浓缩,真空冻干,最终得到3kg粉末状提取物); 鱼油,购自青岛永丰生物科技有限公司; 大豆油,购自益海嘉里食品营销有限公司。
谷丙转氨酶(ALT)、谷草转氨酶(AST)、甘油三酯(TG)和总胆固醇(CHO)的检测试剂盒,均购自南京建成生物工程研究所。Trizol plus购自TaKaRa公司。
实验动物: 购自成都市邛崃水产养殖场。
1.2 方法
1.2.1 饲养管理 试验草鱼为同一批孵化草鱼,购自成都市邛崃水产养殖场,初始体重为(12±1.5)g,经氯化钠溶液浸泡消毒后暂养在80×75×60cm的静水水族箱中,控制水体水温在 26—28°C之间,pH 7.5,溶氧为5 mg/L左右,氨氮低于0.02 mg/L。试验过程中每 2天换水 1次,换水量为原来水量的 1/4—1/3,换水的同时抽去残饵和粪便,水源为经曝气后的自来水,试验周期为12周。
1.2.2 造模期间试验分组与饲料配制 造模 1—6周期间,选取规格均一健康草鱼360尾,随机平均分到12个水族箱中,然后将12个水族箱随机分为4组,每组设置3个重复。四个处理组分别为: 基础组、高脂组、1200mg/kg剂量组和 300mg/kg剂量组。参考汪开毓等(2012)报道的饲料中脂肪比例进行配合饲料设计并进行制作四组等氮饲料。造模过程中: 基础组投喂基础饲料(粗蛋白 30.5%),其中高脂组(粗蛋白30.5%)、1200mg/kg (粗蛋白 30.5%)剂量组和300mg/kg (粗蛋白30.5%)剂量组投喂高脂饲料,共饲喂6周,每天投喂率为3%。造模第6周结束后,各组分别进行称重、临床及组织病理学观察,当高脂组、1200mg/kg剂量组和 300mg/kg剂量组均出现明显的内脏脂肪堆积和血清学指标发生明显升高及肝细胞脂肪变性时,进行治疗试验。
1.2.3 治疗期间试验分组与饲料配制 治疗 1—6周期间,1200mg/kg剂量组、300mg/kg剂量组开始投喂加药饲料(高脂饲料+1200mg/kg垂盆草水提物、高脂饲料+300mg/kg垂盆草水提物),进行6周的治疗,其余两组饲料仍按造模期间饲料投喂。在每天的9: 00 am,12: 00 am,6: 00 pm,按草鱼体重的3%投喂饲料,并在投喂加药饲料后每隔 2周检测一次血清指标并称重,随时观察鱼体健康状况,记录死亡情况。
1.3 血清采集与相关指标的测定
试验期间,在造模结束的第6周和治疗的第2、4和 6周进行取样检测,取样前将试验草鱼禁食 24h,各组随机抽取6尾,进行尾静脉采血。血液样品置于4°C冰箱,静置3 h后,4°C下,4000 r/min离心 10min,采集上层血清,4°C存放,用于谷丙转氨酶(ALT)、谷草转氨酶(AST)、甘油三酯(TG)和总胆固醇(CHO)含量的测定。
1.4 肝脏采样与病理切片制作
在无菌条件下剥离肝脏,单独将治疗6周后所取的部分肝脏组织固定于 4%中性福尔马林中,制作病理切片后进行 H.E.染色和苏丹染色,并将其余部分于–80°C 中冻存,用于总 RNA 的提取,以进行CPT-1、PPAR-α、TNF-α表达量的半定量检测。
1.5 CPT-1、PPAR-α和 TNF-α基因mRNA表达的半定量检测
1.5.1 引物设计 参考 GenBank已公布的草鱼CPT-1(登录号: JF728839)、PPAR-α(登录号: FJ231987,FJ849065)、TNF-α(登录号: HQ696609,JQ040498)使用Primer 5.0和Oligo 7.0软件设计RT-PCR引物,引物序列送至生工生物工程(上海)股份有限公司合成。β-actin基因应用本实验室已报道的序列(表 1) (汪开毓等,2012)。
1.5.2 PCR扩增和产物半定量分析 反转录: 称取0.1g肝脏组织,采用Trizol试剂(TaKaRa公司),提取治疗 6周各组草鱼肝脏总 RNA,1%琼脂糖凝胶电泳分析总 RNA提取效果后,用紫外分光光度计测定RNA浓度。提取的总RNA经过37°C 15min,85°C 5s的反转录后,合成cDNA (TaKaRa公司: DRRO14S)。各组的cDNA样品保存于–20°C。
以合成的cDNA为模板,扩增目的片段。反应体系为 50 μL; CPT-1、PPAR-α、TNF-α 基因的反应参数为: 94°C 5 min; 94°C 30 s,55°C 30 s ,72°C 1 min,共30个循环; 72°C 5 min。β-actin反应参数为: 94°C 5 min; 94°C 30 s,59.4°C 30 s,72°C 1 min,共 30 个循环; 72°C 5 min。PCR产物经2%的琼脂糖凝胶电泳分析后,用Quantity One 462软件分析条带丰度,并计算各基因相对表达量。
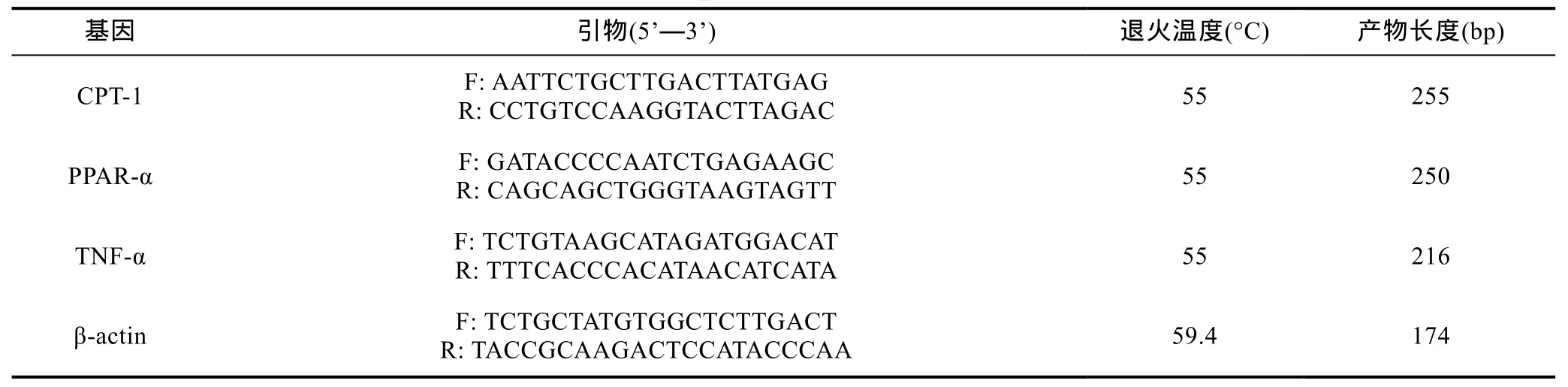
表1 RT-PCR引物序列Tab.1 List of primers used for the RT-PCR
1.6 统计分析
Quantity One 462软件分析所得数据采用Spss16.0软件进行统计学分析,各组相同指标的数据进行单因素方差分析,结果用“±SD”表示,P<0.05表示差异显著,P>0.05表示差异不显著。
2 结果
2.1 试验期间草鱼生长情况及血清生理与生化指标变化
2.1.1 造模 6周草鱼生长情况及血清生理与生化指标测定 由表2可知,在造模第6周结束时基础组草鱼体重显著高于高脂饲料投喂的高脂组、1200mg/kg剂量组和300mg/kg剂量组(P<0.01)。高脂组草鱼各生理生化指标的检测结果表明: 高脂组、1200mg/kg剂量组、300mg/kg剂量组各生化指标与基础组相比出现显著性变化,ALT、AST、TG和CHO指标分别表现为不同水平的显著升高(P<0.01)。
2.1.2 治疗6周血清生理与生化指标的测定 由表3可知,整个治疗期间,高脂组体重显著低于其它三组(P<0.01),试验第 2、4周时,1200mg/kg剂量组与300mg/kg剂量组草鱼体重差异不显著,而试验的第 6周,1200mg/kg剂量组体重显著高于300mg/kg剂量组(P<0.01)。
治疗第 2周结束后,1200mg/kg剂量组与300mg/kg剂量组草鱼血清 ALT水平为 5.89 U/L和7.53 U/L,均同时极显著低于高脂组的 23.71 U/L(P<0.01)。其中,1200mg/kg剂量组与300mg/kg剂量组ALT水平差异具有统计学意义(P<0.01); AST水平分别为7.35 U/L和9.56 U/L,均同时极显著低于高脂组 43.68 U/L (P<0.01),且 1200mg/kg剂量组与300mg/kg剂量组差异显著(P<0.05); TG水平分别为1.96mmol/L和 2.55mmol/L,与高脂组无显著性差异(P>0.05); CHO含量分别为3.97mmol/L和4.91mmol/L均显极著低于高脂组的5.86mmol/L (P<0.01)。
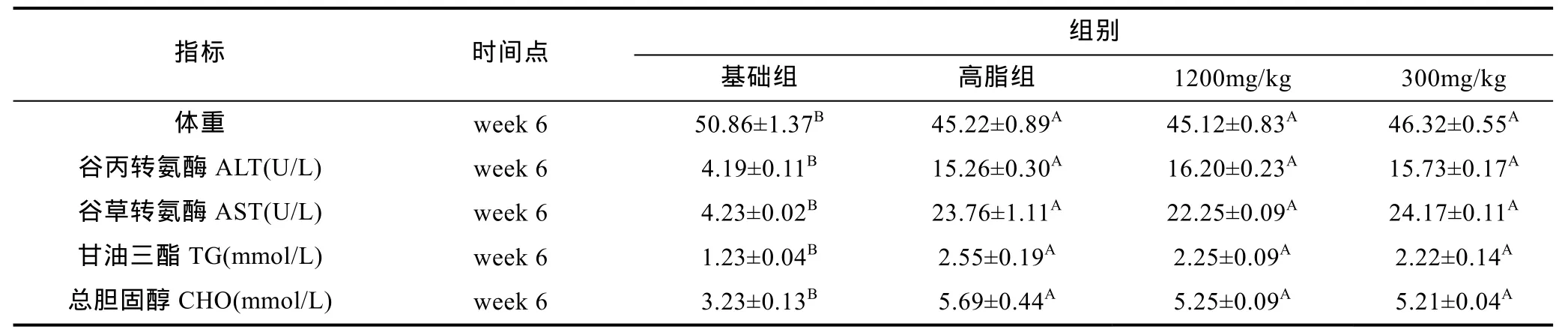
表2 造模6周后各组草鱼生理指标的变化Tab.2 The physiological changes of C. idellus after modeling for 6 weeks
治疗第 4周结束后,1200mg/kg剂量组与300mg/kg剂量组草鱼血清 ALT水平为 4.97 U/L和5.76 U/L,均同时极显著低于高脂组的 49.60 U/L(P<0.01)。其中,1200mg/kg剂量组 ALT水平与300mg/kg剂量组,差异不具有统计学意义(P>0.05);AST水平分别为6.63 U/L和7.59 U/L,均极显著低于同期高脂组的57.94 U/L(P<0.01),其中1200mg/kg剂量组与300mg/kg剂量组AST水平差异具有统计学意义(P<0.05); TG水平分别为1.77mmol/L,和1.91mmol/L,均极显著低于同期高脂组的 2.56mmol/L (P<0.01);CHO含量分别为4.07mmol/L和4.55mmol/L,均极显著低于同期高脂组的 6.14mmol/L (P<0.01),其中,1200mg/kg剂量组与300mg/kg剂量组CHO水平差异具有统计学意义(P<0.05)。
治疗第6周结束后,1200mg/kg剂量与300mg/kg剂量组草鱼血清ALT水平为4.60 U/L和5.39 U/L,均同时极显著低于高脂组的 53.30 U/L(P<0.01)。其中,1200mg/kg剂量组ALT水平与300mg/kg剂量组,差异具有统计学意义(P<0.05); AST水平分别为 6.60 U/L和 7.13 U/L,均极显著低于同期高脂组的 59.61 U/L(P<0.01),其中1200mg/kg剂量组与 300mg/kg剂量组 AST水平差异不具有统计学意义(P>0.05); TG水平分别为1.51mmol/L和1.60mmol/L,均极显著低于同期高脂组的2.62mmol/L (P<0.01),其中1200mg/kg剂量与 300mg/kg剂量组 SOD水平差异不具有统计学意义(P>0.05); CHO 含量分别为 3.97mmol/L和4.67mmol/L,均极显著低于同期高脂组的 6.41mmol/L(P<0.01),其中,1200mg/kg剂量组与300mg/kg剂量组CHO水平差异具有统计学意义(P<0.01)。
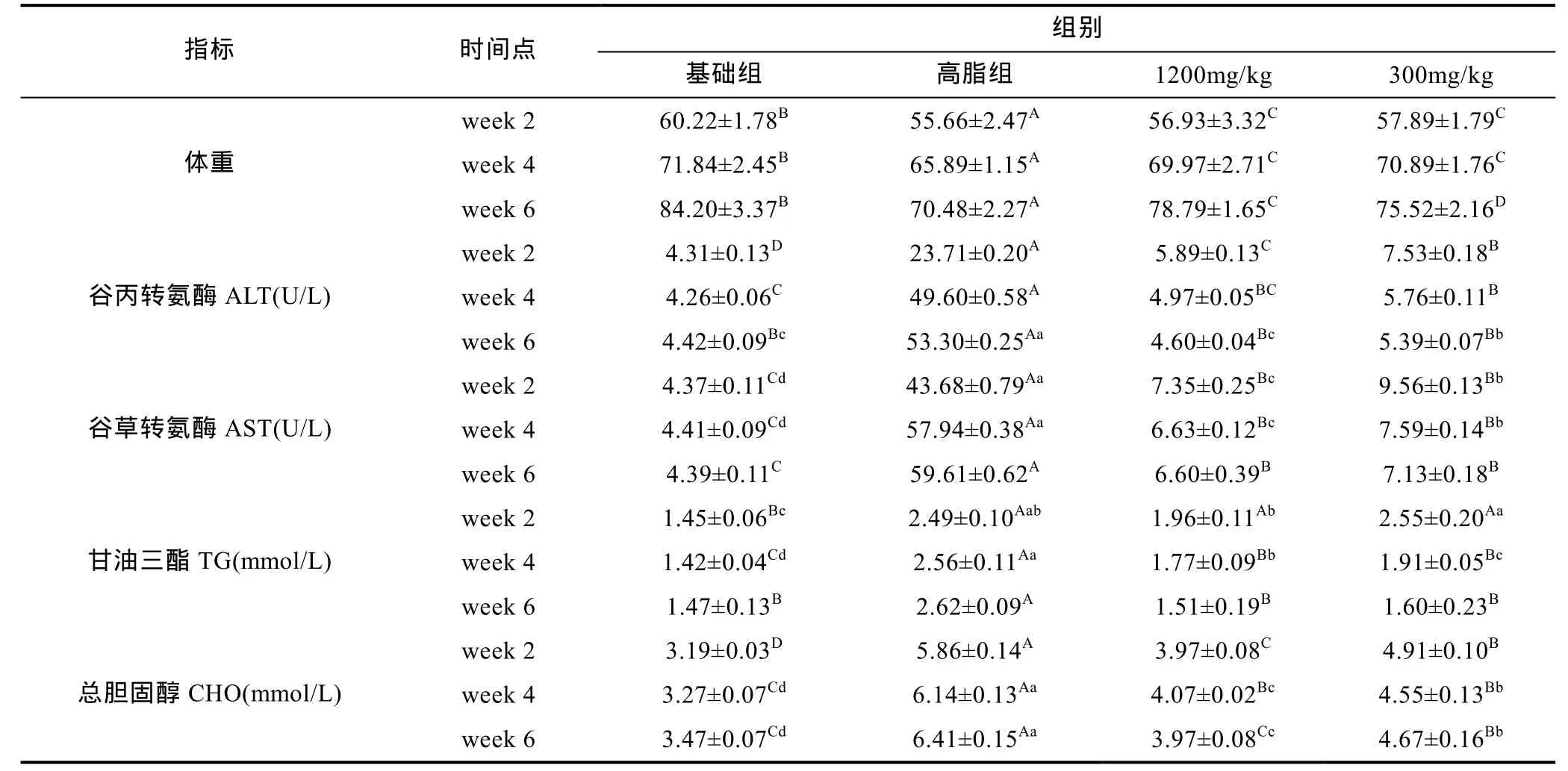
表3 治疗6周内各组草鱼生理指标的变化Tab.3 The physiological changes of C. idellus within 6 weeks of treatment
2.2 治疗6周草鱼肝脏组织形态学观察
组织病理学观察结果表明,经过加药饲料的投喂,在治疗的第6周结束后基础组(图1a,b): 肝细胞大小一致,细胞核蓝染,位于细胞中央; 胞浆均质红染,内有少量脂滴。高脂组(图1c,d): 肝细胞形似脂肪细胞,胞核被挤向边缘,胞内脂滴融合为大空泡,苏丹Ⅲ染色呈现大量脂滴; 与高脂组相比,1200mg/kg剂量组(图1e,f)与300mg/kg剂量组(图1g,h)在治疗6周后取样观察时,发现肝细胞脂肪变性的程度有所降低,脂滴有一定程度的减少。
2.3 治疗6周总RNA的鉴定及样品检测
总 RNA经紫外分光光度计检测纯度和定量A260/A280值在 1.8—2.0之间,表明纯度高、污染低且无降解,可以作为逆转录模版。各组CPT-1、PPAR-α、TNF-α和β-actin基因扩增产物如图2所示。
利用Quantity One 462软件对β-actin、CPT-1、PPAR-α及TNF-α的RT-PCR扩增产物进行进一步的数据分析,结果可知: 试验治疗第6周结束后1200mg/kg剂量组和300mg/kg剂量组的肝脏CPT-1 mRNA相对表达量为1.42和1.15均高于同期高脂组相对表达量且差异极显著(P<0.01); PPAR-α mRNA表达量分别为1.49和、1.43均高于同期高脂组且差异极显著(P<0.01); 1200mg/kg剂量组TNF-α mRNA表达量为1.11,低于同期高脂组且差异极显著(P<0.01)(表4)。

图1 治疗6周后草鱼肝脏病理组织学变化Fig.1 Pathological changes of the C. idellus hepatopancreas after treatment for 6 weeksa. 基础组: 肝细胞形态正常,细胞核居中,胞质均质红染(H.E.); b. 基础组: 肝细胞红染脂滴体积较小(Sudan Ⅲ); c. 高脂组: 肝细胞形似脂肪细胞,胞核边移,胞浆内出现大的脂滴空泡(H.E); d. 高脂组: 肝细胞内出现大量红染脂滴(Sudan Ⅲ); e. 1200mg/kg剂量组(第12周): 肝细胞肿胀,胞浆内脂滴空泡相对于高脂组有所减少(H.E); f. 1200mg/kg剂量组(第12周): 肝细胞内红色脂滴有所减少(Sudan Ⅲ);g. 300mg/kg剂量组(第12周): 肝细胞肿胀,胞浆内脂滴空泡轻微减少(H.E); h. 300mg/kg剂量组(第12周): 肝细胞内红色脂滴相对减少(Sudan Ⅲ)
3 讨论
本研究中,通过对健康草鱼进行连续6周投喂高脂饲料,使得鱼体ALT、AST、TG和CHO血液指标升高,说明肝组织出现了严重的损伤,部分细胞内的酶进入血液,导致血液中相应酶含量增加,并由于持续的高脂饮食导致鱼体摄入过量的脂肪酸,使血清TG和CHO水平升高,另外病理组织学显示肝细胞严重脂肪变性,说明本次研究成功建立了草鱼脂肪性肝损伤模型(Duet al,2006)。作为保肝降酶特效药景天科植物垂盆草(Sedum sarmentosumBunge),近年来主要用于慢性病毒性肝炎的治疗,其有效成分对人肝癌细胞脂质代谢具有调控作用,并同时抑制癌细胞的增殖(Huanget al,2010; Morikawaet al,2012),且通过抑制炎性渗出而有效降低血清中 ALT水平(Junget al,2008); 除此之外,Oh等(2004)报道了垂盆草黄酮成分可抑制血管紧张素转化酶(ACE)的活性,有效缓解高血压等一系列心血管疾病。但这些研究结果主要是针对小鼠等哺乳类动物,而关于草鱼脂肪肝脂质代谢调控等方面的研究,本文尚属首次报道。
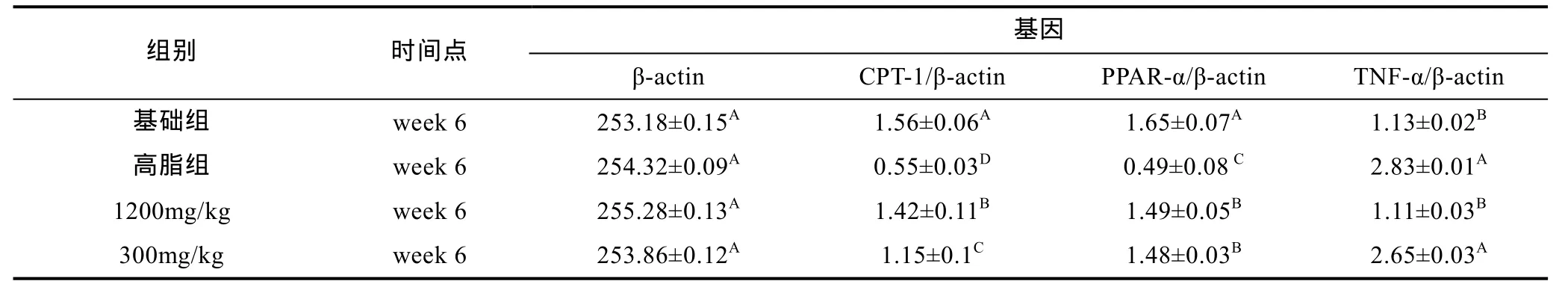
表4 治疗6周结束后草鱼肝脏不同基因mRNA表达的情况Tab.4 The effect of C. idellus hepatopancreas on different gene mRNA expressions after 6 weeks of treatment
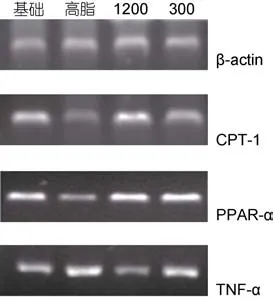
图2 治疗第6周结束草鱼肝脏不同基因mRNA表达情况Fig.2 The effect of C. idellus epatopancreas on different gene mRNA expressions after 6 weeks of treatment
投喂加药饲料 6周后,1200mg/kg剂量组、300mg/kg剂量组的ALT、AST水平显著降低(P<0.01),说明垂盆草可通过降低血清 ALT、AST水平对肝细胞起保护作用。由于持续投喂高脂饲料导致草鱼肝脏摄取脂肪酸增多,造成草鱼血清TG和CHO水平的升高,出现类似哺乳动物的高血脂症症状(汪开毓等,2012),是引起草鱼脂肪肝的重要因素。本试验在投喂添加垂盆草的药物饲料治疗4周后,血清TG和CHO已经开始显著降低(P<0.05),且在试治疗 6周结束时1200mg/kg剂量组TG和CHO水平已降低到基础组正常水平,说明垂盆草水提物可通过促进肝细胞内脂肪酸氧化,抑制其积累而减少TG和CHO释放入血,来有效降低持续高脂饲料导致的患病草鱼 TG和CHO的升高,与 1200mg/kg剂量组改善肝细胞脂肪变性组织病理学观察结果一致。
CPT-1、PPAR-α作为体内脂肪代谢过程中重要的调控酶类,其表达量的变化可反应体内脂类代谢情况(Hsuet al,2007),治疗6周后1200mg/kg、300mg/kg剂量组 CPT-1 mRNA的相对表达量显著升高,与Kuwashiro等(2011)研究替米沙坦改善高脂造成的青鱂鱼非酒精性脂肪肝模型中的结果相符,这说明了垂盆草水提物可促进脂肪酸代谢,从而使得大量堆积的脂肪酸进入线粒体进行 β-氧化,这初步反应了垂盆草水提物对草鱼脂肪肝的保护作用。PPAR-α主要在肝脏表达,可通过对肝内脂肪酸氧化相关基因表达的调控,对肝脏脂质转运中起重要作用(Reddy,2001),治疗6周后,1200mg/kg剂量组、300mg/kg剂量组 PPAR-α mRNA 的相对表达量均显著升高(P<0.01),与Zhou等(2008)报道的小檗碱缓解大鼠高脂血症肝脏PPAR-α的表达中结果一致,这说明垂盆草可通过促进PPAR-α mRNA的表达,从而使得一系列与肝内脂肪酸代谢有关的蛋白质、酶基因的转录水平相应的升高,最终提高脂肪酸的氧化与脂蛋白的合成,有效缓解了鱼类肝脏的脂肪病变(Kuwashiroet al,2011)。此外,已有研究表明,肝细胞TNF-α的表达量的变化,可直接反应出脂类和葡萄糖的代谢情况,对脂肪肝发病早期及其进展均有作用,是肝细胞坏死的一个关键步骤,其致病机制主要是通过自身高表达来降低PPAR-a mRNA的表达量进而促进脂肪肝的形成(Valentiet al,2002; Glosliet al,2005); 本研究中,投喂高脂饲料6周后,高脂组TNF-α mRNA表达量显著于基础组,而经过投喂6周的加药饲料治疗后,1200mg/kg剂量组TNF-α mRNA相对表达量极显著低于高脂组(P<0.01),这反映出垂盆草可通过抑制TNF-α mRNA 的表达从而抑制高脂饮食造成的脂质积累,佐证了垂盆草高剂量组显著改善草鱼肝细胞脂肪变性的结果。
综上所述,以上三个基因半定量检测结果说明垂盆草可通过促进 CPT-1和 PPAR-α的表达,抑制TNF-α表达,来提高肝细胞内脂肪酸的代谢速率; 同时文中组织病理学观察与血液生化指标的变化均显示,垂盆草可缓解草鱼由高脂饮食造成的脂肪性肝病。以上结果可为生产上解决鱼类脂肪性肝病提供理论依据,进而为后期试验研究提供有效数据。
向朝林,2011. 草鱼(Ctenopharyngodon idellus)硫代乙酰胺肝损伤实验模型建立及其应用研究. 苏州: 苏州大学硕士学位论文,11—12
汪开毓,苗常鸿,黄锦炉等,2012. 投喂高脂饲料后草鱼主要生化指标和乙酰辅酶A羧化酶1 mRNA表达的变化. 动物营养学报,24(12): 2375—2383
Du Z Y,Clouet P,Zheng W Het al,2006. Biochemical hepatic alterations and body lipid composition in the herbivorous grass carp (Ctenopharyngodon idella) fed high-fat diets.British Journal of Nutrition,95(5): 905—915
Du Z Y,Liu Y J,Tian L Xet al,2005. Effect of dietary lipid level on growth,feed utilization and body composition by juvenile grass carp (Ctenopharyngodon idella). Aquaculture Nutrition,11(2): 139—146
Glosli H,Gudbrandsen O A,Mullen A Jet al,2005.Down-regulated expression of PPARα target genes,reduced fatty acid oxidation and altered fatty acid composition in the liver of mice transgenic for hTNFα. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids,1734(3): 235—246
Hsu S-C,Huang C-J,2007. Changes in liver PPARα mRNA expression in response to two levels of high-safflower-oil diets correlate with changes in adiposity and serum leptin in rats and mice. The Journal of Nutritional Biochemistry,18(2): 86—96
Huang D D,Zhang W Y,Huang D Qet al,2010. Antitumor activity of the aqueous extract fromSedum sarmentosumbungeIn vitro. Cancer Biotherapy and Radiopharmaceuticals,25(1): 81—88
Jung H-J,Kang H-J,Song Y Set al,2008. Anti-inflammatory,anti-angiogenic and anti- nociceptive activities ofSedum sarmentosumextract. Journal of Ethnopharmacology,116(1):138—143
Kuwashiro S,Terai S,Oishi Tet al,2011. Telmisartan improves nonalcoholic steatohepatitis in medaka (Oryzias latipes) by reducing macrophage infiltration and fat accumulation. Cell and Tissue Research,344(1): 125—134
Lian L H,Jin X J,Wu Y Let al,2010. Hepatoprotective effects ofSedum sarmentosumon D-galactosamine/lipopolysaccharideinduced murine fulminant hepatic failure. Journal of Pharmacological Sciences,114(2): 147—157
Morikawa T,Ninomiya K,Zhang Yet al,2012. Flavonol glycosides with lipid accumulation inhibitory activity fromSedum sarmentosum. Phytochemistry Letters,5(1):53—58
Muraoka O,Morikawa T,Zhang Yet al,2009. Novel megastigmanes with lipid accumulation inhibitory and lipid metabolism-promoting activities in HepG2 cells fromSedum sarmentosum. Tetrahedron,65(21): 4142—4148
Oh H,Kang D-G,Kwon J-Wet al,2004. Isolation of angiotensin converting enzyme (ACE) inhibitory flavonoids fromSedum sarmentosum. Biological and Pharmaceutical Bulletin,27(12): 2035—2037
Reddy J K,2001. Nonalcoholic steatosis and steatohepatitis. III.Peroxisomal beta-oxidation,PPAR alpha,and steatohepatitis.American Journal of Physiology-Gastrointestinal and Liver Physiology,281(6): G1333—G1339
Valenti L,Fracanzani A L,Dongiovanni Pet al,2002. Tumor necrosis factor α promoter polymorphisms and insulin resistance in nonalcoholic fatty liver disease. Gastroenterology,122(2): 274—280
Wilson R P,Poe W E,1988. Choline nutrition of fingerling channel catfish. Aquaculture,68(1): 65—71
Zhou J Y,Zhou S W,Zhang K Bet al,2008. Chronic effects of berberine on blood,liver glucolipid metabolism and liver PPARs expression in diabetic hyperlipidemic rats.Biological and Pharmaceutical Bulletin,31(6): 1169—1176

