Cox回归分析肝动脉化疗栓塞对大肠癌肝转移的疗效和预后的影响
陈 慧 ,韩建军 ,李 健 ,张建新
(1.山东省交通医院信息中心,山东 济南250031;2.山东省肿瘤医院介入科,山东 济南 250117)
大肠癌又称结直肠癌,近年来其发病率呈明显上升趋势[1]。远处转移是大肠癌患者的主要死亡原因,其中肝转移最常见,是影响大肠癌预后的重要因素。肝转移患者自然病程很短,预后较差,如果不进行积极的治疗,其中位生存期仅6~9个月[2-3]。目前临床上较常用的是TACE治疗大肠癌肝转移,效果明显好于单纯的静脉化疗[4]。本研究采用COX回归分析,分析影响TACE治疗的大肠癌肝转移患者预后的因素。
1 资料与方法
1.1 一般资料 随机选取山东省肿瘤医院2010年6月至2013年2月86例经穿刺或病理证实的TACE治疗后的结直肠癌肝转移患者,男66例,女20例;年龄37~79岁,中位年龄60岁;80例为大肠癌术后有明确病理诊断者,6例未行手术切除原发灶经穿刺病理证实。其中,腺癌75例,印戒细胞癌1例,其他如恶性间质瘤、未分化癌4例,随访率95.4%。单发转移灶32例,多发54例,直径1.95~12 cm,均为不能手术切除的晚期患者,白细胞≥3.0×109/L,血小板≥50×109/L;肝肾功能检验值在正常参考值3倍以内。所有患者无其他严重伴随疾病。KPS评分60~90分。
1.2 TACE方法 患者均采用 Seldinger’s穿刺技术,右侧股动脉进针,将导管超选至肿瘤供血动脉,造影显示肿瘤染色明显则为肿瘤富血供,反之为肿瘤乏血供。灌注药物:5-氟尿嘧啶1.0 g,亚叶酸钙0.2 g,奥沙利铂150 mg;后注入碘油5~20 mL与阿霉素30 mg混合乳剂,1 mm×1 mm×1 mm明胶海绵栓塞肿瘤供血动脉。治疗结束后加压包扎,患者平卧24 h,常规保肝、止吐、止酸治疗。
1.3 疗效评价 TACE治疗4周后,行CT或MRI扫描,测量肿瘤最长径。根据WHO标准,参考陈智伟等[5]的标准评定疗效:完全缓解(CR),所有病灶消失,无新发病灶,肿瘤标记物下降至正常,维持4周以上;部分缓解(PR),所有病灶最长径总和减小≥30%,并维持4周以上;无变化(SD),所有病灶最长径总和缩小但未达PR;进展(PD),病灶最长径总和增大≥20%,或出现新病灶。以CR+PR来计算治疗总有效率。
1.4 随访 随访截止日期为2013年12月,所有患者每1个月随访1次,每次行CT或MRI扫描、检测肝肾功能和肿瘤标志物CEA、CA19-9。CT显示碘化油栓塞肿瘤≥1/2为沉积良好,碘化油栓塞肿瘤<1/2沉积欠佳。
1.5 统计学分析 利用SPSS 13.0软件,计算患者的中位生存期和0.5、1、2、3年累积生存率;对可能影响TACE疗效的因素进行多元回归多因素分析。
2 结果
2.1 临床资料比较(表1) 性别、年龄、确诊时CEA和CA19-9水平是否升高与患者的中位生存期没有密切关系,差异无统计学意义(P>0.05)。肿瘤大小、有无肝外转移、单发或多发、累及肝叶数、大肠癌病理分化程度与大肠癌肝转移TACE治疗后的中位生存期关系密切,差异有统计学意义(P<0.05)。
2.2 大肠癌肝转移TACE治疗的有效率 截止到随访结束日期完整随访患者82例,死亡76例,存活10例,失访4例,失访率为4.7%。生存时间进行统计,中位生存期为(20.0±1.5)个月,95%可信区间为15.1~25.3 个月;0.5、1、2、3 年累积生存率分别为 90.8%、73.6%、38.1%、11.0%。 86例中 4例(4.7%)完全缓解,40例(46.5%)部分缓解,总有效率为51.2%。
2.3 大肠癌肝转移TACE治疗后的不良反应 所有患者在TACE治疗后,出现不同程度的低热、右上腹胀痛、谷丙转氨酶轻度升高、消化道反应、骨髓抑制、食欲下降等,予以对症支持治疗后,均可好转。
2.4 影响生存期的因素 经过Cox多变量分析,患者DSA造影示富血供、高中分化、无肝外远处转移、大肠癌原发灶切除、多次TACE治疗、碘化油沉积良好等6项因素的相对危险度(RR)的95%CI<1,P<0.05,为大肠肠癌肝转移患者TACE治疗的保护性因素,患者死亡率下降、生存期延长(表2)。
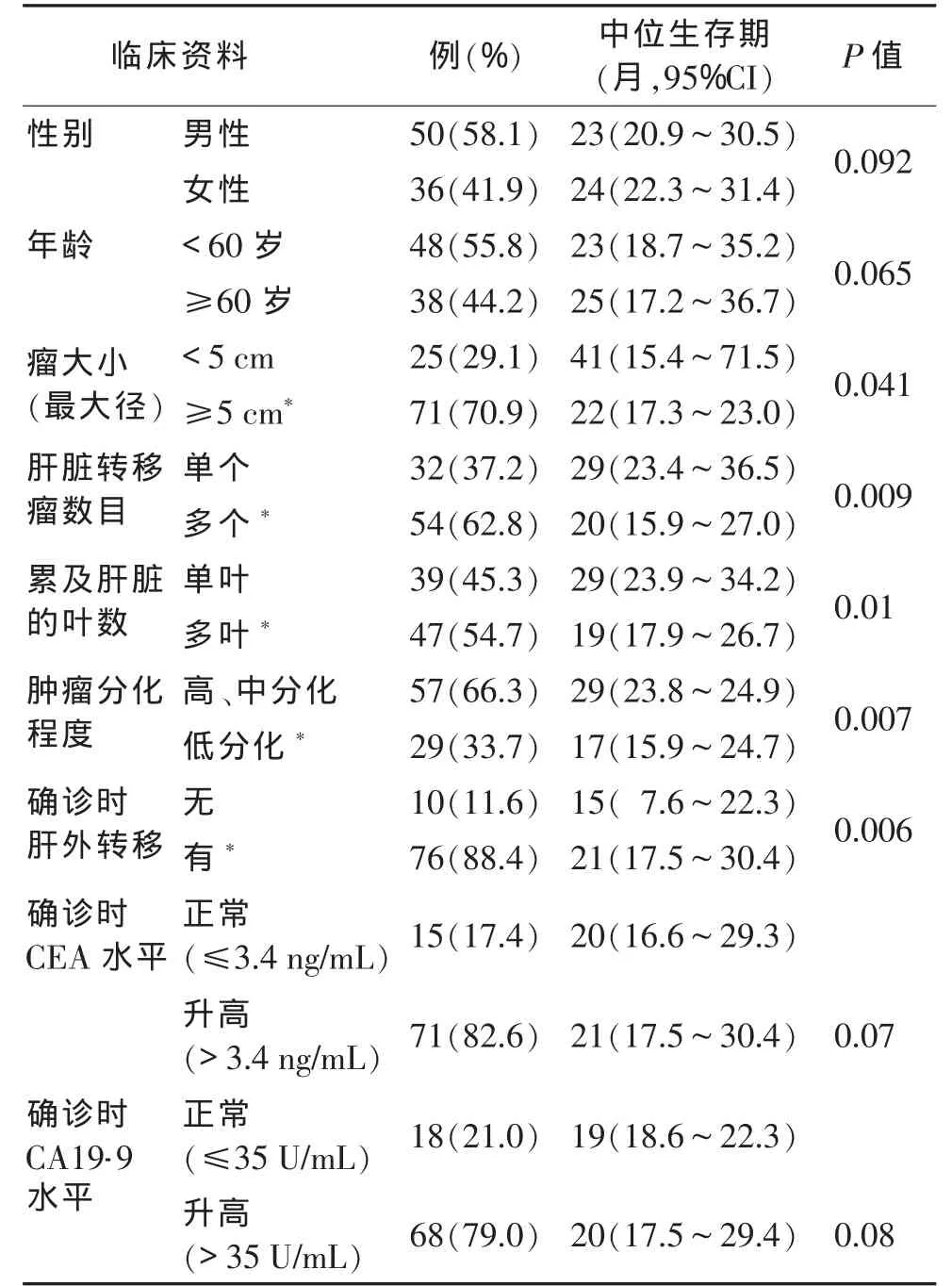
表1 一般性临床资料的比较
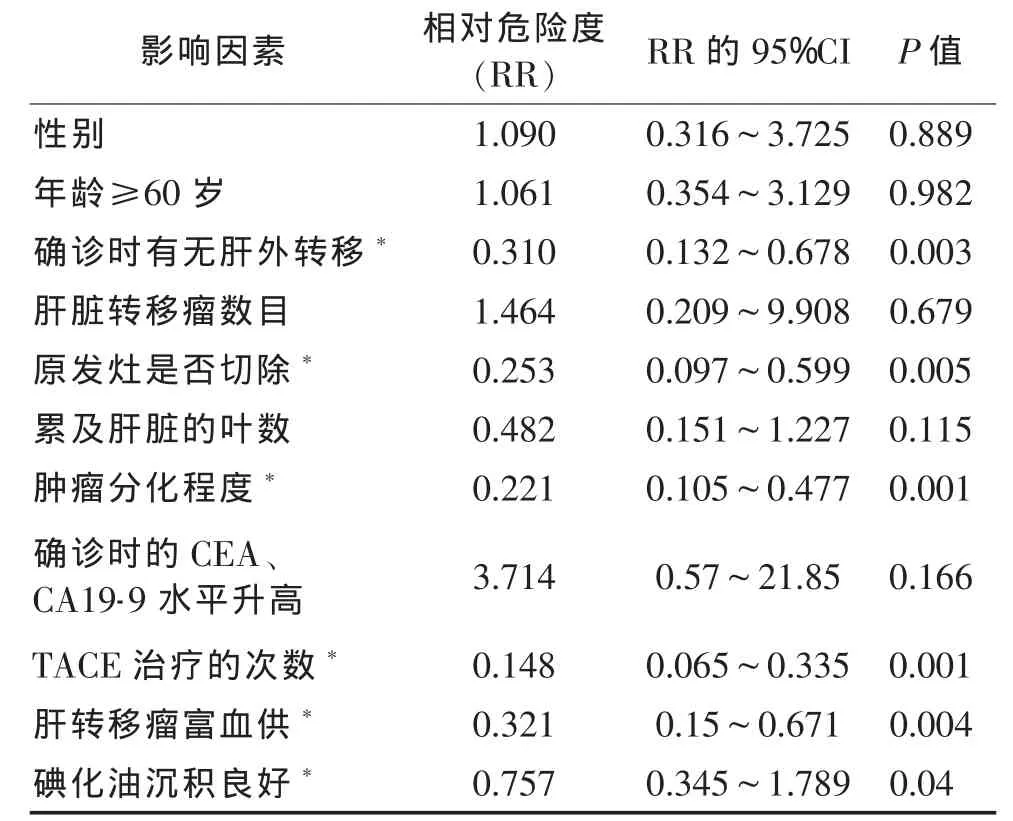
表2 全变量的Cox回归分析结果
3 讨论
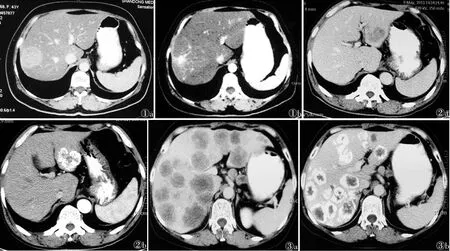
图1 男,67岁,肝脏右叶单发转移 图1a 介入治疗前转移瘤有明显动脉期强化 图1b 治疗后病灶明显减小,可见碘油沉积 图2女,58岁,肝脏左叶单发肝转移 图2a TACE之前可见静脉期强化 图2b 治疗后肿瘤碘化油沉积明显 图3 男,70岁,肝脏多发转移病灶 图3a 肝脏各叶多发转移病变,术前可见静脉期均有强化 图3b 治疗后可见有病变明显的碘化油沉积,多数病灶缩小
肝脏是胃肠道恶性肿瘤最常见的转移器官,具有非常丰富的血供,其中门静脉占70%~75%,肝动脉占20%~25%,是双重血供[6]。门静脉与肝动脉分支形成小叶间动、静脉,最终共同汇入肝血窦。肝脏血窦通透性大,内皮细胞之间有无基底膜覆盖的0.1 mm间隙,有利于肿瘤细胞的进入,门静脉的血流变和解剖结构为胃肠道恶性肿瘤肝转移提供了基础。肝血窦结构有利于瘤细胞停留、生长,进而形成转移瘤。大肠癌肝转移以门静脉血行转移为主要的转移方式,一般是多发的[7]。单发的肝转移瘤可行手术切除,多发一般不能切除,真正手术仅10%~20%[8]。无法手术切除的大肠癌肝转移的姑息性治疗,TACE目前认为应是首选的,疗效确切[9-10]。
TACE治疗是针对肝肿瘤的病灶直接进行治疗的一种微创的方法,具有创伤小、疗效确切、安全、可多次进行的特点[11]。动脉灌注化疗可以增加肿瘤灶局部内的药物浓度,对正常组织的影响小,到达肿瘤局部的药物浓度比全身静脉化疗相比肿瘤组织的药物浓度高10~20倍[12]。化疗药物抑制癌细胞的效果与药物浓度呈正相关,所以癌细胞死亡明显增加[13-14]。抗癌药物与碘油混合乳化后,因碘化油乳剂可以将抗癌药物在肿瘤组织内缓慢慢释放,高浓度抗癌药物可持续杀伤癌细胞[15]。同时,碘化油乳剂栓塞肿瘤的微血管,碘化油不易被肿瘤组织所代谢,超液态碘化油颗粒极小,可阻止肿瘤形成侧支循环,肿瘤的营养血供中断,引起肿瘤缺血坏死[16-17]。TACE还可诱导肝转移瘤细胞的凋亡,可能作用机制为:①化疗药物的首过效应,局部应用的化疗药物通过损伤DNA诱导凋亡,促进促凋亡基因表达增高,抑制凋亡抑制基的表达,使肿瘤细胞进入凋亡程序而发挥细胞毒类药物的抗肿瘤作用[18];②TACE治疗后肿瘤组织缺血、缺氧,进而诱导促凋亡基因高表达;肿瘤的坏死因子表达增高,也可诱导癌细胞凋亡[19]。
全身化疗常用的药物是以氟尿嘧啶+亚叶酸钙为基础的化疗,加上奥沙利铂或伊立替康作为一线化疗方案可将疗效提高39%左右[20]。本课题选择以5-氟尿嘧啶+亚叶酸钙+奥沙利铂为治疗方案,同时加入阿霉素30 mg进行栓塞。TACE治疗后主要不良反应是一过性的肝功能损伤和栓塞后综合征等,给予止吐、止痛等对症处理后均能缓解。
本研究经过Cox的回归模型进行多因素分析,得出经TACE治疗的大肠癌肝转移患者的中位生存期为(20±1.8)个月;0.5、1、2、3 年累积生存率分别为90.8%、73.2%、38.2%、14.1%。 高中分化肝转移瘤、原发灶切除、多次介入治疗、转移瘤为富血供、无肝转移这几个保护性因素,有助于提高TACE疗效及患者生存率。对于大肠癌肝转移患者,TACE是安全、有效的治疗方法,值得推广。
[1]万德森,陈功.结直肠癌的流行病学及其危险因素研究近况[J].实用癌症杂志,2000,15(2):220-222.
[2] Sadahiro S,Suzuki T,Ishikawa K,et al.Recurrence patterns after curative resection of colorectal cancer in patients followed for a minimum of ten years[J].Hepatogastroenterology,2003,50:1362-1366.
[3] Cokmert S,Ellidokuz H,Demir L,et al.Survival outcomes of liver metastasectomy in colorectal cancer cases:a single-center analysis in Turkey[J].Asian Pac J Cancer Prev,2014,15:5195-5200.
[4]叶涛,王耀辉,夏景林,等.肝动脉化疗栓塞治疗结直肠癌肝转移的疗效和预后影响因素[J]. 中华肿瘤杂志,2012,34(9):706-709.
[5]陈智伟,廖美琳.RECIST标准在肿瘤治疗疗效评价中的应用[J].中国肿瘤,2004,13(10):616-618.
[6]李恺,张绍祥,邱明国,等.肝脏可视化研究在解剖学教学中的应用[J]. 局解手术学杂志,2005,14(1):34-35.
[7] Fiorentini G,Aliberti C,Mulazzani L,et al.Chemoembolization in colorectal liver metastases:the rebirth[J].Anticancer Res,2014,34:575-584.
[8] Akgül O,Cetinkaya E,Ersoz S,et al.Role of surgery in colorectal cancer liver metastases[J].World J Gastroenterol,2014,20:6113-6122.
[9] de Baere T,Deschamps F.Arterial therapies of colorectal cancer metastases to the liver[J].Abdom Imaging,2011,36:661-670.
[10] Ghanaati H,Mohammadzadeh V,Mohammadzadeh A,et al.Efficacy of transarterial chemoembolization on lesion reduction in colorectal liver metastases[J].Acta Med Iran,2012,50:535-540.
[11]徐辉,王滨.肝动脉化疗栓塞对肝癌生物学特性的影响[J].中国中西医结合影像学杂志,2006,4(1):42-45.
[12] Vogl TJ,Zangos S,Eichler K,et al.Colorectal liver metastases:regional chemotherapy via transarterial chemoembolization(TA CE) and hepatic chemoperfusion:an update[J].Eur Radiol,2007,17:1025-1034.
[13] Lubienski A,Simon M,Lubienski K,et al.Update on chemoinfusion and chemoembolization treatments[J].Radiologe,2007,47:1097-1106,1108.
[14] Murata S,Mine T,Sugihara F,et al.Interventional treatment for unresectable hepatocellular carcinoma[J].World J Gastroenterol,2014,20:13453-13465.
[15] Yoshimitsu K.Transarterial chemoembolization using iodized oil for unresectable hepatocellular carcinoma:perspective from multistep hepatocarcinogenesis[J].Hepat Med,2014,6:89-94.
[16] Talenfeld AD,Sista AK,Madoff DC.Transarterial therapies for primary liver tumors[J].Surg Oncol Clin N Am,2014,23:323-351.
[17] Hoffmann RT,Paprottka P,Jakobs TF,et al.Arterial therapies of non-colorectal cancer metastases to the liver(from chemoembolization to radioembolization)[J].Abdom Imaging,2011,36:671-676.
[18] Li Z,Hu DY,Chu Q,et al.Cell apoptosis and regeneration of hepatocellular carcinoma after transarterial chemoembolization[J].World J Gastroenterol,2004,10:1876-1880.
[19] Xiao E,Li D,Shen S,et al.Effect of preoperative transcatheter arterial chemoembolization on apoptosis of hepatocellular carcinoma cells[J].Chin Med J (Engl),2003,116:203-207.
[20] Nelson MA,Shetty S,Kulakodlu M,et al.A comparison of mortality and costs associated with FOLFOX versus FOLFIRI in stage Ⅳ colorectal cancer[J].J Med Econ,2011,14:179-186.

