急性脑梗死患者内皮祖细胞动态变化及其对神经功能的影响
项正兵 屈新辉 王万松 张昆南 吴晓牧(江西省人民医院神经内科 江西省神经病学研究所,江西 南昌 330006)
急性脑梗死患者内皮祖细胞动态变化及其对神经功能的影响
项正兵屈新辉王万松1张昆南吴晓牧
(江西省人民医院神经内科江西省神经病学研究所,江西南昌330006)
〔摘要〕目的探讨脑血管病危险因素对内皮祖细胞(EPCs)的影响以及急性脑梗死患者EPCs和神经功能缺损评分(NIHSS)的动态变化。方法选择60例急性脑梗死、60例脑梗死后遗症、60例具有脑血管病危险因素的患者和30例健康体检者,以CD133和KDR双阳性细胞作为EPCs标记,用流式细胞仪检测外周血EPCs数量,以NIHSS评分评价神经功能缺损程度。分析外周血EPCs数量与脑血管各危险因素的关系以及急性脑梗死患者EPCs数量动态变化与NIHSS评分改善的相关性。结果急性脑梗死组、脑梗死后遗症组、危险因素组患者外周血EPCs数量均低于健康对照组(均P<0.01)。急性脑梗死患者在发病72 h~21 d时,外周血EPCs数量均较发病24 h时间点高(均P<0.05),发病后EPCs逐渐升高,且在14 d时间点达高峰(P<0.01),此后逐渐下降,在30~90 d时EPCs水平与发病24 h无差异(P>0.05)。吸烟史、高血压病史、糖尿病史、高脂血症病史是脑血管病外周血EPCs独立的影响因素。外周血EPCs数量与舒张压、糖化血红蛋白、总胆固醇、低密度脂蛋白呈负相关(均P<0.05),与收缩压、空腹血糖、甘油三酯无关(均P>0.05)。急性脑梗死患者在24 h~14 d时,NIHSS评分随着外周血EPCs上升而改善;脑梗死患者急性期NIHSS评分与外周EPCs呈负相关(均P<0.01) ;在发病后21~90 d时,这种相关性不复存在。结论急性脑梗死患者外周血EPCs数量呈动态变化,且数量上升时患者的神经功能改善。检测外周静脉血EPCs数量可以判断急性脑梗死患者预后。
〔关键词〕急性脑梗死;内皮祖细胞
1南昌大学研究生院医学部
第一作者:项正兵(1984-),男,在读博士,主治医师,主要从事脑血管病研究。
The dynamic variations of peripheral blood endothelial progenitor cells in acute cerebral infarction patients and its impact on the neural function
XIANG Zheng-Bing,QU Xin-Hui,WANG Wan-Song,et al.
Department of Neurology,Jiangxi Provincial People's Hospital,Institute of Neurology of Jiangxi Province,Nanchang 330006,Jiangxi,China
【Abstract】Objective To observe the risk factors of cerebrovascular disease on peripheral endothelial progenitor cells (EPCs) in acute cerebral ischemic(ACI) patients and investigate the correlation with the variations of EPCs and neurological function.Methods Three groups of patients including ACI group (60 cases),cerebral infarction sequel group (60 cases),the risk factors group (60 cases) as well as healthy control group (30 cases) were selected.CD133+/KDR+ cells were considered as EPCs.Peripheral blood EPCs was quantified by flow cytometry assay.The NIH stroke scale(NIHSS) was used to assess the neurological function of patients with ACI group at 24,72 h,7,14,21,30,60 and 90 d after the onset of cerebral infarction.The correlation of cerebrovascular disease risk factors consist of age,gender,past history,smoking history,systolic blood pressure(SBP),diastolic blood pressure(DBP),fasting plasma glucose(FPG),glycosylated hemoglobin (HbA1c),triglycerides(TG),total cholesterol(TC),high density lipoprotein(HDL) and low density lipoprotein(LDL) with peripheral EPCs as well as the correlation with the variations of EPCs in the ACI group and neurological function at different time points after onset were analyzed.Results Compared with those of healthy control group,the number of EPCs in ACI group,cerebral infarction sequel group and the risk factors group were decreased(P<0.01).Compared with 24 h after the onset of cerebral infarction,the number of EPCs during 72 h to 21 d after the onset was increased (P<0.05).EPCs was gradually increased until reaching the peak from the onset to 14 d after ACI(P<0.01),then gradually decreased until reaching the same level during 30~90 d compared with 24 h after onset (P>0.05).Smoking,hypertension,diabetes and hyperlipidemia were independent influence factors of cerebrovascular disease.The number of peripheral EPCs in ACI group,cerebral infarction sequel group and the risk factors group had negative correlation with DBP,HbA1c,TC and LDL(P<0.05),and no correlation with SBP,FPG and TG(P>0.05).The NIHSS score of patients with ACI had negative correlation with peripheral EPCs during 24 h to 14 d after onset (P<0.05) and no correlation after onset of 21 d to 90 d.Conclusions Peripheral EPCs in patients with ACI have a dynamic variations at different time points after onset.With the increase of the number of EPCs,the neurological function is improved.The quantity of peripheral blood EPCs could predict the prognosis of ACI.
【Key words】Acute cerebral infarction; Endothelial progenitor cells
血管内皮损伤是脑梗死重要的病理生理基础,治疗上挽救缺血半暗带、恢复神经元功能均以血管再通和修复为先决条件。当前研究表明,内皮祖细胞(EPCs)能在生理或病理情况下维持血管功能,参与血管内皮修复和血管再生〔1〕。因此,EPCs在脑梗死的发生、发展中可能扮演十分重要角色。本实验拟分析脑血管病各危险因素(高血压、糖尿病、高脂血症、吸烟)对外周血EPCs的影响,以及外周血EPCs水平与患者神经功能评分NIHSS改善的相关性,评估EPCs数量预测脑梗死预后的价值。
1 资料与方法
1.1研究对象选择2010年1月至2013年12月江西省人民医院神经内科住院或门诊患者和医院体检中心体检者。急性脑梗死组:符合全国第四届脑血管病学术会议修订的诊断标准,头颅MRI平扫和弥散加权(DWI)证实,均为首次急性起病,发病24 h内入院;共60例,男32例,女28例,平均年龄(62.2± 4.7)岁,合并高血压23例、糖尿病25例、高脂血症17例、吸烟史24例。脑梗死后遗症组:发病6个月以上,头颅MRI平扫和DWI证实;共60例,男34例,女26例,平均年龄(63.6±4.1)岁,合并高血压23例、糖尿病25例、高脂血症18例、吸烟史23例。危险因素组:既往高血压病、糖尿病、高脂血症或吸烟(20支/d)史患者,头颅MRI平扫无颅内病变;共60例男33例,女27例,平均年龄(61.8±4.3)岁,合并高血压26例、糖尿病24例、高脂血症20例、吸烟史23例。健康对照组:否认高血压、糖尿病、冠心病、高脂血症或吸烟病史;共30例,男16例,女14例,平均年龄(63.5±4.2)岁。危险因素组、脑梗死后遗症组、急性脑梗死组和健康对照组间年龄、性别比较无统计学差异(均P>0.05)。危险因素组、脑梗死后遗症组和急性脑梗死组高血压病史、糖尿病病史、高脂血症病史、吸烟史方面比较无统计学差异(均P>0.05)。
排除标准:心房纤颤、感染性心内膜炎等引起的脑栓塞,重要脏器(心、肺、肝、肾)衰竭,感染性疾病,血液病,恶性肿瘤,结缔组织病,自身免疫性疾病,急性冠脉综合征,下肢栓塞性疾病,近3个月外伤、手术史,近期服用炎症抑制药、免疫抑制剂、激素等药物。
1.2研究方法
1.2.1一般资料收集研究对象基本资料:性别、年龄、既往史(高血压、糖尿病、高脂血症)、吸烟史。
1.2.2生化检查和血压测定急性脑梗死组肘静脉血标本尽可能空腹10 h以上采集,健康对照组、危险因素组、脑梗死后遗症组研究对象均隔夜空腹采集肘静脉血。采用日本日立公司的全自动生化检测仪(型号7600-020)测定空腹血糖(FPG)、甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白(HDL)和低密度脂蛋白(LDL)水平。采用美国PRIMUS公司的ultra2全自动糖化血红蛋白分析仪行高压液相亲和层析法测定糖化血红蛋白(HbA1c)水平。采用水银柱式血压计测定收缩压(SBP)和舒张压(DBP)。
1.2.3EPCs水平检测采用BEACKMAN COULTER公司Epics XL流式细胞仪检测,以聚乙烯(PE)标记的CD34和PerCPCy5.5标记的KDR的双阳细胞为EPCs细胞(个/10万细胞)。
1.2.4神经功能评定采用美国国立卫生研究院卒中量表(NIHSS)评估急性脑梗死患者在24 h、72 h、7 d、14 d、21 d、30 d、60 d、90 d的神经功能缺损程度。
区块链技术是使用块式和链式的存储结构来认证和保存数据,使用共识算法实现生成新区块,使用非对称加密算法保证数据在信道中的安全传输,使用智能合约来处理数据的新型分布式技术。区块链分为私有链、联盟链和公有链。从本质上讲,区块链就是一个去中心化的分布式数据库,任何用户都可以参与到区块链中。用户周围的路由器设备就是一个节点,每个节点都拥有一整套数据的备份,并且各个节点间使用相同的共识机制,通过竞争计算来生成或更新区块链。基于区块链结果的特点,如果任何一个节点失败,其他节点仍能进行正常的工作,且能分辨出是哪一个节点失败。因此,区块链技术解决了传统平台易受攻击或篡改的缺陷。
2 结果
2.1一般临床资料危险因素组、脑梗死后遗症组和急性脑梗死组的SBP、DBP、FPG、HbA1c、TG、TC、HDL、LDL无统计学差异(均P>0.05)。见表1。
表1 各组一般临床资料的比较(±s,n=60)

表1 各组一般临床资料的比较(±s,n=60)
组别 SBP (mmHg) DBP (mmHg) FPG (mmol/L) HbA1c (mmol/L) TG (mmol/L) TC (mmol/L) HDL (mmol/L) LDL (mmol/L)危险因素组 141.8±22.3 84.8±11.0 6.82±2.72 6.58±2.10 1.65±0.34 5.08±1.22 1.18±0.14 3.10±0.34脑梗死后遗症组 143.8±17.0 84.5±11.0 6.59±2.66 6.63±2.40 1.67±0.27 5.09±1.19 1.14±0.16 3.00±0.28急性脑梗死组 141.1±21.5 81.9±11.6 6.38±2.33 6.43±2.10 1.64±0.29 5.15±1.18 1.12±0.12 3.01±0.37 F或χ2值 1.132 1.176 0.432 0.123 2.872 0.062 2.665 3.071 P值 0.568 0.311 0.650 0.884 0.238 0.940 0.072 0.215
2.2外周血EPCs水平入组时外周血EPC数量急性脑梗死组(28.1±7.1)、脑梗死后遗症组(27.1±4.9)、危险因素组(27.5±5.0)比较无统计学差异(P>0.05),均低于健康对照组(41.7±5.2) (均P<0.01)。
急性脑梗死组EPCs水平在72 h(29.9±6.2)、7 d(32.6± 6.5)、14 d(35.5±7.2)、21 d(31.0±6.5)时均比发病24 h高(均P<0.05),可见发病后EPCs数量呈上升趋势,且在14 d时达高峰(P<0.01),此后逐渐下降,至30 d(28.1±7.0)、60 d(28.6± 7.8)和90 d(28.5±8.1)时间点EPCs数量与发病24 h时无统计学差异(P>0.05)。
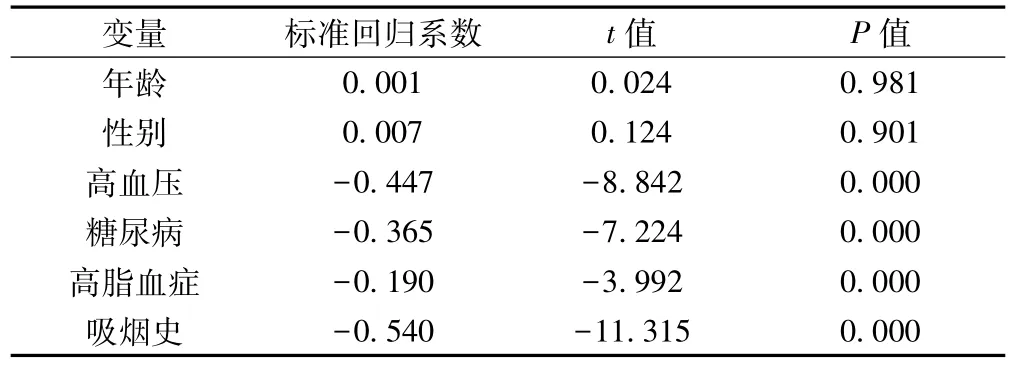
表2 外周血EPC s数量与脑血管危险因素的回归分析
2.3外周血EPCs水平和脑血管病危险因素的相关性与EPCs数量独立相关的变量为吸烟史、高血压病史、糖尿病史、高脂血症病史(均P<0.01),与年龄、性别不相关(均P>0.05)。见表2。危险因素组、脑梗死后遗症组和急性脑梗死组外周血Spearson相关分析或pearman秩相关分析显示,外周血EPCs数量与DBP、HbA1c、TC、LDL呈负相关(均P<0.05),与FPG、TG无相关性(均P>0.05)。见表3。
2.4急性脑梗死患者外周血EPCs数量变化与NIHSS评分改善程度的关系急性脑梗死患者发病后NIHSS评分随着外周血EPCs上升而改善。NIHSS评分发病24~72 h、72 h~7 d、7~14 d的改善程度与对应时间点外周血EPCs的数量变化呈负相关(均P<0.01)。在发病后21~90 d时,患者NIHSS评分仍有改善而与外周EPCs变化减少,这种相关性不复存在(均P>0.05)。见表4,表5。

表3 外周血EPCs数量与脑血管危险因子的相关性
表4 急性脑梗死患者外周血EPCs水平和神经功能NIHSS评分(±s,n=60)

表4 急性脑梗死患者外周血EPCs水平和神经功能NIHSS评分(±s,n=60)
指标 24 h 72 h 7 d 14 d 21 d 30 d 60 d 90 d EPCs 28.1±7.1 29.9±6.2 32.6±6.5 35.5±7.2 31.0±6.5 28.1±7.0 28.6±7.8 28.5±8.1 NIHSS评分 12.9±3.48 11.6±3.28 10.3±3.50 9.1±3.86 8.1±3.58 7.6±3.52 7.2±3.66 6.7±3.59
表5 脑梗死患者外周血EPCs数量变化与NIHSS评分改善的相关性(±s)
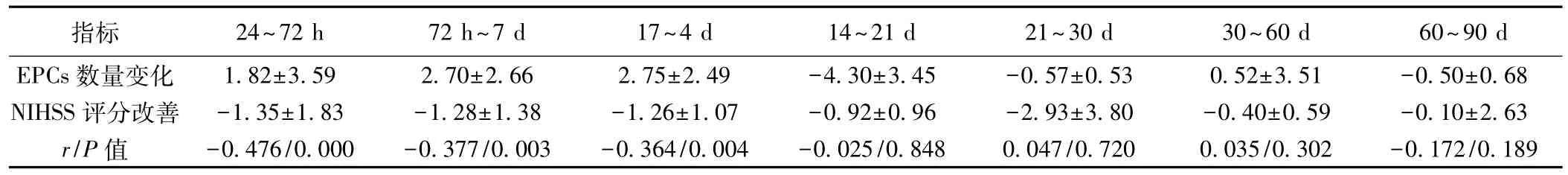
表5 脑梗死患者外周血EPCs数量变化与NIHSS评分改善的相关性(±s)
指标 24~72 h 72 h~7 d 17~4 d 14~21 d 21~30 d 30~60 d 60~90 d EPCs数量变化 1.82±3.59 2.70±2.66 2.75±2.49 -4.30±3.45 -0.57±0.53 0.52±3.51 -0.50±0.68 NIHSS评分改善 -1.35±1.83 -1.28±1.38 -1.26±1.07 -0.92±0.96 -2.93±3.80 -0.40±0.59 -0.10±2.63 r/P值 -0.476/0.000 -0.377/0.003 -0.364/0.004 -0.025/0.848 0.047/0.720 0.035/0.302 -0.172/0.189
3 讨论
EPCs能在生理或病理情况下维持血管功能,参与血管内皮修复和血管再生。脑血管病危险因素损伤血管内皮细胞、出现动脉粥样硬化,导致脑血管狭窄、闭塞,然后脑血管供血障碍,脑实质缺血坏死。EPCs的提出,可能为脑梗死的预防、治疗和预后判断提供新的思路〔1〕。
正常健康人体外周血中存在少量EPCs,并且随个体差异而数量不同。首先循环EPCs的数量随年龄的增长而减少〔2〕,Kushner等〔3〕证实年龄增加可加速EPCs的凋亡。再次,性别差异也导致其数量的不同,年轻女性循环EPCs数量最多,这可能和雌激素水平变化相关〔4〕。
脑血管病的危险因素(动脉粥样硬化、高脂血症、高血压、糖尿病和吸烟等)皆导致循环EPCs的数量减少和功能下降。Vemparala等〔5〕观察到动脉粥样硬化可加速EPCs的衰老,使EPCs的存活时间缩短。而作为动脉粥样硬化的主要病因之一,高脂血症除导致EPCs数量减少,还可以影响EPCs的分化能力,致使功能减退〔6〕。谢培益等〔7〕发现,低密度脂蛋白胆固醇(LDL-C)的中间代谢产物氧化LDL-C(ox-LDL-C)通过氧化应激直接导致EPCs损伤、凋亡;同时通过下调bcl-2(正常细胞凋亡抑制基因)的表达而抑制EPCs增殖、诱导EPCs凋亡。Rossi等〔8〕对高胆固醇血症患者进行研究,发现HDL是EPCs数量和功能的重要决定因素。Tso等〔9〕在研究中发现EPCs水平与高密度脂蛋白胆固醇(HDL-C)呈负相关相关,且增高HDL-C的药物可以增加一氧化氮(NO)的表达和减少EPCs的凋亡,促进EPCs介导的内皮修复。在那些血清胆固醇水平升高的相对健康人群中,EPCs集落生成单位明显下降〔10〕。Chen等〔11〕发现高胆固醇血症患者离体EPCs的迁移、分化、增殖能力下降,体外血管发生功能也明显减弱。在高血压病中,肾素-血管紧张素-醛固酮系统活性增高〔12〕,醛固酮可以降低信号转导通路活性而抑制骨髓动员及EPCs的分化,同时降低血管内皮生长因子的表达。血管紧张素Ⅱ降低EPCs端粒酶活性,增加氧化应激而减少EPCs的存活数量。而且高血压患者外周血CD34+细胞的同源异形盒A9(HOXA9)表达下调也可促成EPCs的减少〔13〕。Loomans等〔14〕证实糖尿病所致的高血糖微环境可改变骨髓EPCs免疫表型的形成,减少骨髓中EPCs生成,而且发现HbA1c与EPCs的数量呈负相关,血糖水平与EPCs的功能损伤呈正相关。患者胰岛素抵抗可使NO生物利用度降低,致EPCs从骨髓动员减少。高血糖环境可使氧自由基产生过量,导致EPCs凋亡。胰岛素抵抗和糖毒性均可抑制磷酯酰肌醇-3液酶/丝氨酸-苏氨酸蛋白激酶(PI3K/Akt)信号转导通路致EPCs功能下降〔15〕。研究表明〔16〕晚期糖基化终末产物改变骨髓及靶组织微环境,损害EPCs的迁徙、黏附和分泌功能。Hamed等〔15〕在2型糖尿病患者EPCs数量减少及功能紊乱的基本分子机制研究中认为可能与NO系统的代谢改变相关。已有研究证实吸烟可引起血管炎症反应,并损伤内皮细胞,循环EPCs修复受损。Mandraffino等〔17〕认为吸烟能导致EPCs的氧化与抗氧化失衡,炎症反应失衡均可减少EPCs的数量,并且吸烟量与EPCs数量呈明显的负相关。Kondo等〔18〕也证实戒烟可以增加外周血EPCs数量,但如果再次恢复吸烟,EPCs数量会又降低至戒烟前水平。
外周血EPCs数量与吸烟史关系密切〔17〕。在血压因素中,与舒张压呈明显负相关。因为高血压患者舒张压升高是因为外周血管阻力增高,认为EPCs数量的下降造成受损的血管内皮修复减少,同时血管生长受损也导致微血管的减少。小动脉管腔直径变小、微小动脉及毛细血管密度减小又继发外周血管阻力的增高。在与血糖的比较中EPCs数量与FPG无明显相关性,而与HbA1c呈负相关。FPG受到的影响因素比较多,尤其是急性脑梗死空腹血糖常应激性增高,而HbA1c反映近期一段时间的血糖水平。可见长期的高血糖才是EPCs数量的影响因素,而且糖代谢紊乱的程度和时间长短与EPCs的数量密切相关,即糖尿病时间越长、血糖越高,EPCs数量越少。血脂对EPCs数量的影响与文献报道〔7~11〕的一致。
血管危险因素的影响下患者EPCs的数量明显下降,脑梗死一旦发生,脑组织缺血、缺氧致骨髓中EPCs迅速动员并释放入外周血,进行血管内皮的修复和血管的再生。众多学者针对脑梗死后EPCs数量变化进行研究,都发现EPCs存在一个动态复杂的数量变化过程。Tsai等〔19〕发现急性脑梗死后第1天早期EPCs和晚期EPCs数量均显著降低,随后逐步增加,直至第30天恢复至正常水平,并且在大血管病变组尤为明显。Woywodt等〔20〕发现在急性腔隙性脑梗死和心源性脑栓塞后90 d之内循环EPCs皆处于低水平状态,而在动脉粥样硬化性血栓型脑梗死病程中,循环EPCs数量显著增高,并在病程第7天达最高水平。然而在有些研究则得出了不同的结论,Navarro-Sobrino等〔21〕发现在脑梗死发作3~24 h内外周血EPCs数量上升,并认为这是急性动员所致。Paczkowska等〔22〕研究发现在脑梗死后1~7 d内外周血早期EPCs和晚期EPCs数量都明显上升,并且早期EPCs数量在第3天达到高峰,并认为血管内皮生长因子的分泌是动员因素之一。
本研究证实血管危险因素造成外周血EPCs数量的下降,考虑原因可能EPCs的生成减少、修复血管消耗增加以及诱导EPCs的凋亡增加。急性脑梗死发生时,内皮细胞被大量消耗,外周血中EPCs在理论上应减少,但发病24 h时间点检测患者外周血EPCs数量与危险因素组和脑梗死后遗症组无差异。因此,认为脑梗死发生时脑组织缺血、缺氧会增强骨髓EPCs动员、分化并迁移至外周血,应对血管损伤应激需要。脑梗死患者急性期(0~30 d)存在骨髓EPCs的动员,外周血EPCs水平升高,在稳定期(30 d后)则回落至基线水平。与Taguchi等〔23〕研究的基本一致循环EPCs被认为可以反映机体内皮的修复能力,循环EPCs数量变化可反映血管修复再生的情况。虽然脑梗死后循环EPCs数量变化存在争议,但是多数研究结果都支持低水平的循环EPCs提示预后不良〔24〕。这可能是由于血管损伤修复消耗大量的EPCs、大量炎症因子抑制EPCs的动员和/或促进外周血中EPCs的凋亡而导致循环EPCs的减少〔25〕。
基础研究发现脑缺血后神经再生、神经功能的恢复与缺血部位新血管的形成、重塑密切相关。Hess等〔26〕以雄性转基因小鼠骨髓细胞移植给雌性小鼠,观察到脑缺血第24小时则仅有少量的表达绿荧光蛋白的骨髓来源细胞整合,到脑缺血后7、14 d,骨髓来源的细胞大量整合进缺血区血管系统并表达血管内皮细胞的标志。Zhang等〔27〕以转基因小鼠的骨髓细胞移植给小鼠,发现脑缺血损伤后可募集血循环中的EPCs参与血管再生。Giraldi-Guimarares等〔28〕在大鼠脑缺血模型证实,EPCs能使脑缺血部位的血液供应得到显著改善,促进大鼠神经功能恢复。EPCs促进神经功能改善的可能机制是分化为内皮细胞〔29〕和分泌血管生成因子〔30〕。一项以人的骨髓基质细胞移植治疗大鼠脑缺血的研究表明,人骨髓基质细胞可以通过提高内源性,即大鼠的血管内皮生长因子(VEGF)和其受体(VEGFR-2)的水平来促进缺血区的“血管新生”。血供的恢复是神经修复的基础。在急性缺血性脑卒中发生后,骨髓EPCs被动员到外周血并归巢到缺血组织,参与该处的损伤血管修复和缺血部位新血管的形成〔31〕。很明显,EPCs参与了脑缺血的修复。Yip等〔32〕研究也发现,用CD34+/ KDR+细胞代表循环EPCs,急性脑梗死发生后外周血EPCs水平显著提高,反映骨髓的动员,认为循环EPCs的水平可作为脑缺血后临床预后的独立预测因子。Chu等〔33〕也发现脑缺血,尤其是脑缺血1 w内,外周血EPCs数量增加明显的患者,预后良好,外周血EPCs数量与预后呈独立相关。
本研究在分析急性脑梗死患者外周血EPCs数量变化与NIHSS评分改善程度的关系中发现,NIHSS评分发病24 h至14 d的改善程度与对应时间点外周血EPCs的数量变化呈负相关(均P<0.01)。在发病后21~90 d时,患者NIHSS评分仍有改善而与外周EPCs变化减少,这种相关性不复存在(均P>0.05)。EPCs对脑梗死的作用机制可能为: (1)诱导梗死区域血管的新生,改善缺血脑组织的血供,减少神经细胞凋亡,从而促进神经功能恢复。(2)修复损伤的血管内皮,维持血脑屏障的完整性,减轻脑水肿。(3)通过旁分沁作用分泌血管内皮生长因子,诱导神经干细胞的增殖和分化,促进神经元恢复和再生。
实验中急性脑梗死患者急性期(24 h~14 d)外周血EPCs数量变化与NIHSS评分的改善有明显的相关性,EPCs数量越多,神经功能恢复越好。因此认为,脑梗死急性期外周血EPCs数量可以作为脑梗死预后预测的指标。研究中脑梗死后30 d 至90 d时,EPCs数量无明显变化,而NIHSS评分仍趋于改善,分析可能通过康复训练等其他途径促进神经功能的恢复。
在急性脑梗死14 d后EPCs数量开始下降,这也为EPCs治疗脑梗死的时间节点提供了理论依据。认为在脑梗死的急性期,可以通过药物干预或移植方式增加外周血或脑梗死部位的EPCs,而增加脑组织的血供,提高脑梗死的神经功能,改善预后〔34,35〕。
4 参考文献
1 Asahara T,Murohara T,Sullivan A,et al.Isolation of putative progenitor endothelial cells for angiogenesis〔J〕.Science,1997; 275(5302) : 964-6.
2 Jie KE,Goossens MH,van Oostrom O,et al.Circulating endothelial progenitor cell levels are higher during childhood than in adult life〔J〕.Atherosclerosis,2009; 202(2) : 345-7.
3 Kushner EJ,MacEneaney OJ,Weil BR,et al.Aging is associated with a proapoptotic endothelial progenitor cell phenotype〔J〕.J Vasc Res,2011; 48(5) : 408-14.
4 Rousseau A,Ayoubi F,Deveaux C,et al.Impact of age and gender interaction on circulating endothelial progenitor cells in healthy subjects〔J〕.Fertil Steril,2010; 93(3) : 843-6.
5 Vemparala K,Roy A,Bahl VK,et al.Early accelerated senescence of circulating endothelial progenitor cells in premature coronary artery disease patients in a developing country-a case control study〔J〕.BMC Cardiovasc Disord,2013; 13(1) : 104.
6 Zhang X,Mao H,Chen JY,et al.Increased expression of microRNA-221 inhibits PAK1 in endothelial progenitor cells and impairs its function viac-Raf/MEK/ERK pathway〔J〕.Biochem Biophys Res Commun,2013; 431(3) : 404-8.
7谢培益,苏又苏,汤海燕,等.CD4+CD25+调节性T细胞对氧化型低密度脂蛋白致内皮祖细胞损伤的保护作用〔J〕.临床心血管病杂志,2010; 26(20) : 927-30.
8 Rossi F,Bertone C,Montanile F,et al.HDL cholesterol is a strong deter minant of endothelial progenitor cells in hypercholesterolemic subjects 〔J〕.Microvasc Res,2010; 80(2) : 274-9.
9 Tso C,Martinic G,Fan WH,et al.High-density lipoproteins enhance progenitor-mediated endothelium repair in mice〔J〕.Arterioscler Thromb Vasc Biol,2006; 26(5) : 1144-9.
10 Kusuyama T,Omura T,Nishiya D,et al.The effects of HMG-CoA reductase inhibitor on vascular progenitor cells〔J〕.J Pharmacol Sci,2006; 101 (4) : 344-9.
11 Chen JZ,Zhang FR,Tao QM,et al.Number and activity of endothelial progenitor cells from peripheral blood in patients with hypercholesterolaemia〔J〕.Clin Sci (Lond),2004; 107(3) : 273-80.
12Hill JM,Zalos G,Halcox JP,et al.Circulating endothelial progenitor cells,vascular function,and cardiovascular risk〔J〕.N Engl J Med,2008; 348(7) : 593-600.
13 Loomans CJ,de Koening EJ,Staal FJ,et al.Endothelial progenitor cell dysfunction.A novel concept in the pathogenesis of vascular complications of typeⅠdiabetes〔J〕.Diabetes,2004; 53(1) : 195-9.
14 Loomans CJ,van Haperen R,Duijs JM,et al.Differentiation of bone marrow-derived endothelial progenitor cells is shifted into a proinflammatory phenotype by hyperglycemia〔J〕.Mol Med,2009; 15(5-6) : 152-9.
15 Hamed S,Brenner B,Roguin A,et al.Nitric oxide: a key factor behind the dysfunctionality of endothelial progenitor cells in diabetes mellitus type-2〔J〕.Cardiovasc Res,2011; 91(1) : 9-15.
16 Li H,Zhang X,Guan X et al.Advanced glycation end products impair the migration,adhesion and secretion potentials of late endothelial progenitor cells〔J〕.Cardiovasc Diabetol,2012; 11(1) : 46.
17 Mandraffino G,Sardo MA,Riggio S,et al.Smoke exposure and circulating progenitor cells: evidence for modulation of antioxidant enzymes and cell count〔J〕.Clin Biochem,2010; 43(18) : 1436-42.
18 Kondo T,Hayahsi M,Takeshita K,et al.Smoking cessation rapidly increases circulating progenitor cells in peripheral blood in chronic smokers〔J〕.Arterioscler Thromb Vasc Biol,2004; 24(8) : 1442-7.
19 Tsai NW,Hung SH,Huang CR et al.The association between circulating endothelial progenitor cells and outcome in different subtypes of acute ischemic stroke〔J〕.Clin Chim Acta,2013; 427C: 6-10.
20Woywodt A,Gerdes S,Ahl B,et al.Circulating endothelial cells and stroke: influence of stroke subtypes and changes during the course of disease〔J〕.J Stroke Cerebrovasc,2012; 21(3) : 452-8.
21 Navarro-Sobrino M,Rosell A,Hernandez-Guillamon M,et al.Mobilization,endothelial differentiation and functional capacity of endothelial progenitor cells after ischemic stroke〔J〕.Microvasc Res,2010; 80(3) : 317-23.
22 Paczkowska E,Golab-Janowska M,Bajer-Czajkowska A,et al.Increased circulating endothelial progenitor cells in patients with haemorrhagic and ischaemic stroke: the role of endothelin-1〔J〕.J Neurol Sci,2013; 325(1-2) : 90-9.
23 Taguchi A,Matsuyama T,Moriwaki H,et al.Circulating CD34-positive cells provide an index of cerebrovascular function〔J〕.Circulation,2004; 109(24) : 2972-5.
24 Bogoslovsky T,Chaudhry A,Latour L,et al.Endothelial progenitor cells correlate with lesion volume and growth in acute stroke〔J〕.Neurology,2010; 75(23) : 2059-62.
25 Chen J,Jin J,Song M,et al.C-reactive protein down-regulates endothelial nitric oxide synthase expression and promotes apoptosis in endothelial progenitor cells through receptor for advanced glycation end-products 〔J〕.Gene,2012; 496(2) : 128-35.
26 Hess DC,Hill WD,Martin-Studdard A,et al.Bone marrow as a source of endothelial cells and NeuN-expressing cells after stroke〔J〕.Stroke,2002; 33(5) : 1362-8.
27 Zhang ZG,Zhang L,Jiang Q,et al.Bone marrow derived endothelial progenitor cells participate in cerebral neovascularization after focal cerebral ischemia in the adult mouse〔J〕.Circ Res,2002; 90(3) : 284-8.
28 Giraldi-Guimardes A,Rezende-Lima M,Bruno FP,et al.Treatment with bone marrow mononuclear cells induces functional recovery and decreases neurodegeneration after sensorimotor cortical ischemia in rats〔J〕.Brain Res,2009; 1266(2) : 108-20.
29 Medina RJ,O'Neill CL,O'Doherty TM,et al.Myeloid angiogenic cells act as alternative M2 macrophages and modulate angiogenesis through interleukin-8〔J〕.Mol Med,2011; 17(9-10) : 1045.
30 Medina RJ,O'Neill CL,Sweeney M,et al.Molecular analysis of endothelial progenitor cell (EPC) subtypes reveals two distinct cell populations with different identities〔J〕.BMC Med Genomics,2010; 3(1) : 18.
31 Taguchi A,Soma T,Tanaka H,et al.Ad ministration of CD34+ cells after stroke enhances neurogenesis via angiogenesis in a mouse model〔J〕.J Clin Invest,2004; 114(3) : 330-8.
32 Yip HK,Chang LT,Chang WN,et al.Level and value of circulating endothelial progenitor cells in patients after acute ischemic stroke〔J〕.Stroke,2008; 39(1) : 69-74.
33 Chu K,Jung KH,Lee ST,et al.Circulating endothelial progenitor cells as a new marker of endothelial dysfunction or repair in acute stroke〔J〕.Stroke,2008; 39(5) : 1441-7.
34 Gertz K,Priller J,Kronenberg G,et al.Physical activity improves longterm stroke outcome via endothelial nitric oxide synthase-dependent augmentation of neovascularization and cerebral blood flow〔J〕.Circ Res,2006; 99(10) : 1132-40.
35 Nakamura K,Tsurushima H,Marushima A,et al.A subpopulation of endothelial progenitor cells with low aldehyde dehydrogenase activity attenuates acute ischemic brain injury in rats〔J〕.Biochem Biophys Res Commun,2012; 418(1) : 87-92.
〔2015-01-17修回〕
(编辑袁左鸣)
通讯作者:屈新辉(1970-),男,硕士,主任医师,硕士生导师,主要从事脑血管病、运动障碍疾病和干细胞研究。
基金项目:十一五国家科技支撑计划资助项目(2008BAI68) ;江西省卫生厅科技计划项目(20133013)
〔中图分类号〕R743
〔文献标识码〕A
〔文章编号〕1005-9202(2015) 16-4520-05;
doi:10.3969/j.issn.1005-9202.2015.16.044

