小分子抑制剂瑞戈非尼的药理和临床概述
王明森,刘正平,侯良玉,张菊红,张建强
(1.山东省药学科学院,山东济南250101;2.山东福瑞达医药集团公司,山东省黏膜与皮肤给药技术重点实验室,山东济南250101;3.山东天浩工程设计有限公司,山东济南250101)
小分子抑制剂瑞戈非尼的药理和临床概述
王明森1,2,刘正平1,2,侯良玉3,张菊红1,张建强1
(1.山东省药学科学院,山东济南250101;2.山东福瑞达医药集团公司,山东省黏膜与皮肤给药技术重点实验室,山东济南250101;3.山东天浩工程设计有限公司,山东济南250101)
摘要:本文综述了瑞戈非尼治疗结肠直肠癌和胃肠道间质瘤的药理、药动学、临床研究和安全性信息。主要参考国外有关的瑞格菲尼的注册和临床资料。临床试验表明瑞戈非尼能使患者的总生存期、无进展生存期获得明显提高。接受治疗的患者中最严重的药物不良反应是严重肝损伤、出血和胃肠道穿孔,最常见的不良反应(≥30%)为虚弱/疲乏、食欲减退、食物摄入量减少、手足皮肤反应、腹泻、消瘦、高血压和发音障碍。
瑞戈非尼片是由拜耳制药公司研制的一种口服多激酶抑制剂,通过抑制多种蛋白质激酶,靶向作用于肿瘤生成、肿瘤血管发生和肿瘤微环境的维持。2012年9月美国食品药品监督管理局(FDA)批准其用于既往曾用基于氟嘧啶,奥沙利铂和伊立替康化疗,一种抗VEGF(血管内皮生长因子)治疗,如果为KRAS野生型(第二外显子),则为抗EGFR(上皮生长因子受体)治疗过的转移结肠直肠癌(CRC)患者的治疗; 2013年2月美国批准其用于治疗先前接受过伊马替尼和舒尼替尼治疗的局部晚期而不能手术切除或转移性胃肠道间质瘤(GIST)患者。商品名为“Stivarga”,规格为40 mg。2013年8月日本厚生劳动省(MHLW)批准瑞格菲尼用于系统性癌症治疗后病情恶化的胃肠道间质瘤的治疗。目前国内没有该药物上市。
1 理化性质
分子式[1]: C21H15ClF4N4O3·H2O
分子量: 500.83
理化性质:瑞戈非尼几乎不溶于水,轻微溶解于乙腈,甲醇,乙醇,以及乙酸乙酯并略溶于丙酮。
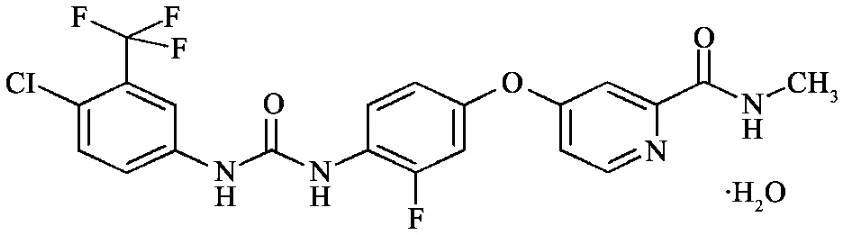
图1 瑞戈非尼的结构式
2 作用机制
瑞戈非尼是一种多靶点的、细胞内激酶的小分子抑制剂,参与正常细胞功能及病理过程,如肿瘤发生、肿瘤血管生成以及肿瘤微环境维护。在体外生化或细胞试验中,瑞戈非尼或其主要人体活性代谢物M-2和M-5在达到临床治疗浓度时,可以抑制RET、VEGFR1、VEGFR2、VEGFR3、KIT、PDGFR-α、PDGFR-β、FGFR1、FGFR2、TIE2、DDR2、TrkA(酪氨酸激酶作用的靶点)等的活性。在体内模型中,瑞戈非尼在大鼠肿瘤模型中表现出抗血管形成活性,在几个小鼠异种移植模型(包括人体结肠直肠癌的一些模型)中表现出肿瘤生长抑制活性和抗转移活性[2]。
3 给药方案
在每28 d为一周期的前21 d,每次口服160 mg瑞戈非尼,每天1次。继续治疗至疾病进展或出现不可接受的毒性时。每天同一时间服用瑞戈非尼,配合低于30%脂肪的低脂早餐,整片吞服。
4 药动学
4.1吸收在口服单剂量160 mg,每片40 mg共4片瑞戈非尼后大约3~4 h平均峰值血浆浓度达到2.5 mg·L-1。接下来口服单剂量60 mg或100 mg片剂,平均相对生物利用度对比口服溶液分别为69%和83%。进食一份低脂肪(清淡)早餐后口服瑞戈非尼,对比无论是高脂肪早餐或空腹状态后口服,瑞戈非尼的浓度和其主要药理活性代谢物(M-2和M-5)的含量都是最高。相比空腹状态,进食高脂肪早餐后瑞戈非尼的暴露增加了48%,进食低脂肪早餐后暴露增加了36%。瑞戈非尼代谢产物M-2(N-氧化物) 和M-5(N-氧化物和N-去甲基)进食低脂肪早餐后相比空腹状态更高,进食高脂肪早餐后相比空腹状态更低。
4.2分布瑞戈非尼以及主要循环代谢产物的血药浓度-时间曲线显示,在整个24 h给药间隔内出现多个峰值,这归因于肝肠循环。在体外蛋白质结合瑞戈非尼对人类血浆蛋白升高(99.5%)。在体外蛋白质结合M-2和M-5(分别为99.8%和99.95%)高于瑞戈非尼。
代谢产物M-2和M-5是P-gp(糖蛋白)的弱底物。代谢产物M-5是弱BCRP(药物转运蛋白)底物。
4.3代谢瑞戈非尼的代谢主要在肝脏通过CYP3A4介导氧化代谢,以及由葡糖醛酸通过UGT1A9介导。瑞戈非尼的2个主要和6个次要代谢物在血浆中已确定。瑞戈非尼在人类血浆中的主要循环代谢产物是M-2和M-5,这是其药物活性,并且在稳定状态与瑞戈非尼具有类似的浓度。M -2通过CYP3A4介导进一步氧化代谢,以及由UGT1A9介导通过葡醛酸代谢。
通过微生物菌群代谢物可减少或水解在胃肠道中,允许未结合的活性物质和代谢产物(肝肠循环)再吸收。
4.4消除在不同研究中,口服给药瑞戈非尼及其代谢产物M-2在血浆中的平均消除半衰期为20~30 h。代谢产物M-5的平均消除半衰期约为60 h(范围从40~100 h)。约90%的放射性剂量在给药后12 d内恢复,约71%的剂量在粪便中排出(47%为母体化合物,24%为代谢物),大约19%的剂量在尿液中和葡萄糖醛酸苷一同排出。葡萄糖醛酸苷在尿液的排泄在稳态条件下减少至10%以下。在粪便中发现母体化合物可能来源于葡萄糖醛苷酸的肠内分解或M-2代谢物的还原(N-氧化物),以及未被吸收的瑞戈非尼。M-5在胃肠道中可通过微生物菌群转化为M-4,允许M-4再吸收(肝肠循环)。M-5在粪便中最终通过M-4作为M-6排泄(羧酸)。
5 药物相互作用
瑞戈非尼对细胞色素P450底物的影响:体外研究表明,瑞戈非尼是CYP2C8、CYP2C9、CYP2B6、CYP3A4及CYP2C19的一种抑制剂; M-2代谢物是CYP2C9、CYP2C8、CYP3A4 及CYP2D6的一种抑制剂,并且M-5代谢物是CYP2C8的一种抑制剂。体外研究表明瑞戈非尼不是CYP1A2、CYP2B6、CYP2C19以及CYP3A4酶活性的诱导剂。在给予每天1次160 mg的瑞戈非尼的1周前及2周后,进展期实体瘤患者接受单次口服剂量的CYP底物,2 mg咪达唑仑(CYP3A4),40 mg奥美拉唑(CYP2C19)及10 mg华法林(CYP2C9)或4 mg罗格列酮(CYP2C8)。观察到罗格列酮(n=12)或奥美拉唑(n=11)血浆浓度AUC均值或咪达唑仑(n=15) AUC均值在给药后无临床相关的变化。华法林的AUC均值(n=8)增加25%。
CYP3A4强效诱导物对瑞戈非尼的影响: 22例健康成年男性仅接受160 mg瑞戈非尼并在7天后开始用利福平。利福平是一种强效的CYP3A4诱导物,每日给予600 mg连续9 d。瑞戈非尼的AUC均值降低50%且M-5的AUC均值增加264%。没有观察到M-2的AUC均值变化。
CYP3A4强效抑制剂对瑞戈非尼的影响: 18例健康成年男性仅接受160 mg Stivarga并在5天后开始用酮康唑,一种强效的CYP3A4抑制剂,每日给予400 mg连续18 d。瑞戈非尼的AUC均值增加33%,且M-2及M-5的AUC均值均减少93%。
瑞戈非尼对UGT1A1底物的影响:体外研究表明,在治疗相关剂量时,瑞戈非尼、M-2及M-5竞争性抑制UGT1A9及UGT1A1。11例患者接受合用伊立替康的化疗,其瑞戈非尼的剂量为160 mg。连用7 d瑞戈非尼后给予5 d的伊立替康,伊立替康的AUC均值增加28%且SN-38(伊立替康的活性中间体)的AUC均值增加44%。
体外筛查转运蛋白:体外数据表明瑞戈非尼是ABCG2(乳腺癌耐药蛋白)及ABCB1 (P-糖蛋白)的一种抑制剂。
6 临床有效性和安全性评价
6.1结肠直肠癌Stivarga的临床有效性和安全性在一项国际、多中心、随机(2∶1)、双盲、安慰剂对照的试验中进行了研究,有760例患者,前期接受转移性结直肠癌的治疗。主要的有效性结果测量方式是总生存率(OS) ;支持有效性结果测量方式包括无进展生存期(PFS)和客观的肿瘤有效率[3]。
在所有随机群体中,中位年龄为61岁,61%为男性,78%为白人,所有患者基线ECOG表现分为0或1。疾病主要部位为结肠(65%)、直肠(29%)或两者(6%)。KRAS评价被报道于729 (96%)例患者;其中430 (59%)例被报道有KRAS突变[4]。
转移性疾病的治疗前线的中位值为3。所有患者前期治疗接受了氟嘧啶,奥沙利铂,以及伊立替康的化疗和贝伐珠单抗治疗。所有患者,除了1例KRAS变异异性的肿瘤患者,均接受了帕木单抗或西妥昔单抗。与安慰剂加BSC相比,瑞戈非尼加BSC将使生存期有统计意义的增加。
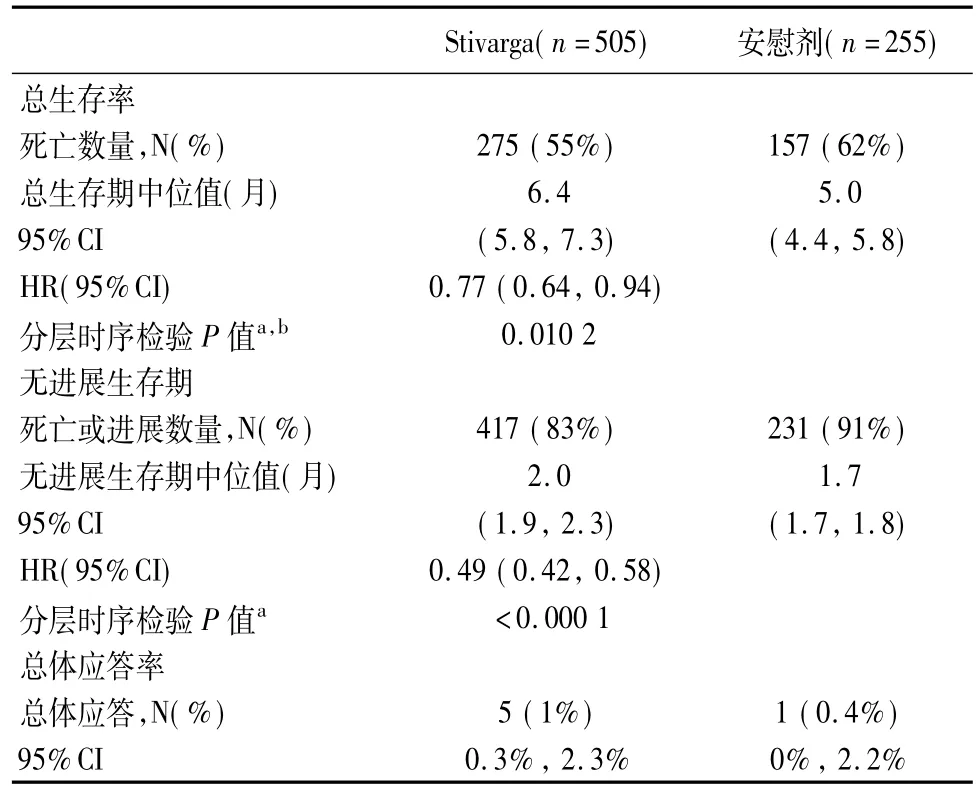
表1 有效性结果
列举于下面的安全性数据,均来自一项随机(2∶1)、双盲、安慰剂对照试验,其中500例既往接受过转移性结肠直肠癌治疗的患者(中位年龄为61岁; 61%为男性)在每个4周周期的前3周中每日服用瑞戈非尼160 mg的单药治疗,另外253例患者(中位年龄为61岁; 60%为男性)服用安慰剂。服用瑞戈非尼的患者的治疗中位持续时间为7.3周(范围为0.3,47.0)。因为不良反应,61%接受瑞戈非尼的患者需要中断给药,38%的患者降低了剂量。在瑞戈非尼治疗组中有8.2%的患者报告了引起治疗中止的药物相关不良反应,而在安慰剂组中为1.2%。手足皮肤反应(HFSR)和皮疹是引起瑞戈非尼永久停药的最常见原因。
表2比较了在服用瑞戈非尼的患者中发生率≥10%的不良反应和发生率高于安慰剂组的不良反应。
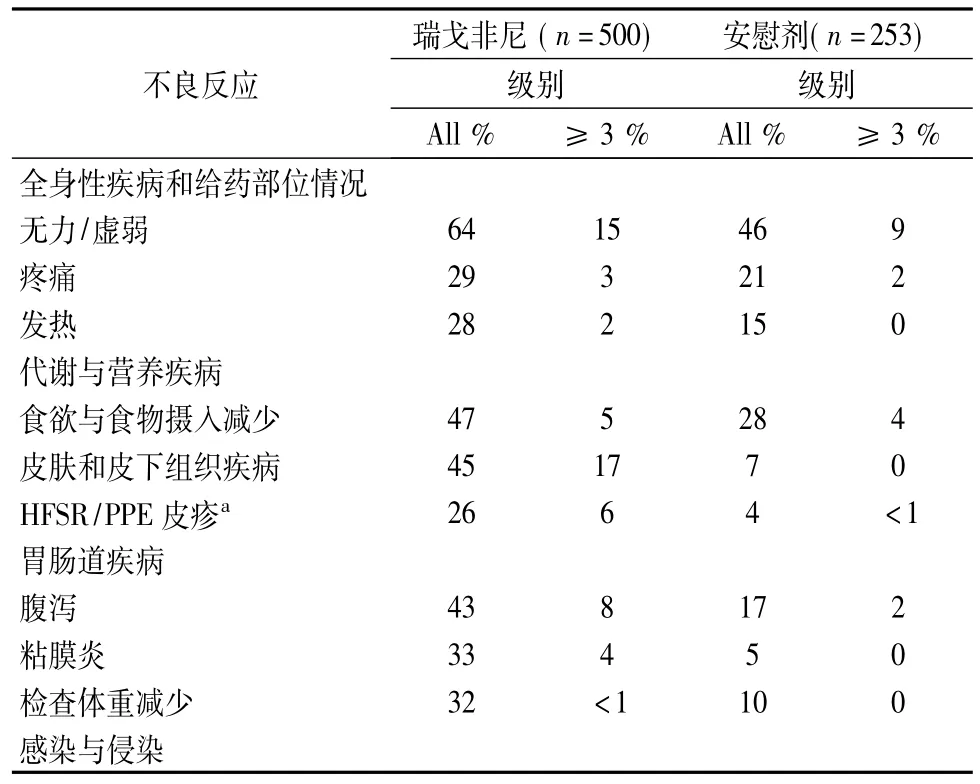
表2 患者发生率≥10%的不良反应和发生率高于安慰剂组的不良反应
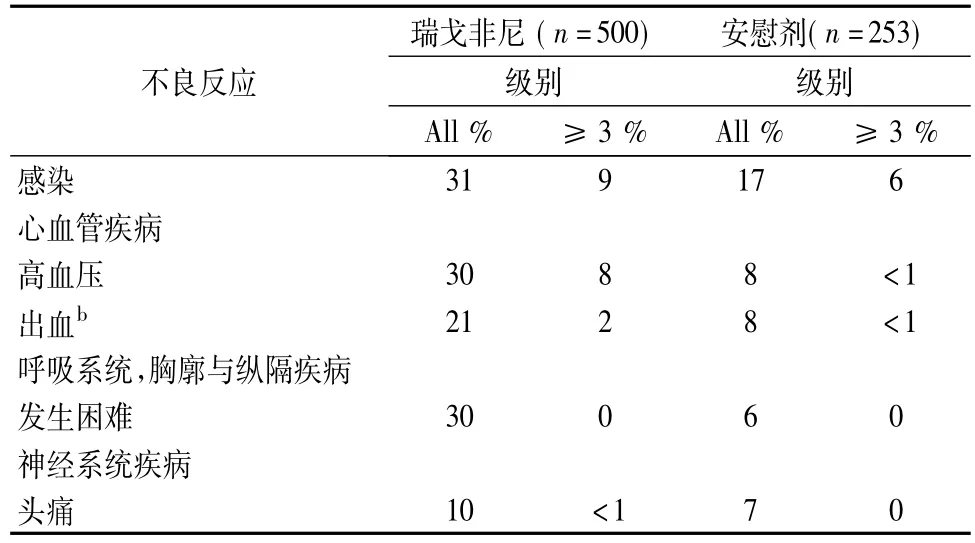
续表2:
6.2胃肠道间质瘤瑞戈非尼的临床有效性和安全性在一项国际的、多中心、随机(2∶1)、双盲、安慰剂对照的实验中进行了研究,有199例患者具有不可切除的,局部进展或转移性胃肠道基质肿瘤(GIST),其前期用甲磺酸伊玛替尼和苹果酸舒马替尼进行治疗。按治疗线(3比4或更多)和地理面积(亚洲vs世界其他区域)进行随机分层。
主要有效性结果测量方式为基于疾病评估的无进展生存期(PFS),使用改良的RECIST 1.1标准对独立的影像进行评估,其中淋巴结和骨损害不是靶损害并且在预存在肿瘤块的新肿瘤结节增长为病情进展。主要的次级结果测量方式为总存活数。患者随机接受160 mg瑞戈非尼每天1次口服(n=133)加最大支持性护理(BSC)或安慰剂(n=66)加BSC用于每28 d周期的前21 d。治疗持续直至有疾病进展或不可接受的毒性。在研究中,患者中位年龄为60岁,64%为男性,68%为白种人,所有患者基线值ECOG表现水平为0 (55%)或1(45%)。在中心评价有疾病进展时,研究设盲被打破并且所有的患者被提供机会按研究者的指导使用Stivarga。56例(85%)患者随机接受安慰剂并且41例(31%)患者随机接受标签开放的Stivarga。Stivarga与安慰剂组患者相比PFS有统计意义的提高。在计划的间隔分析期,根据最终分析中全部事件的29%,总存活率无统计意义的差别[5,6],结果见表3。
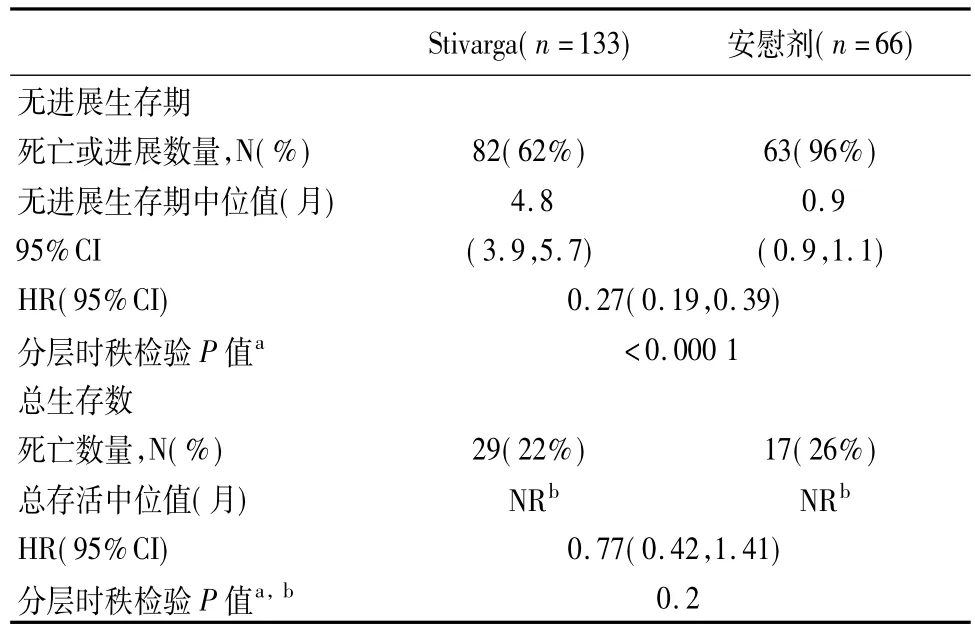
表3 有效性结果
如下安全性数据来自于一项随机(2∶1),双盲,安慰剂对照试验,其中132例既往接受过GIST治疗的患者(中位年龄60岁,64%男性)在每个4周治疗周期的前3周接受每天160mg瑞戈非尼的单药治疗,另外66例患者(中位年龄为61岁; 64%男性)服用安慰剂。瑞戈非尼组治疗的中位持续时间为22.9周(范围为0.1至50.0)。瑞戈非尼组中有58%的患者因不良反应而中断给药,50%的患者降低了剂量。在瑞戈非尼治疗组中有2.3%的患者因药物相关不良反应而停止治疗,而在安慰剂组患者则为1.5%[7]。
表4比较了在服用瑞戈非尼的GIST患者中发生率≥10%的不良反应和发生率高于安慰剂组的不良反应[8]。
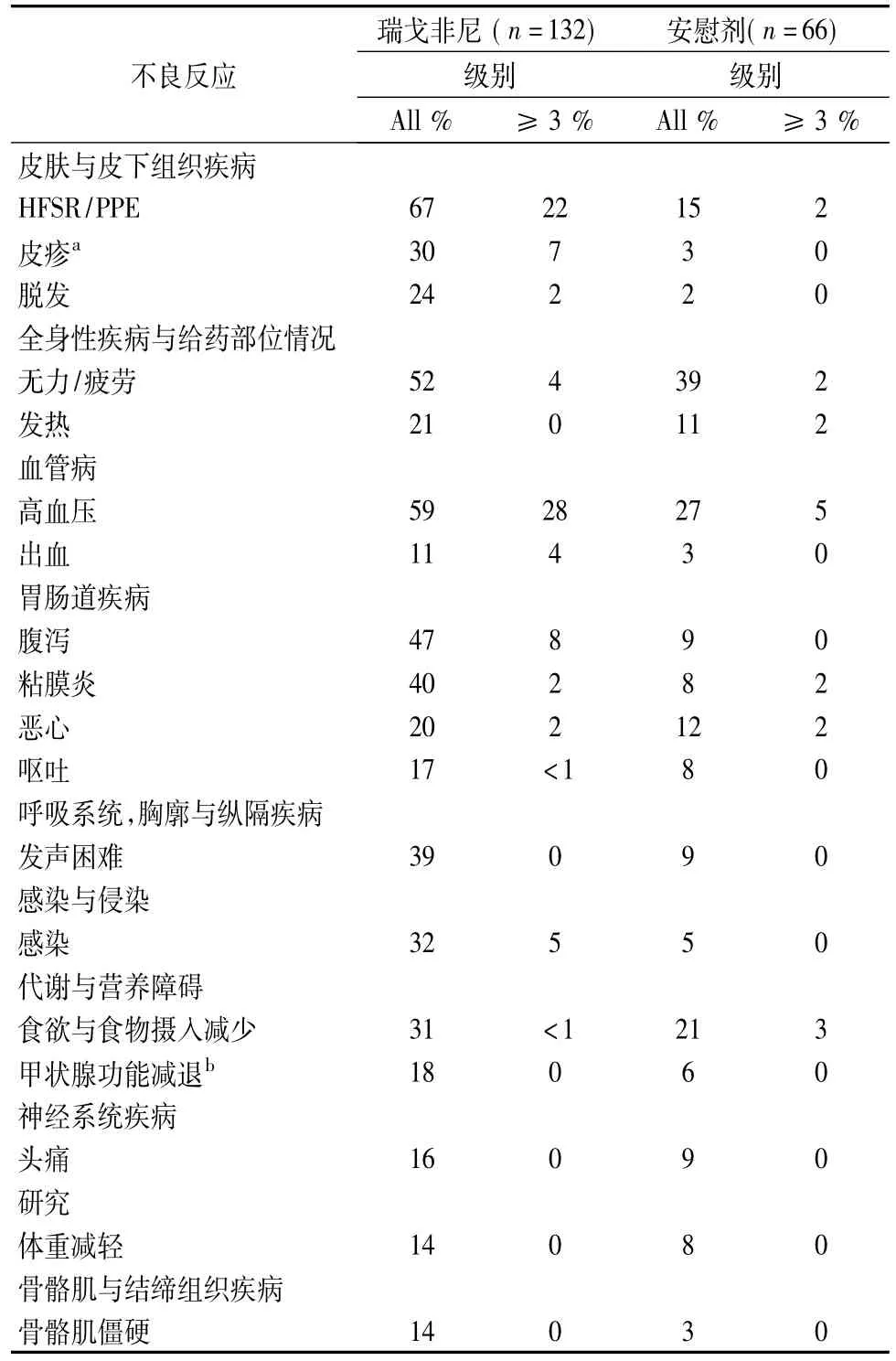
表4 GIST患者中发生率≥10%的不良反应和发生率高于安慰剂组的不良反应
7 结语
瑞戈非尼作为一种新型的多激酶抑制剂,可以阻断几种促进癌症增长的酶。较于安慰剂组,可使接受标准治疗后肿瘤仍处于进展期的转移性结肠直肠癌患者的无进展生存期延长,总生存期获得明显提高,意味着疾病进展或死亡风险降低,疾病控制率显著高于安慰剂组。在治疗使用甲磺酸伊马替尼或苹果酸舒马替尼治疗后病情发生进展的胃肠道间质瘤患者,瑞戈非尼相比安慰剂能使患者的无进展生存期获得统计学上的明显延长。
接受瑞戈非尼片治疗的最明显的毒性反应为药物性肝损伤、出血、皮肤毒性(掌足红肿和皮疹)、高血压、心脏缺血性反应,胃肠穿孔。观察瑞戈非尼治疗患者中发生最频繁不良反应为疲乏、无力、食欲下降、进食量减少、掌足红肿综合征、腹泻、粘膜炎、感染、高血压、发声困难等[9]。
瑞戈非尼的安全性与其他多激酶抑制剂一致。总生存期的优势在推荐患者群体中可见,服用瑞戈非尼,对既往治疗过的转移性结肠直肠癌的患者提供了一个良好的效益风险评估。
参考文献:
[1]Wilhelm SM,Carter C,Tang L,et al.BAY 43-9006 exhibits broad spectrum oral antitumor activity and targets the RAF/MEK/ERK pathway and receptor tyrosine kinases involved in tumor progression and angiogenesis[J].Cancer Res,2004,64(19) : 7099-7109.
[2]Dhillon AS,Hagan S,Rath O,et al.MAP kinase signaling pathways in cancer[J].Oncogene,2007,26(22) : 3279 -3290.
[3]Grothey A,Van Cutsem E,Sobrero A,et al.Regorafenibmono therapy for previously treated metastatic colorectal cancer (CORRECT) : an international,multicentre,randomized,placebocontrolled,phase 3 trial[J].Lancet,2013,381(9863) : 303-312.
[4]Van Cutsem E,Sombrero A,Siena S,et al.Regorafenib (REG ) in progressive metastatic colorectal cancer (mCRC) : Analysis of age subgroups in the phaseⅢCORRECT trial[J].J Clin Oncol,2013,31(Suppl) : a3636.
[5]Demetri GD,Reichardt P,Kang YK,et al.Efficacy and safety of regorafenib for advanced gastronintestinal stromal tumours after failure of imatinib and sunitinib (GRID) : an international,multicentre,randomized,placebo-controlled,phase 3 trial[J].Lancet,2013,381(9863) : 295 -302.
[6]Joensuu H,Casali PG,Reichardt P,et,al.Results from a phaseⅢtrial(GRID) evaluating regorafenib (REG) in metastatic gastrointestinal stromal tumour (GIST) : ubgroup analysis of outcomes based on pretreatment characteristics[J].J Clin Oncol,2013,31(Suppl) : a10551.
[7]Reichardt P,Demetri GD,Jeffers M,et al.Mutational analysis of plasma DNA From patients (pts) in the phase ⅢGRID sthdy of regorafenib (REG) versus placebo (PL) in tyrosine kinase in hibitor (TKI) refractory GIST: Correlating genotype with clinical outcomes[J].J Clin Oncol,2013,31(Suppl) : a10503.
[8]Grothey A,Sobrero AF,Siena S,et al.Time profile of adverse events from regorafenib treatment for metastatic colorectal cancer in the phaseⅢCORRECT study[J].J Clin Oncol,2013,31(Suppl) : a3637.
[9]李进.新型口服多激酶抑制剂瑞戈非尼治疗癌症的研究进展[J].临床肿瘤学杂志,2014,19(5) : 385-390.
关键词:瑞戈非尼;结肠直肠癌;胃肠道间质瘤
The progress on pharmacological and clinical research of small molecule inhibitors regorafenib
WANG Ming-sen1,2,LIU Zheng-ping1,2,HOU Liang-yu3,ZHANG Ju-hong1,ZHANG Jian-qiang1
(1.Shandong Academy of Pharmaceutical Sciences,Jinan 250101,China;2.Key Laboratory of Mucosal and Transdermal Drug Delivery Technology in Shandong Province,Shandong Freda Co.,Ltd.,Jinan 250101,China;3.Shandong Tianhao Chemical Engineering Design Co.,Ltd.,Jinan 250101,China)
Abstract:Pharmacology,pharmacokinetics,clinical study and safety of regorafenib in the treatment of colorectal cancer and gastrointestinal stromal tumors were reviewed in the paper.The main refeience to foreign-related registration and clinical data of regorafenib.Clinical trials showed the Overall Survival (OS) and Progression-Free-Survival (PFS) was significantly increased in patients treated with regorafenib.The most serious adverse drug reactions in patients receiving Stivarga were severe liver injury,haemorrhage and gastrointestinal perforation.The most frequently observed adverse drug reactions(≥30%) in patients receiving Stivarga were asthenia/fatigue,decreased appetite and food intake,hand foot skin reaction,diarrhoea,weight loss,hypertension and dysphonia.
Key words:Regorafenib; Colorectal cancer; Gastrointestinal stromal tumors
作者简介:王明森,男,主管药师,研究方向:新药物开发,E-mail: wms0536@126.com
中图分类号:R979.1
文献标识码:A
文章编号:2095-5375(2015) 10-0617-004

