稀土Ce掺杂纳米TiO2的制备及其光催化性能研究
(怀化学院化学系,湖南怀化418008)
近年来,纳米TiO2作为一种重要的宽带隙半导体材料,在太阳能转化[1]、光催化材料[2]、环境保护[3]等诸多领域有着广阔的应用前景.而且研究发现掺杂不同离子的纳米TiO2可使其具有更加优越的性能[4].由于稀土原子有未填满的4f壳层,4f壳层受晶体场或配位场影响较小,能级结构基本保留自由离子的特征,仍为分立的能级.由于稀土原子结构的特殊性和其丰富电子能级,使其具有许多优异的光、电、磁等物理特性[5-6].本研究以Ce2O3试剂为前驱体,采用溶胶-凝胶法制备了一系列不同掺杂量Ce3+/TiO2纳米晶体.并对纳米Ce3+/TiO2进行各种表征以及吸附和光催化性能测试.
1 实验部分
1.1 试剂与仪器
钛酸丁酯(A.R,国药集团化学试剂有限公司);无水乙醇(A.R,湖南汇虹试剂有限公司);三氧化二铈(Ce2O3);冰醋酸(A.R,北京化工厂).马弗炉(SRJX-4-13,长沙市远东电炉厂);光化学反应装置(XPA,南京胥江机电厂);XRD(日本理学公司D/MAX-ⅢA);DRS(UV-2501PC)光谱仪.
1.2 Ce3+掺杂二氧化钛的制备和表征
采用经典溶胶—凝胶法制备纳米Ce3+-TiO2,以钛酸丁酯为前驱物,取17 mL的钛酸丁酯(Ti(OC4H9)4)与60 mL的无水乙醇混合均匀为A溶液,盛放在分液漏斗中;将2.0 mL的0.1 mol/L硝酸铈(Ce(NO3)3)溶液加入15 mL冰醋酸和42.5 mL 95%乙醇混合,充分搅拌30 min得到B溶液.然后在搅拌中将A溶液滴入B溶液,滴完后继续搅拌1 h以形成均匀透明的Ce3+/TiO2溶胶,然后室温放置直至形成凝胶.将该凝胶在95℃下烘干且碾细成粉末.最后将粉末置于马弗炉中于500℃下煅烧2 h得到0.5%Ce3+掺杂的Ce3+-TiO2纳米催化剂,记为 0.5%(物质的量比)Ce3+-TiO2,采用相同的方法制备 0.25%,1.0%,1.5%,3.0%,5.0%,10.0% 以及 20.0% 的铈离子掺杂TiO2;纯的TiO2制备中未加入硝酸铈(Ce(NO3)3)溶液.
采用日本理学公司D/MAX-ⅢA型XRD来表征光催化剂的晶型,条件为:Cu石墨单色器,加速电压为30 kV,发射电流35 mA,λ为0.154 18 nm.采用UV-2101-PC型DRS光谱仪测试光吸收的变化.采用UV-2101-PC紫外—可见吸收光谱仪测试光吸收的变化.
1.3 光催化活性评价
以70 W的高压钠灯作为光源,使用光化学反应装置,将250 mL初始浓度为0.045 mmol/L的甲基橙溶液和0.25g催化剂粉末加入反应器,用锡纸包裹,连续鼓入空气下电磁搅拌30 min,确立吸附-解吸平衡,每间隔一定时间取样一次,样品在4 000 r/min下离心分离25 min,取上清液用紫外-可见分光光度计测定样品吸光度变化,以吸光度计算甲基橙浓度.
1.4 等温吸附实验
配置一系列的甲基橙溶液,分别移取10 mL不同浓度的目标污染物溶液于离心管,为防止光的影响,将离心管用锡箔纸包好;然后加入0.1 g催化剂粉末于离心管,将离心管放入气流震荡器在160 r/min、室温条件下,震荡24 h.取出离心分离后,取上清液用紫外-可见吸收光谱测量该温度下的甲基橙溶液的平衡浓度Ce(mmol/L),求出每克催化剂上甲基橙平衡吸附量:

式(1)中:Qe为时间t时的吸附量,mmol/g;C0、Ce为染料初始浓度和时间t时的浓度,mmol/L;V为溶液体积,L;M为吸附剂质量,g.
2 结果与分析部分
2.1 催化剂的表征
图1(a,b)为TiO2和 Ce3+-TiO2的 XRD 谱图分析结果.从图1中可以看出,在2θ等于25°左右处出现的明显的锐钛矿TiO2(101)晶面衍射峰,因此本试验所制备的二氧化钛催化剂晶体是锐钛矿TiO2;从晶面衍射峰的强度可以看出,随着Ce3+掺杂的增加,101晶面衍射峰的强度减弱,说明Ce3+掺杂可以阻碍晶体颗粒变大,掺杂有利于提高晶体的热稳定性,阻碍晶粒生长.

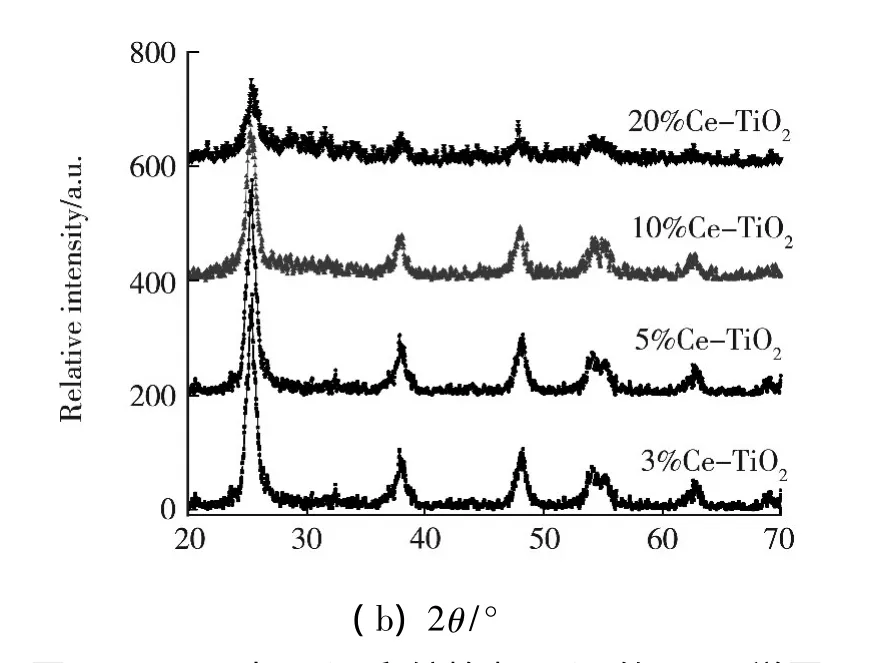
图1 (a,b)为TiO2和铈掺杂TiO2的XRD谱图
而且从图1(b)中可见,当Ce3+的掺杂量超过5%时,在2θ等于25.3°的晶面衍射峰(101)峰明显减略,Ce3+的掺杂量在20%时,在2θ等于25.3°的晶面衍射峰(101)峰已经很弱,在2θ等于37.8°,48.0°,62.75°,68.84°处的峰晶面衍射峰几乎没有,说明当掺杂量达到20%后催化剂几乎未晶化.
图2为TiO2和1.5%Ce3+-TiO2样品的紫外-可见吸收光谱.从图2可见,纯TiO2在可见光范围内没吸收.Ce3+-TiO2的吸收带边明显往长波方向移动(红移),Ce3+掺杂明显提高催化剂在可见光区域的光吸收能力,这是由于Ce3+的f电子的跃迁,使铈离子掺杂TiO2光催化剂在可见光区的吸收明显增强.意味着其可能被可见光激发,从而可利用太阳可见光来进行光催化处理污染物.
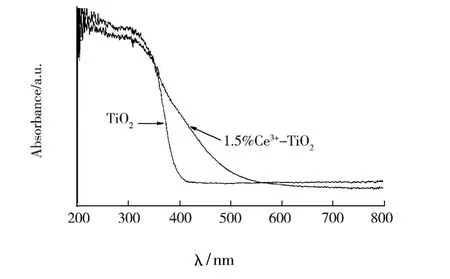
图2 TiO2和1.5%Ce3+-TiO2样品的紫外-可见吸收光谱
2.2吸附等温实验
图3 为甲基橙在不同铈掺杂量的催化剂上吸附等温线,从图中可见,甲基橙在Ce3+-TiO2的吸附远比纯TiO2强,而且随掺杂量增加吸附增强越明显.2.0%Ce3+-TiO2催化剂吸附最大容量达到42.3×10 mol/g,而纯 TiO2仅为 9.03 ×10 mol/g,高出大约5倍.与前期研究的其它稀土掺杂TiO2吸附性能比较,也要高出2倍多.
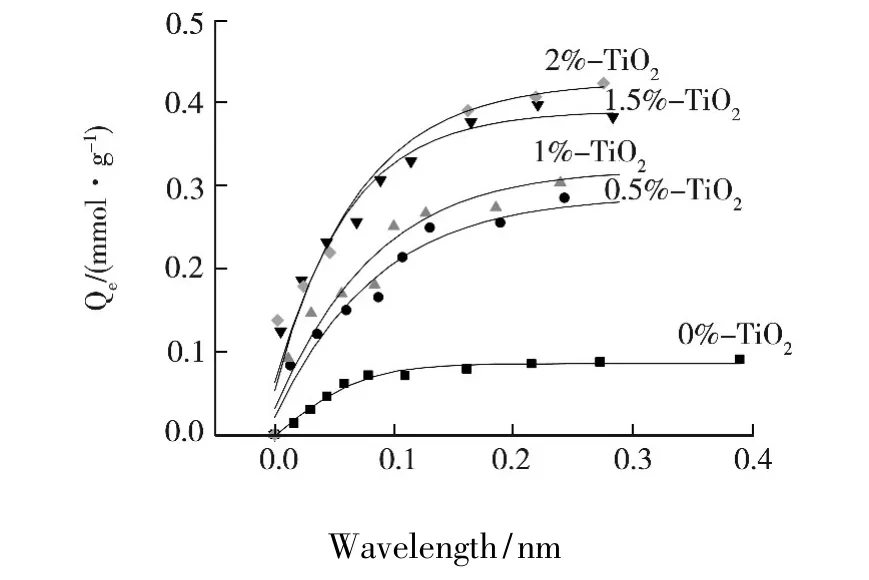
图3 甲基橙在纯TiO2和Ce3+-TiO2催化剂粉末上的吸附等温线
采用Langmuir吸附模型对甲基橙吸附数据做进一步分析:

(2)式中:Ce为吸附平衡有机物在溶液中的浓度(mol/L),Ka为兰格谬尔吸附平衡常数(mol/g),Qmax为饱和吸附量(mol/g).以Ce/Qe-Ce作图得到一直线,将实验数据进行回归处理可以求得Ka、Qmax及相关系数见表1.从表中可看出,Ce3+-TiO2对甲基橙的吸附比纯TiO2强,2.0%Ce3+-TiO2的催化剂饱和吸附量达到45.66×10-5mol/g,而纯TiO2为10.89 ×10-5mol/g.吸附能力的增强是由于Ce3+掺杂的催化剂带正电荷,与负电荷(阴离子型)的有机污染物(甲基橙)形成静电吸附,增大了物理吸附.而且稀土离子可与偶氮染料发生络合反应,形成螯合物[7],从而形成化学吸附.

表1 甲基橙在Ce3+-TiO2催化剂粉末上的吸附常数及相关系数
2.3 铈离子的掺杂量对甲基橙降解的影响
图4为稀土Ce3+掺杂二氧化钛(Ce3+-TiO2)光催化降解甲基橙的效果图,由图4可知,在0 min(即暗反应30 min),甲基橙的浓度由起始0.045 mmol·L-1,随 Ce3+掺杂量的增加逐渐降为 0.019 2 mmol·L-1,表明在2.0%Ce3+-TiO2的表面有57.4%甲基橙被吸附.当光照60 min后,掺杂量为2.0%Ce3+-TiO2对降解甲基橙的降解率为0.009 8 mmol·L-1.甲基橙的降解率随 Ce3+掺杂量的增大而降低,这与很多文献以及我们前期的研究不一致,可能由于TiO2的光催化是界面反应,Ce3+掺杂TiO2的吸附能力超强,阻碍光的利用率,使产生的空穴和电子减少,因而降解率降低.
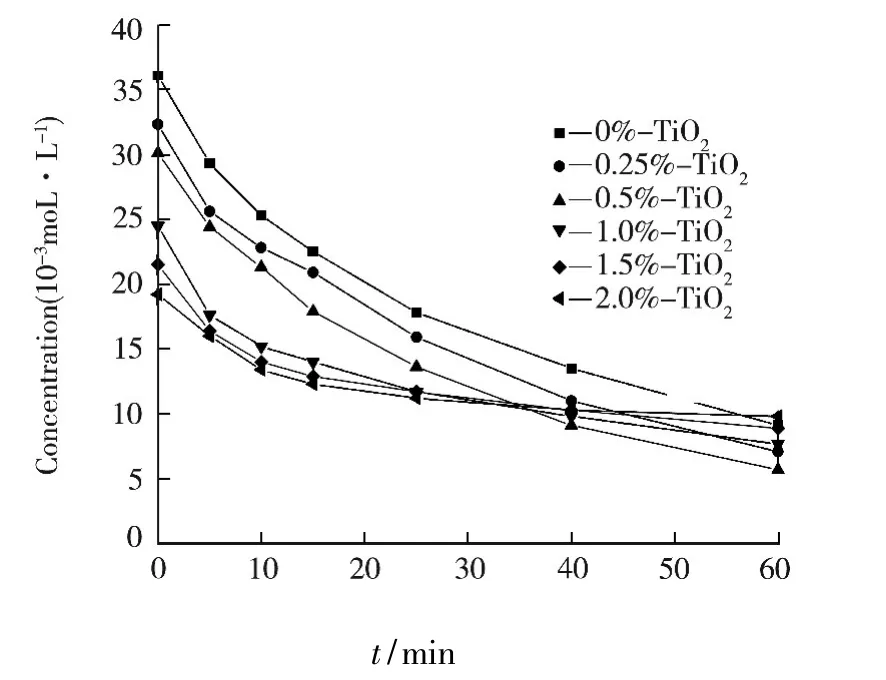
图4 铈离子掺杂对TiO2光催化活性的影响
3 结 论
(1)成功制备了铈掺杂锐钛型的二氧化钛光催化剂,铈掺杂的二氧化钛的光吸收带边红移.
(2)铈离子的掺杂二氧化钛吸附能力超强,阻碍了光的利用率,不利于提高二氧化钛光催化降解甲基橙.
[1] 王蓉,张海燕,王文广,等.二氧化钛阵列-二氧化钛/石墨烯颗粒复合结构光阳极对染料敏化太阳能电池的改善[J].光学学报,2013,33(12):1216001-1_1216001-6.
[2] 梁春华,林红卫.稀土镨掺杂TiO2光催化剂的吸附和光催化活性研究[J].工业水处理,2011,31(6):24-27.
[3] 许士洪,上官文峰,李登新.TiO2光催化材料及其在水处理中的应用[J].环境科学与技术,2008,31(12):94-98.
[4] 陈琳,杨苏东,王传义,等.二氧化钛光催化材料及其改性技术研究进展[J].离子交换与吸附,2013,29(1):86-94.
[5] Chursanova M V,Dzhagan V M,Yukhymchuk V O et al.Nanostructured Silver Substrates With Stable and U-niversal SERS Properties:Application to Organic Mole-[J].Nanoscale Research Letters,2010,5(2):403-409.
[6] Jr.M B,Moronne M,Gin Pet al.Semiconduct or Nanocrystals as Fluorescent Biological Labels[J].Science,1998,281:2013-2016.
[7] Guo R,Wu Y C,Fu P Z,et al.Optical transition probabilities of Pr3+ion La2CaB10O19crystal[J].Chemistry and Physics Letter,2005,416:133-136.

