子宫结合带干细胞的培养与鉴定
康康,王蔼明,尹善德,赵勇,王明凯,黄绍敏
间充质干细胞(m esenchym al stem cells,MSCs)属于成体干细胞,是一种具有自我更新和多向分化能力的多能细胞[1],子宫内膜干细胞在2004年被发现并分离出来,目前已应用于多种临床试验及动物实验[2-4]。虽然子宫内膜再生能力强,其应用价值已得到一定程度的肯定,但毕竟数量有限,而子宫结合带组织标本充足,与子宫内膜具有相似性[5]和相同的胚胎起源[6-7],其厚度变化与子宫内膜一样具有周期性,且探索子宫结合带组织中是否含有MSCs具有重要意义。近年来,有学者提出子宫内膜异位症(EH)的干细胞学说,认为EH病灶中的终末细胞不能维持病灶的长期发展[8-10],且已有研究发现EH患者子宫结合带的厚度发生改变,甚至有学者提出可通过结合带的厚度改变来诊断EH[11]。若子宫结合带中含有MSCs,即子宫结合带干细胞(uterine junctional zone stem cells,uJZSCs),其是否参与了EH的发生发展仍有待探究。本研究观察子宫结合带细胞形态,贴壁情况,表面标志物表达情况,细胞生长动力学特征以及成脂、成骨诱导分化能力,旨在综合评估子宫结合带是否可作为MSCs的来源。
1 材料与方法
1.1 样本来源及处理 子宫结合带组织由海军总医院手术室提供,均取自育龄期女性,年龄30~52岁,因子宫肌瘤、宫颈癌、卵巢癌而行子宫切除术(术前3个月内未服用激素类药物)。所取组织均远离患处2cm以上,首先去除子宫内膜组织,用无菌生理盐水反复冲洗后,获取子宫结合带组织(均由病理学证实[12]),置入无菌生理盐水中,2h内送实验室培养。所有子宫结合带组织均经病理检查排除子宫内膜,标本留取经本院伦理委员会批准,征得患者同意并签署知情同意书。
样本的处理及培养:样本送至实验室后,用磷酸盐缓冲液(PBS)反复洗涤,直至去除红细胞,将标本剪成10mm3小块,加入2倍体积0.25%胰酶,置于37℃水浴箱中消化30m in,加入等体积含10% FBS的IMDM培养基中止消化。以2500r/m in离心10m in,并用PBS洗涤2次,加入2倍体积0.1%胶原酶Ⅰ消化2h,2000r/m in离心8m in,用PBS清洗2次后接种到培养瓶中,置于37℃、5%CO2孵箱中培养,72h后半量更换培养基,之后每周更换2次。
1.2 试剂与仪器 IMDM培养基及试剂购于Gib co公司,胎牛血清(FBS)购于四季清公司,CCK-8试剂盒购于Do jindo公司,CD13-FITC、CD29-APC、CD44-PE、CD90-FITC、CD14-APC、CD19-APC、CD34-PE、CD45-FITC、CD73-PE、CD105-PercP、CD166-PE、HLA-DR-APC、HLA-ABC-FITC购于BD公司。流式细胞仪(型号为BD FACS Calibu r)购于BD公司。
1.3 u JZSCs形态学观察 细胞接种后72h半量换液,7d后全量换液,去除未贴壁细胞,待细胞融合程度达80%~90%时,用0.125%胰酶消化后传代,并于每一代传代前用倒置显微镜拍照记录。
1.4 u JZSCs细胞表面标志物分析 取第3代对数生长期细胞进行免疫表型分析,鉴定所培养的细胞为MSCs,用0.1%胰酶消化并采集细胞,制成1×106/m l的单细胞悬液,分别向预先加入抗体CD13-FITC、CD29-APC、CD44-PE、CD90-FITC、CD14-APC、CD19-APC、CD 34-PE、CD 45-FITC、CD73-PE、CD105-PercP、CD166-PE、HLA-DR-APC、HLAABC-FITC的Falcon管各加100μl细胞悬液,以大鼠IgG1-FITC、IgG1-APC、IgG1-PE、IgG1-PercP为阴性对照。避光孵育20m in,PBS洗涤2次,重悬后进行流式细胞仪检测。采用CellQuest Pro对数据进行分析。
1.5 u JZSCs细胞存活率测定 取第3代对数生长期细胞,0.1%胰酶消化,采集细胞,制成1×106/m l单细胞悬液,重悬,加7-AAD染色,涡旋震荡均匀,避光15m in,PBS洗涤2次后,4℃避光保存,立即用流式细胞仪(型号为BD FACS Calibu r)进行检测。采用CellQuest Pro对数据进行分析。
1.6 u JZSCs细胞周期测定 取第3代对数生长期细胞,0.1%胰酶消化后采集细胞,制成1×106/m l的单细胞悬液,向Falcon管中加入-20℃预冷的75%乙醇2m l,再迅速加入100μl细胞悬液,涡旋震荡均匀,-20℃放置3h。将固定好的细胞1500r/m in离心5m in,弃上清;涡旋震荡均匀,加入RNaseA(20m g/m l)10μl,37℃水浴30m in;水浴后将样品置于4℃冰箱10m in终止酶反应;加入5μl的碘化丙啶(PI)溶液,4℃避光孵育30m in;涡旋震荡均匀,离心,4℃避光保存,3h内用流式细胞仪进行检测。采用CellQuest Pro对数据进行分析。
1.7 u JZSCs生长曲线测定 将第3代对数生长期细胞以1×103个/孔的密度接种于96孔板,设置4个复孔,同时设置调零孔,分别于第1~8天同一时间加入10μl CCK-8,孵育2h后用酶标仪进行检测,在450nm条件下检测吸光度(A)值,并绘制生长曲线。
1.8 u JZSCs诱导分化能力鉴定 成脂分化:将P5代细胞按照2.1×106/cm2密度接种,置于37℃、5%CO2孵箱中培养,待细胞完全融合后更换成脂分化完全培养基A,72h后更换成脂分化诱导完全培养基B,如此循环3~5次后,用成脂分化诱导完全培养基B继续维持7d,每3d换液1次;分化诱导完成后固定,油红O染色,光镜下观察并拍照。
成骨分化:将P5代细胞按照3.1×103/cm2密度接种,置于37℃、5%CO2孵箱中培养,直至间质干细胞达到50%~70%融合,然后更换成成骨诱导分化培养基,每3d换液1次;分化诱导完成后固定,茜素红染色,光镜下观察并拍照。
成软骨诱导分化:将P5代细胞按照5×105/m l密度加入成软骨分化培养基重悬细胞,吸取10μl滴到6孔板上,放置24h后加入新鲜的诱导分化培养基,21d后用阿利信蓝染色,光镜下观察并拍照。1.9 统计学处理 采用SPSS 17.0软件进行统计分析。计量资料以±s表示,组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 u JZSCs的形态学特点 原代细胞接种后第3天半量换液,可见少量贴壁细胞;于第7天全量换液,此后细胞迅速贴壁,细胞集落明显增大、增多,接种后第10~14天细胞达80%~90%融合。传代后细胞3~6h贴壁,细胞融合并呈长梭形,漩涡状生长,3~4d后细胞传代(图1)。
2.2 u JZSCs细胞表面标志物分析 流式细胞仪检测结果显示,第3代u JZSCs表面标志物CD90、CD73、CD105、CD29、CD44、CD13、CD166、HLA-ABC的表达呈阳性,而造血干细胞表面标志物CD34、CD45、CD14、HLA-DR、CD19呈阴性表达(图2)。
2.3 u JZSCs细胞存活率分析 流式细胞仪检测结果显示,u JZSCs细胞存活率(94.32%±0.96%)较高,细胞生长状态好,适应环境能力强(图3)。

图1 u JZSCs的P0(A、B)和P3(C、D)代细胞(×100)Fig.1 u JZSCs at passage 0 (A and B) and passage 3 (C and D) (×100)
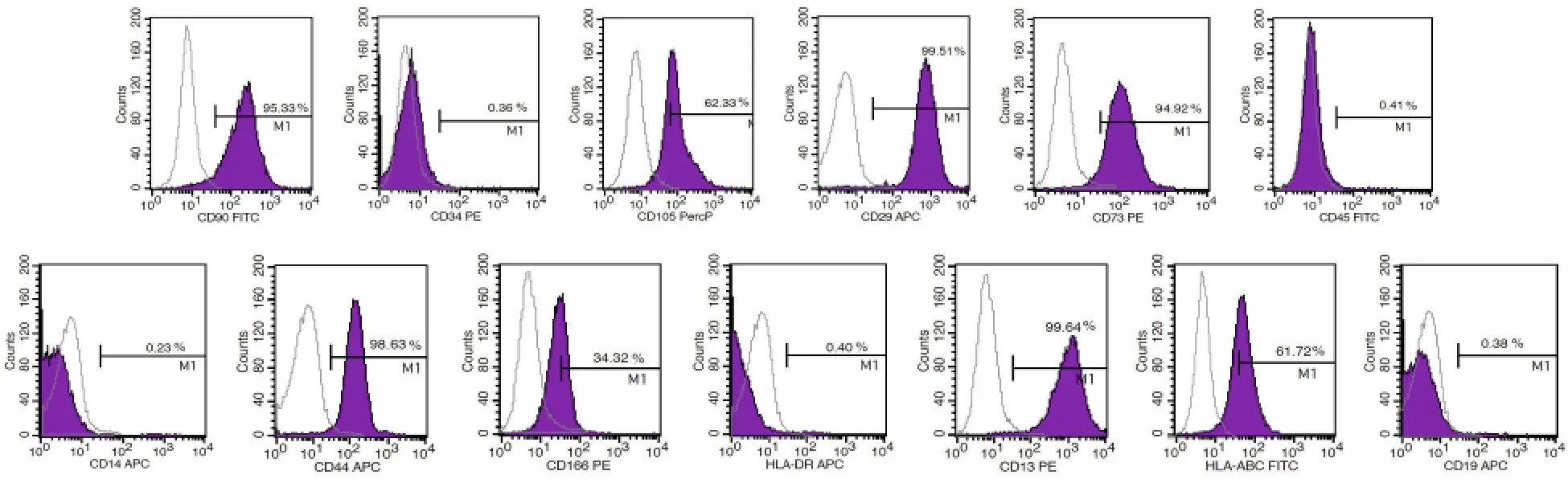
图2 u JZSCs表面标志物表达Fig.2 Exp ression of cell su rfactan ts in cu ltu red u JZSCs (Flow cytom etry)
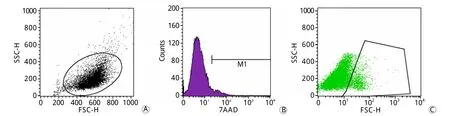
图3 u JZSCs细胞活率检测结果Fig.3 Cell viab ility of cu ltu red EnMSCs (Flow cytom etry)A. Ce ll d istribu tion; B. Histog ram of ce ll viab ility; C. Scatterp lo t of ce ll viab ility
2.4 u JZSCs细胞周期分析 采用流式细胞术测定各周期细胞的百分比,结果显示处于DNA合成期的细胞比例较高(G2+S期为30.3%),u JZSCs的增殖能力相对较强(图4)。
2.5 u JZSCs细胞的生长曲线 细胞传代后,增殖曲线呈S型,1~3d生长速度较慢,属于潜伏期,4~6d进入对数生长期,于7~9d进入平台期,此时细胞已达到90%~95%融合(图5)。
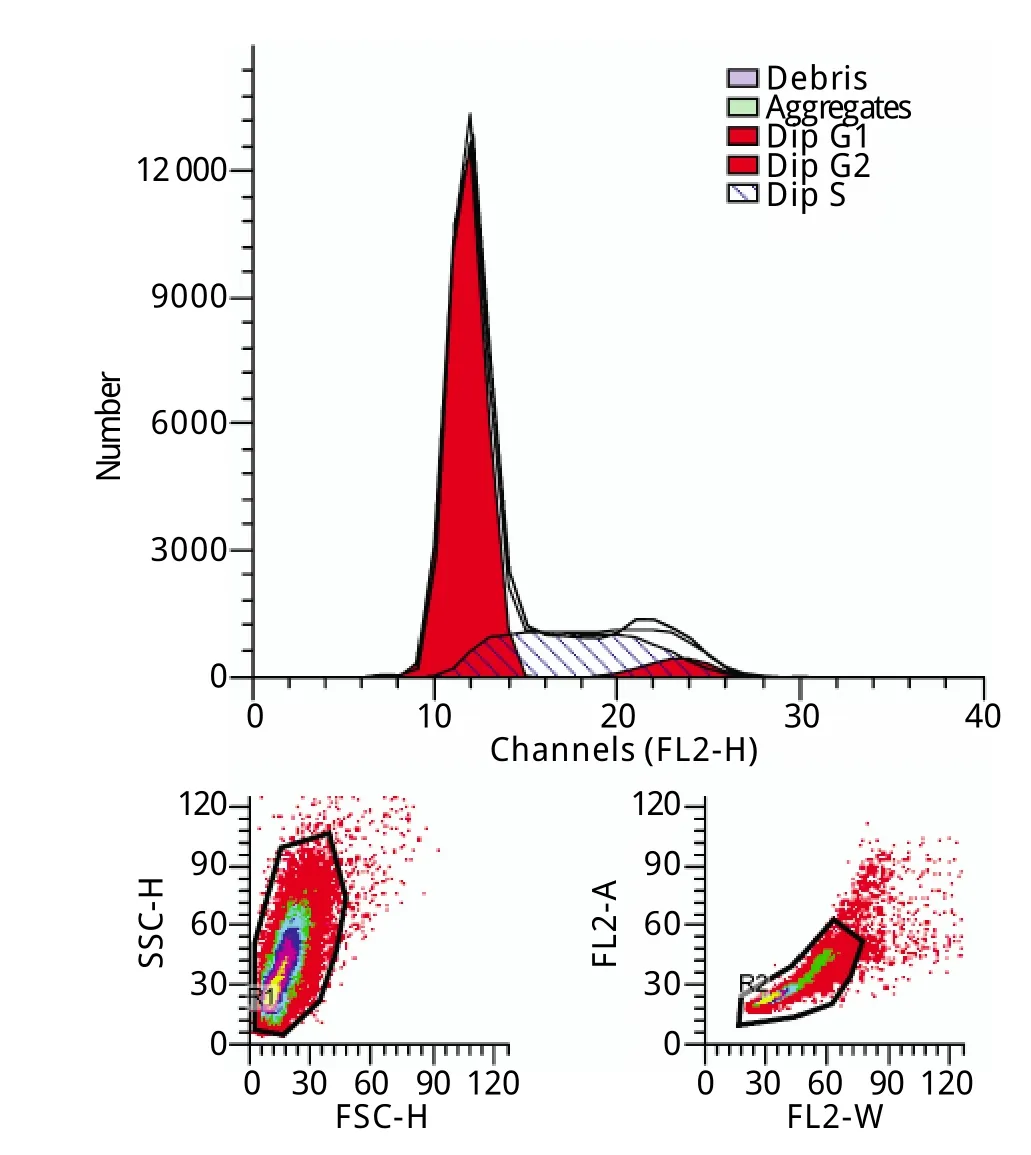
图4 u JZSCs细胞周期检测结果Fig.4 Cell cycle analysis of u JZSCs (Flow cytom etry)

图5 u JZSCs细胞生长曲线Fig.5 The grow th curve of u JZSCs in p resent experim ent
2.6 u JZSCs成脂、成骨、成软骨诱导分化结果成脂分化:u JZSCs经成脂诱导分化21d后,油红O染色倒置显微镜下观察可见细胞质中充满红色的油滴(图6A)。成骨分化:u JZSCs经成骨诱导分化21d后,采用茜素红进行钙化结节染色,可见致密生长的细胞中散在出现大小不一的橘红色矿化结节(图6B)。成软骨分化:u JZSCs经成软骨诱导分化21d后,采用阿利辛蓝对细胞团进行染色,可见大小不一的蓝色结节(图6C)。
3 讨 论
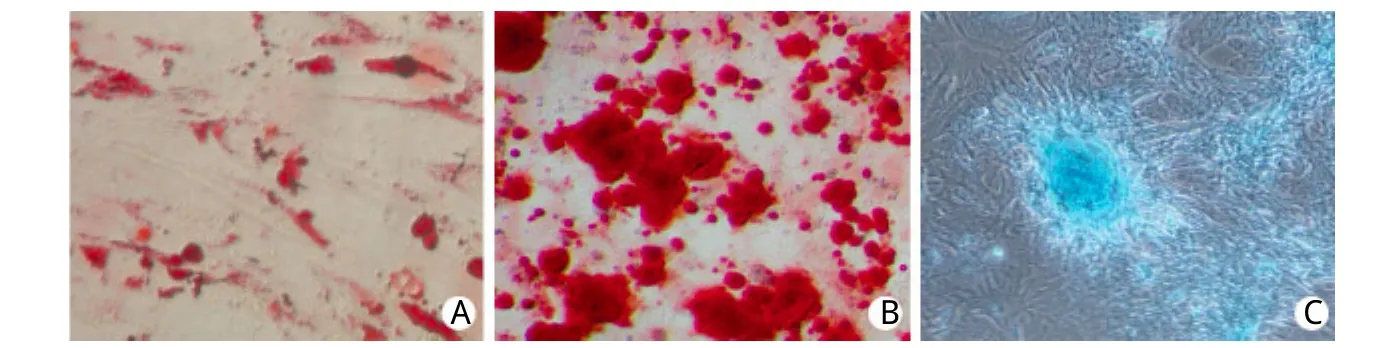
图6 光镜下观察u JZSCs的诱导分化(×100)Fig.6 Induced d ifferen tiations of u JZSCs (×100)A. Ad ipogenic (Oil red O); B. Osteogenic (Alizarin red); C. Chond rogen ic (Alcian b lue)
骨髓是基础研究和临床治疗所用MSCs的主要来源之一,但是获取骨髓MSCs是有创的,且所获细胞数量非常有限[13-15]。因此,人们一直在从更方便获得和更优质两方面努力寻找替代骨髓MSCs的新来源[16]。目前已从一些废弃的组织,例如脂肪、乳牙、胎盘和脐带中发现了M SCs[17],但是这些MSCs是否可应用于临床治疗,以及如何从这些新来源中选出更优质的MSCs仍有待探索。
本实验的取材主要是子宫肌层的内1/3,即子宫结合带,又称黏膜下肌层[18],其平滑肌束与内膜基底层平行走行。核磁共振上显示的子宫结合带是分辨清晰的低信号带影像,与结合带内侧的内膜高信号影像和结合带外侧的子宫外肌层中等信号影像界限清楚[19]。虽然子宫内膜MSCs具有高度增殖能力及自我更新分化潜能[20],且近年来因子宫肌瘤、宫颈癌、卵巢癌等妇科疾病切除子宫的患者也逐渐增多,但是从子宫内膜基底层获得的细胞仍很有限,且子宫内膜与外界相通,容易发生污染,尤其是对于阴道炎和宫颈HPV感染的患者,而子宫结合带部分占子宫组织的1/3,是充足的组织来源,可以获得足够用于干细胞治疗的细胞数量且不易发生污染。
本研究结果显示,u JZSCs呈梭形、放射状生长,贴壁能力强,MSCs表面标志物的表达多数在90%以上,成骨、成脂、成软骨诱导分化能力强,从而证实从子宫结合带分离出来的细胞为MSCs,符合国际鉴定MSCs的标准[1]。流式细胞术检测细胞活率数据稳定,以细胞的流速评价细胞数量,联合使用区分活细胞与死细胞的染料,可用于细胞存活率的测定[21]。从本研究结果来看,细胞成活率很高,为94.32%±0.96%,比较容易适应环境;从细胞周期结果来看,处于G2+S期的细胞百分比高,具有较强的增殖能力,在培养过程中,死亡细胞及细胞碎片少,是干细胞治疗较为理想的来源。
综上所述,本研究结果表明,可成功从子宫结合带中分离出u JZSCs,且该干细胞表达典型的MSCs表面抗原,具有较强的增殖能力以成脂、成骨、成软骨分化特性。此外,u JZSCs还具有组织充足,易分离,不易污染等优势。对于u JZSCs的研究,目前尚处于起步阶段,相关研究仍有待进一步深入。
[1] Dom inici M, Le Blanc K, Mueller I, et al. Minim al criteria for defining m u ltipotent m esenchym al strom al cells. The International Society for Cellular Therapy position statem ent[J].Cytotherapy, 2006, 8(4): 315-317.
[2] Verdi J, Tan A, Shoae-Hassani A, et al. Endom etrial stem cells in regenerative m ed icine[J]. J Bio l Eng, 2014, 8(1): 1-10.
[3] Su K, Edw ards SL, Tan KS, et al. Induction of endom etrial m esenchym al stem cells into tissue-form ing cells suitable for fascial repair[J]. Acta Biom aterialia, 2014, 10(12): 5012-5020.
[4] Bockeria L, Bogin V, Bockeria O, et al. Endom etrial regenerative cells for treatm ent of heart failure: a new stem cell enters the clinic[J]. J Transl Med, 2013, 11: 56.
[5] Wiczyk HP, Janus CL, Richards CJ, et al. Com parison of m agnetic resonance im aging and ultrasound in evaluating follicular and endometrial developm ent throughout the normal cycle[J]. Fertil Steril, 1988, 49(6): 969-972.
[6] Donnez J, Niso lle M. Hysteroscop ic lysis of in trau terine adhesions (Asherm an's synd rom e)[M]//Donnez J, Nisolle M.Atlas of laser operative laparoscopy and hysteroscopy. New York:Press-Parthenon, 1994. 305-322.
[7] Nasr AL, Al-Inany HG, Thabet SM, et al. A clinicohysteroscopic scoring system of intrauterine adhesions[J]. Gynecol Obstet Invest, 2000, 50(3): 178-181.
[8] Gargett CE, Chan RW, Schwab KE. Endom etrial stem cells[J].Curr Opin Obstet Gyneco l, 2007, 19(4): 377-383.
[9] Gargett BE, Chan RW. Endom etrial stem/progenitor cells and proliferative disorders of the endom etrium[J]. Minerva Ginecol,2006, 58(6): 511-526.
[10] Wang YQ, Yin LR. Advances in endometriosis stem cell doctrine research [J]. Tianjin Med J, 2013, 41(10): 1034-1036. [王宇全,尹利荣. 子宫内膜异位症的干细胞学说及其研究进展[J].天津医药, 2013, 41(10): 1034-1036.]
[11] Tosti C, Zup i E, Exacoustos C. Could the uterine junctional zone be used to identify early-stage endometriosis in women[J]?Wom ens Hea lth (Lond Eng l), 2014, 10(3): 225-227.
[12] Brosens I, Derw ig I, Brosens J, et al. The enigm atic u terine junctional zone: the m issing link between reproductive disorders and m ajor obstetrical d isorders[J]? Hum Rep rod, 2010, 25(3):596-574.
[13] Choudhery MS, Badow ski M, Muise A, et al. Com parison of hum an m esenchym al stem cells derived from adipose and cord tissue[J]. Cyto therapy, 2013, 15(3): 330-343.
[14] Mueller SM, Glow acki J. Age-related decline in the osteogenic poten tial of hum an bone m arrow cells cu ltu red in th reedim ensional collagen sponges[J]. J Cell Biochem, 2001, 82(4):583-590.
[15] Stenderup K, Justesen J, Clausen C, et al. Aging is associated with decreased m axim al life span and accelerated senescence of bone m arrow strom al cells[J]. Bone, 2003, 33(6): 919-926.
[16] de Giro lam o L, Lucarelli E, Alessand ri G, et al. Mesenchym al stem/strom al cells: a new "cells as d rugs" paradigm. Efficacy and critical aspects in cell therapy[J]. Curr Pharm Des, 2013,19(13): 2459-2473.
[17] Chen Y, Li D, Zhang Z, et al. Effects of hum an um bilical cord m esenchym al stem cells on nerve fibers in the lesions of rat endom etriosis m odel[J]. J Shandong Univ (Health Sci), 2013,51(3): 48-51+57. [陈岩, 李栋, 张哲, 等. 人脐带间充质干细胞对大鼠子宫内膜异位症病灶神经纤维的影响[J]. 山东大学学报(医学版), 2013, 51(3): 48-51+57.]
[18] Lazzarin N, Exacoustos C, Vaquero E, et al. Uterine junctional zone at th ree-d im ensional transvaginal u ltrasonography in patients with recurrent m iscarriage: a new d iagnostic too l[J]?Eu r J Obstet Gyneco l Rep rod Bio l, 2014, 174: 128-132.
[19] Liu JY, Wan YD. The uterine junctional zone: histo logic basis of MRI find ings[J]. Foreign Med sci: Clin Rad io l, 2008, 31(4):257-260. [刘竞艳, 万业达. 子宫结合带正常MRI表现的组织学基础[J]. 国外医学临床放射学分册, 2008, 31(4): 257-260].
[20] Verdi J, Tan A, Shoae-Hassani A, et al. Endom etrial stem cells in regenerative m ed icine[J]. J Bio l Eng, 2014, 8: 20.
[21] Liu Y, Lai Y, Li MH, et al. Developm en t of an assay fo r the detection of the survival rates of cells by flow cytom etry[J]. Int J Lab Med, 2011, 32(15): 1663-1664. [刘阳, 赖翼, 李敏惠, 等.流式细胞术检测细胞存活率的方法学建立[J]. 国际检验医学杂志, 2011, 32(15): 1663-1664].

