HPV E6/E7 mRNA表达量与宫颈癌患者预后的关联研究*
杨 岚 王 娟 崔 彬 徐兰兰 王丽峰
(廉江市人民医院,广东 湛江 524400)
HPV E6/E7 mRNA表达量与宫颈癌患者预后的关联研究*
杨岚王娟崔彬徐兰兰王丽峰
(廉江市人民医院,广东 湛江524400)
摘要:目的研究HPV E6/E7 mRNA的表达量与宫颈癌患者预后的关系。方法实时荧光定时PCR检测宫颈癌患者癌旁正常组织和癌组织中HPV E6/E7 mRNA的表达情况;分析HPV E6/E7 mRNA的表达量与宫颈癌临床病理特征、患者预后的关系。结果宫颈癌组织中HPV E6/E7 mRNA的表达明显高于癌旁正常组织。高表达HPV E6/E7 mRNA与肿瘤大小(P=0.025)和癌旁浸润(P=0.031)呈正相关。另外,高表达HPV E6/E7 mRNA还与低总生存率(P=0.032)和无瘤生存率(P=0.02)相关。多变量分析发现,HPV E6/E7 mRNA的表达是一个独立的预后因子。结论HPV E6/E7 mRNA的表达在宫颈癌的发生、发展中起重要作用,是患者预后的重要评价因子。
关键词:宫颈癌;HPV E6/E7 mRNA的表达;预后
宫颈癌是世界第三大妇科恶性肿瘤,在发展中国家的肿瘤相关死亡事件中占第一位[1]。统计资料显示,全世界每年新发病例46.6万,其中80%来自发展中国家,患者临床特征隐匿,预后差。随着近年来对宫颈癌普查工作的广泛开展,宫颈癌预后因素研究也有了新的进展。尽管宫颈癌患者的预后有了很大的改善,但是患者的5年生存率仍然低于40%[2]。其中一个主要问题就是高转移和复发性。大约30%以上的病人由于没有很好的治疗而死于这种肿瘤的转移和复发[3]。因此,需要寻找新的有效的生物标记物来预测宫颈癌的进程。
1974年,Zur hausen首次提出人乳头瘤病毒(HPV)感染与宫颈癌有密切关系[4]。HPV属于乳头瘤病毒家族,是球状DNA病毒。HPV病毒能引起皮肤粘膜增生,持续刺激角化细胞,并提供细胞有丝分裂增殖的癌基因而导致肿瘤的发生[5]。与HPV DNA的检测不同,对病毒RNA的检测可以检测有转录活性的病毒。HPV E6/E7 mRNA作为受感染细胞中E6/E7癌基因持续表达的标志,可以作为一种肿瘤标记物[6]。故癌基因E6、E7 mRNA是目前宫颈癌最佳的风险评估指标。病毒癌基因E6、E7 mRNA检测目前在欧美开展的较为广泛。因此,宫颈癌筛查的发展趋势由简单关注是否有高危型HPV感染,向关注是否有病毒癌基因E6、E7 mRNA转录方向发展[7]。
HPV E6/E7 mRNA表达检测作为宫颈癌早期筛查已得到广泛的应用,但是HPV E6/E7 mRNA与宫颈癌患者疾病进程和预后的相关性却未见有报道。本研究分析了HPV E6/E7 mRNA的表达与临床病理特征的关系,旨在通过HPV E6/E7 mRNA的表达水平评价患者预后的临床价值。
1资料与方法
1.1 临床资料
收集宫颈癌疑似病例60例(纳入标准为重度宫颈炎、宫颈糜烂、接触性出血、宫颈肿物等),患者均未经治疗,分别取宫颈脱落细胞及宫颈活检组织。患者年龄25~66岁,中位年龄43岁。所有研究对象均进行宫颈液基细胞学检查和用宫颈拭子获取脱落细胞进行HPV E6/E7 mRNA检测及病理活检。
1.2 实验方法
1.2.1 样品采集检测HPV E6/E7 mRNA 均使用一次性取样器插入官颈管顺时针方向旋转5圈,收集宫颈口鳞柱交界的脱落上皮细胞,并将采样刷头部放入装有RNA抽提液的小瓶内,将样本按顺序编号,用于脱落细胞的HPV E6/E7 mRNA检测。
1.2.2 RNA提取和实时荧光定量PCR细胞用PBS洗两次,加入1 ml TriReagent,用移液器吹打几次裂解混匀;室温放置5 min使核蛋白充分分离;加入 200 μl 氯仿,盖紧管盖,剧烈振荡15 s,室温放置5 min;4 ℃、12000 g,离心15 min,转移约400 μl水相到另一新的1.5 ml EP;加入500 μl 异丙醇1 ml,充分混匀,室温放置5 min;4°C,12000 g,离心10 min,弃上清;加入1 ml 70% 乙醇洗涤RNA沉淀;4 ℃,7500 g ,离心5 min,弃上清;沉淀风干3~5 min后加入40 μl DEPC处理水溶解RNA沉淀,测定RNA浓度和完整性,-70 ℃保存。以GADPH作为持家基因的对照,每个RNA样品做3个平行对照,利用SYBP Green kit,在7300检测系统(Applied Biosystems)中扩增HPV E6/E7基因。
1.2.3 HPV E6/E7 mRNA检测将宫颈脱落细胞样本倒入离心管,3 000 r/min离心5 min后倒掉上清液。加入1 ml超纯水,振荡器振荡使细胞全部混悬,加入300 μl裂解液和3 μl蛋白酶K,65 ℃孵育30 min后加入终止反应液终止反应。利用宫颈稳态检测试剂盒进行测试,直接捕获待测物质放大被检目标,杂交捕获待测物,经三步信号放大,快速将反应板放入冷光仪,经计算软件自动读取HPV E6/E7 mRNA拷贝数值。结果判定:HPV RNA阳性判断标准为检测样本的平均拷贝数值> 1.0。
1.3随访
通过住院病历及电话每1~2个月定期了解患者术后治疗、复查情况、复发时间、死亡时间等。随诊包括:盆腔和腹部检查、锁骨上淋巴结是否肿大、巴氏涂片和胸片,同时采用CT、MRI或正电子发射断层扫描术(PET)检查。
1.4 统计学分析
所有统计学分析均在SPSS 16.0软件进行。 临床分析用来评价HPV E6/E7 mRNA表达水平与临床病理特征的关系。Kaplan-Meier方法绘制患者的生存曲线。利用COX 比例风险模型进行多元生存分析。P值小于0.05认为具有统计学差异。
2结果
2.1 HPV E6/E7 mRNA 在癌旁正常组织和宫颈癌组织中的表达情况
通过实时荧光定时PCR技术,我们首先分析了HPV E6/E7 mRNA 在癌旁正常组织和宫颈癌组织中的表达情况。如图1所示,在分析的6例患者中,宫颈癌组织中HPV E6/E7 mRNA的表达均明显高于癌旁正常组织。

图1 荧光定量PCR检测癌旁正常组织
2.2 HPV E6/E7 mRNA的表达量与宫颈癌临床病理特征的关系
为了明确HPV E6/E7 mRNA的表达量在宫颈癌中的临床重要性,我们分析了HPV E6/E7 mRNA的表达水平与相关病理特征的联系。从表1可以看到,HPV E6/E7 mRNA的表达与肿瘤的大小和癌旁浸润密切相关(P=0.025和P=0.031)。HPV E6/E7 mRNA表达越高的患者肿瘤越大,癌旁组织浸润越明显。但是与患者的年龄、肿瘤分级、分化情况和淋巴结转移没有相关性。2.3 HPV E6/E7 mRNA的表达量与患者预后的关系
通过对患者的随访分析发现,HPV E6/E7 mRNA的表达量高的患者总生存率明显低于HPV E6/E7 mRNA的表达量低的患者(图2,P=0.032)。并且无瘤生存率也明显低于HPV E6/E7 mRNA的表达量低的患者(图3,P=0.02)。

表1 HPV E6/E7 mRNA的表达量
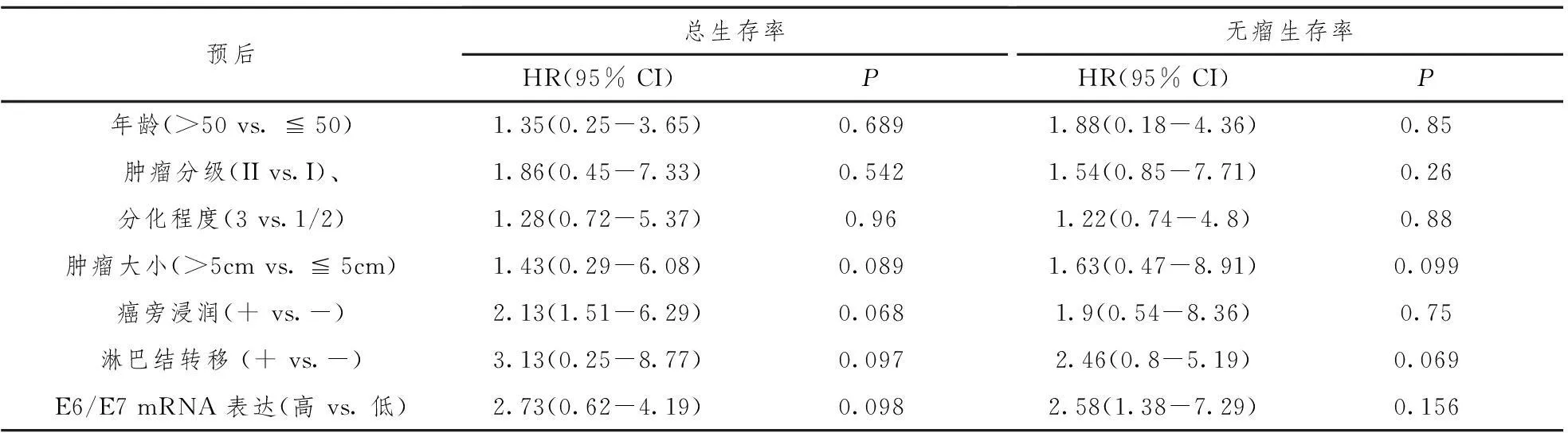
表2 COX 比例风险模型分析宫颈癌患者生存率
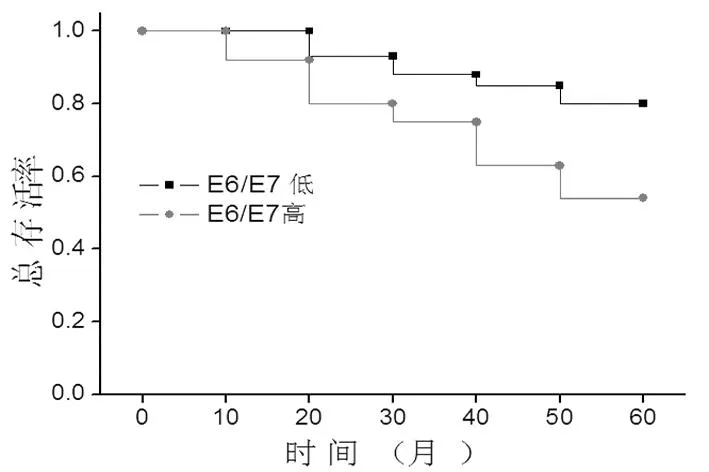
图2 患者总生存率比较分析
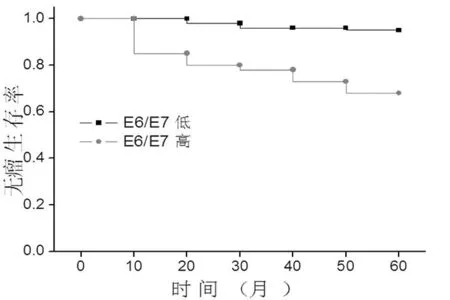
图3 患者无瘤生存率比较分析
通过COX 比例风险模型进行多元生存分析发现HPV E6/E7 mRNA的表达是独立的预后因子(表2)。
3讨论
宫颈癌是一高发的妇科肿瘤,尽管现在早期宫颈癌的诊断率比以前大为提高,但仍然有部分患者治疗效果差预后不良,这就决定了对宫颈癌预后研究的重要性。在肿瘤治疗中,发现特异、敏感的肿瘤分子标记物至关重要。在本研究中,我们观察到HPV E6/E7 mRNA的在癌旁正常组织和宫颈癌组织中的差异表达。另外,我们证明了HPV E6/E7 mRNA的表达与宫颈癌临床病理特征的联系。肿瘤的大小和癌旁浸润与HPV E6/E7 mRNA的表达呈正相关。另外,统计学分析发现,HPV E6/E7 mRNA的高表达与患者较差的预后相关。我们的研究提示HPV E6/E7 mRNA的表达与宫颈癌的发展密切相关。
HPV感染与宫颈癌的关系已有大量的研究[8]。研究表明95%的宫颈癌患者合并有HPV感染,因此认为HPV感染是宫颈癌的主要病因[9]。HPV感染过程通常分为潜伏感染期、亚临床感染期、临床症状期和 HPV相关的肿瘤期。HPV可潜伏若干年#一旦机体免疫力降低,潜伏的病毒可恢复活动[10]。HPV E6/E7 mRNA 在宫颈癌组织中表现为癌基因活性[11]。在大多数病例中,HPV感染自发性退变,只有一小部分进展为高级别病变,而HPV E6/E7 mRNA的持续表达正是导致细胞恶性转化并发展成高级别病变甚至宫颈癌的必要步骤[12]。HPV E6/E7 mRNA的转录产物E6/E7蛋白通过与抑癌基因P53及肿瘤抑制因子视网膜膜母细胞瘤蛋白pRB相互作用并使它们失活,干扰细胞周期使细胞发生恶性增殖和癌变,参与宫颈癌的发生。由此可见,E6和E7的转录可能是判定疾病进程的重要指标,HPV E6/E7 mRNA可作为检测HPV感染的靶位点。HPV E6/E7 mRNA的检测不仅可以判断病毒基因是否整合入宿主基因组中,还可更好的区分HPV处于何种状态,以提高宫颈癌早期筛查和分类[13]。
肿瘤的大小、癌旁组织浸润是影响宫颈癌预后的重要因素之一。肿瘤原发灶的大小与其浸润这二者本身就存在着相关性,因为肿瘤体积越大则其朝深间质浸润甚至宫旁浸润的机率也就越大。多因素分析显示,临床分期和宫颈深肌层浸润是淋巴结转移最主要的高危因素。72%的淋巴结转移者同时存在宫颈深间质浸润,而90.9%的宫旁侵犯者存在淋巴结转移阳性[14]。临床研究还发现,当宫颈鳞癌的肿瘤体积1cm时无一宫旁或宫颈旁受累及,当体积大于1cm者宫颈旁受侵和淋巴结转移率显著上升[15]。这一实验研究强有力的证明了肿瘤的大小、宫旁或宫颈旁浸润与淋巴结转移这三者之间的关系。在本研究中,我们发现,HPV E6/E7 mRNA与肿瘤体积大小和癌旁浸润呈现正相关性,但是与淋巴结转移没有相关性。我也支持我们后续的观察:HPV E6/E7 mRNA的高表达与较差的预后相关联。
HPV E6/E7 mRNA作为宫颈癌早期筛查、诊断的指标已经在临床得到广泛的应用,但是HPV E6/E7 mRNA与患者预后的关联却没有报道。我们的研究数据第一次将HPV E6/E7 mRNA与患者的预后联系起来,提示HPV E6/E7 mRNA表达高是宫颈癌患者较差预后的新的分子标记。因此,通过分析患者HPV E6/E7 mRNA的表达高低,不仅可以阐明宫颈癌的发生发展、预测预后,更重要的是可以指导临床治疗,因此具有广阔的发展前景。
参考文献:
[1]Colombo N, Carinelli S, Colombo A, Marini C, Rollo D and Sessa C. Cervical cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2012, 23(7): vii27-32.
[2]Arbyn M, Castellsague X, de Sanjose S, et al. Worldwide burden of cervical cancer in 2008[J]. Ann Oncol, 2011, 22(12): 2675-2686.
[3] Tao X, Hu W, Ramirez PT and Kavanagh JJ. Chemotherapy for recurrent and metastatic cervical cancer[J]. Gynecol Oncol, 2008,110(3 Suppl 2):S67-71.
[4]Kruse AJ, Skaland I, Janssen EA, et al. Quantitative molecular parameters to identify low-risk and high-risk early CIN lesions: role of markers of proliferative activity and differentiation and Rb availability [J]. Int J Gynecol Pathol, 2004, 23(2):100-9.
[5]贾政军,周玉春,胡 蓉,等.HPV E6/E7 mRNA和HC2-HPV-DNA检测对宫颈病变筛查的意义[J]. 湖南师范大学学报(医学版). 2012,9(4)51-54.
[6]Pietrzak B, Mazanowska N, Ekiel A. M., et al. Prevalence of high-risk human papillomavirus cervical infection in female kidney graft recipients : an observational study[J]. Virol J,2012,9(9):117-122.
[7]周星,赵文明,陈雪,等. HPV E6/E7 mRNA检测在宫颈癌筛查中的应用[J]. 中国热带医学。 2014,14(12):1493-1496.
[8]Katase K, Teshima H, Hirai Y, et al. Natural history of cervica human papillomavirus lesios[J]. Intervirology, 1995, 38(3-4):192-194.
[9]Czegledy J, Veress G, Konya J, et al. Genital human papillomavirus (HPV) infection in Hungarian women [J]. Aacta Microbiologyca Hungarica, 1993,40(2):115-122.
[10] 黄宝英,周伦顺,富显果,等. HPV E6/E7 mRNA检测对宫颈癌筛查意义的初步评价 [J].中华肿瘤防治杂志,2013,7(14):1061-1064.
[11]Lie AK, Kristense G. Human papillomavirus E6/E7 mRNA testing as a predictive marker for cervical cancinoma[J]. Expert Rev Mol Diagn, 2008, 8(4):405-415.
[12]Adriana Vince, Snjezana Zidovec Lepej. Diagnostic methods and ftechniques in cervicai cancer prevention Part II: Molecular diagnostics of HPV infection[J]. Med Glas, 2010,7(11):18-25.
[13]E.A.Brugen,H. Kornon, M. Klemp, et al. HPV mRNA tests for the detection of cervical intraepithelial neoplasia: A systematic review [J]. Gynecologic Oncology, 2011, 120(3):430-438.
[14]宋恩霖,俞薇薇,熊小亮.宫颈癌预后的研究进展 [J]. 实用临床医学,2006,7(12):191-193.
[15]冯淑瑜,张彦娜,留建刚,等.宫颈癌淋巴结转移的高危因素与预后分析[J].Chineses Journal of Cancer,2005,24(10):1261-1266.
Analysis of the relationship between HPV E6/E7 mRNA expression and prognosis of cervical carcinoma
YANGLanWANGJuanCUIBinXULan-lanWANGLi-feng
(Lianjiang people's Hospital,Zhanjiang 524400,China)
Abstract:Objective: To investigate the HPV E6/E7 mRNA expression in cervical carcinoma and to estimate its clinical significance. Methods: The expression of HPV E6/E7 mRNA was evaluated by Real-time PCR in cervical cancer and adjacent normal cervical tissues. The correlation betweenHPV E6/E7 mRNA expression and clinicopathological features were statistically analyzed. Results: HPV E6/E7 mRNA expression was significantly higher in cervical cancer tissues compared with that in adjacent normal cervix. High HPV E6/E7 mRNA expression was positively correlated with tumor size (P= 0.025) and parametrial infiltration(P= 0.031). Moreover, high levels of HPV E6/E7 mRNA was associated with lower overall survival (P= 0.032)and recurrent-free survival (P= 0.02). Multivariate analysis showed that the expression of HPV E6/E7 mRNA was an independent factor of recurrent-free survival for the patients with cervical carcinoma Conclusion: HPV E6/E7 mRNA expression may play an important role in the development and progression of cervical carcinoma, and may be a potential factor for cervical carcinoma prognosis.
Key words:cervical carcinoma; HPV E6/E7 mRNA; prognosis
(收稿日期2015-9-9)
doi:10.3969/j.issn.1004-7115.2015.12.018
中图分类号:R737.3
文献标识码:A
文章编号:1004-7115(2015)12-1369-04
作者简介:杨岚(1973—),女,广东湛江人,副主任医师,本科,主要从事妇科肿瘤及内分泌工作。

