超声波协同酶法提取红芪多糖工艺优化
文 / 李冰, 于长青*, 郝琴, 张晓雪, 魏文慧
(甘肃省轻工研究院 分离技术开发中心 天然产物工程技术研究中心, 甘肃 兰州730000)
超声波协同酶法提取红芪多糖工艺优化
文 / 李冰, 于长青*, 郝琴, 张晓雪, 魏文慧
(甘肃省轻工研究院 分离技术开发中心 天然产物工程技术研究中心, 甘肃 兰州730000)
本研究以甘肃道地药材红芪为研究对象,以超声波协同酶解技术为提取方法,利用单因素试验和响应面分析,优化红芪多糖的提取工艺。结果表明,红芪多糖的最佳提取条件为:提取温度为60.00 ℃,超声功率为120.00 W,溶液pH值为5.0,料液比为1:10,用酶量为0.4%,红芪多糖提取率为5.98%,为超声波协同酶解技术的工业化应用提供理论指导及依据。
超声波; 纤维素酶; 红芪多糖; 提取率
红芪(Radix Hedysari)又叫岩黄芪、晋芪、独根[1],系多序岩黄芪(Hedysarum Poly-botrys Hand.-Mazz.)的干燥根,与黄芪同科异属,为多年生草本[2]。其根多为粗状、深长,外皮暗红褐色的直系根[3];主要分布于甘肃宕昌、武都、岷县、舟曲、临潭、漳县、西和、礼县、武山等地,生于海拔1800~2500米的高原山脊、台地及沟谷边[4,5]。红芪性温、味甘,具有补气固表、利尿排毒、排脓、敛疮生肌等功效[6]。红芪富含多糖、黄酮、皂苷、氨基酸及微量元素等多种有效成分,其中红芪多糖(HPS)因具有提高超氧化物歧化酶活性,增强免疫力、抗衰老、抗肿瘤等多种生物效应,一直成为人们研究的热点[7-10]。
目前,红、黄芪多糖的提取方法多为传统热水浸提法[5]、超声波辅助提取法[11]、微波辅助提取法[12]、酶法提取[5]等方法,研究也主要集中在对某种单一提取方法单因素或多因素的正交优选方面,而对这些提取方法之间的协同作用的研究所见不多。本文以甘肃道地药材红芪为研究对象,以超声波协同酶解技术为提取方法,利用单因素试验和响应面分析,优化红芪多糖的提取工艺,为超声波协同酶解技术的工业化应用提供理论指导及依据。
1、材料与方法
1.1 材料与试剂
红芪(购置于甘肃省陇南市宕昌县);纤维素酶(500000~1400000U/g,甘肃华羚生物科技有限公司);柠檬酸(分析纯,);无水乙醇(分析纯,天津市富宇精细化工有限公司);葡萄糖(分析纯,天津市北辰方正试剂厂);苯酚(分析纯,天津市德恩化学试剂有限公司);浓硫酸(分析纯,天津市百世化工有限公司)。
1.2 仪器与设备
ACS-A型电子天平(上海友声衡器有限公司);CTXNW-10B超声循环提取机(北京弘祥隆生物技术开发有限公司);RE5220型旋转蒸发仪(上海荣亚生化仪器厂);RE-3000型旋转蒸发仪(上海荣亚生化仪器厂);SHZ-CB型循环水式多用真空泵(巩义市予华一起有限责任公司);DL-5M型低速冷冻离心机(长沙湘仪离心机仪器有限公司);DZG-6050型真空干燥箱(上海森信实验仪器有限公司);AB104-N型电子分析天平(梅特勒-托利多仪器有限公司);W201S型恒温水浴锅(上海申生科技有限公司);722s型可见分光光度计(上海仪电分析仪器有限公司)。
1.3 实验内容和方法
1.3.1 红芪多糖的提取
将清洗、干燥后的红芪原料(水分含量≤13%)粉碎至45目,称量后加入一定量的蒸馏水,用柠檬酸调节至一定pH值后,按酶量/红芪粉末质量百分比加入一定量的纤维素酶,投入超声波提取装置,在一定温度、一定功率条件下间歇超声(超声时间:间歇时间为1:1)搅拌(80r/min)提取3次,每次30 min。合并提取液,90℃灭酶活,以4000 r/min离心15min,取上层清液,70℃浓缩。浓缩液加入等体积三氯乙酸-正丁醇(V:V=1:10)振荡静置分层,收下层水溶液,再以4000r/min离心15min,取上层清液加入无水乙醇至30%,静置6h后以4000 r/min离心15min,取沉淀70℃真空干燥得到红芪多糖。
1.3.2 红芪多糖含量的测定
总多糖含量 (%):苯酚-硫酸法[13]

1.3.3 单因素试验设计
以红芪多糖提取率为衡量指标,对提取温度、超声功率、料液比、溶液pH值、酶用量5个单因素进行考察。
1.3.4 响应曲面试验设计
在单因素的基础上,采用的中心组合实验设计原理[14],以提取温度(X1)、超声功率(X2)、料液比(X3)、溶液pH值(X4)、酶用量(X5)为自变量,展开五因素三水平的响应曲面试验,建立最小二乘法拟合二次多项式数学模型,利用此模型确定超声波协同酶法提取红芪多糖工艺中的最佳提取条件及最大提取率。
1.3.5 数据分析
单因素试验设计采用ANOVA进行方差分析,利用Duncan法进行多重比较;响应曲面试验设计采用F检验(tape III)对数据进行方差分析,数据分析分别采用Spss19.0和Design Expert7.0软件。
2、结果与分析
2.1 单因素试验
2.2.1 提取温度的影响
在料液比1:10,溶液pH值5.0,用酶量为0.6 %,超声功率120 W条件下,分别探讨30℃、40℃、50℃、60℃、70℃的提取温度对红芪多糖提取率的影响。提取率与提取温度的关系见图1(a)。
由图1(a)可知,随着提取温度的升高,红芪多糖的提取率随之显著增加(P<0.05),当提取温度达到50℃时,提取率达到峰值,这是因为温度的升高不仅会使萃取剂的传质系数增加, 度下降,从而引起多糖分子溶出的增加[15];而且,酶活也逐渐达到最适温度,促进了酶对红芪细胞壁的分解,使得多糖的提取率增加[13]。当温度超过50℃,红芪多糖的提取率随之显著降低(P<0.05),这可能是因为温度的升高使得酶活性的降低或酶部分失活,从而影响了红芪的水解效果。
2.2.2 超声功率的影响
在料液比1:10,溶液pH值5.0,用酶量为0.6%,提取温度50℃条件下,分别探讨80W、100W、120W、140W、160W的超声功率对红芪多糖提取率的影响。提取率与超声功率的关系见图1(b)。
由图1(b)可知,红芪多糖提取率随超声功率的升高而显著增大(P<0.05),当超声功率超过120W,红芪多糖提取率趋于平缓。这说明适当的升高超声功率可以增强超声波所产生的空穴力,提高多糖分子的运动使其溶出,并且可能会一定程度的增强酶的活力,从而促进提取过程中对红芪细胞壁的破坏作用。
2.2.3 溶液pH值的影响
在料液比1:10,用酶量为0.6%,提取温度50℃,超声功率120W条件下,分别探讨2.0、3.0、4.0、5.0、6.0的溶液pH值对红芪多糖提取率的影响。提取率与溶液pH值的关系见图1(c)。
由图1(c)可知,红芪多糖提取率随着溶液pH值的升高而显著增大(P<0.05),并在pH值为5.0时提取率达到峰值,说明适宜的pH值会提高酶和底物的相互结合,并发生催化作用,从而使酶解效果达到最佳。当溶液pH值大于5.0时,红芪多糖提取率随着pH的增大而显著降低(P<0.05),这可能由于已过最适宜pH值所导致的酶活性降低,从而引起提取率的下降。
2.2.4 料液比的影响
在溶液pH值5.0,用酶量为0.6%,提取温度50℃,超声功率120W条件下,分别探讨1:6、1:8、1:10、1:12、1:14的料液比对红芪多糖提取率的影响。提取率与料液比的关系见图1(d)。
由图1(d)可知,随着溶液体积的增加,红芪多糖的提取率随之显著增加(P<0.05),但料液比达到1:10之后多糖提取率趋于平缓。这主要是因为增加提取液的用量能够使多糖分子充分的溶出,但多糖分子基本溶出后再增加提取液的用量也无法使多糖的提取率有显著的提升。
2.2.5 用酶量的影响
在料液比1:10,溶液pH值5.0,提取温度50℃,超声功率120 W条件下,分别探讨0.2%、0.3%、0.4%、0.5%、0.6%的用酶量对红芪多糖提取率的影响。提取率与用酶量的关系见图1(e)。
由图1(e)可知,随着用酶量的增加,红芪多糖提取率呈增加的趋势,在用酶量为0.3%时达到最大,之后随着酶添加量的继续增加,提取率开始逐渐减少。这主要是因为:(1)加酶量越大,内容物释放量越大,底物减少,使得一部分酶没有足够的底物结合,从而使多糖提取率下降。(2)酶浓度的增加,多糖中某些糖苷键会被过量的酶所分解,多糖提取率会随之下降。

图1 不同因素对红芪多糖提取率的影响Fig.1 The influence of different factors on extraction yield of Radix Hedysari
2.2 响应曲面试验
2.2.1 模型方程的设计及结果
在单因素的试验基础上,采用Box—Behnken设计法,对超声波协同纤维素酶法提取红芪多糖工艺进行3因素优化试验设计。响应面因素与水平见表1,试验设计及结果见表2。

表1 Box-Behnken试验因素及水平
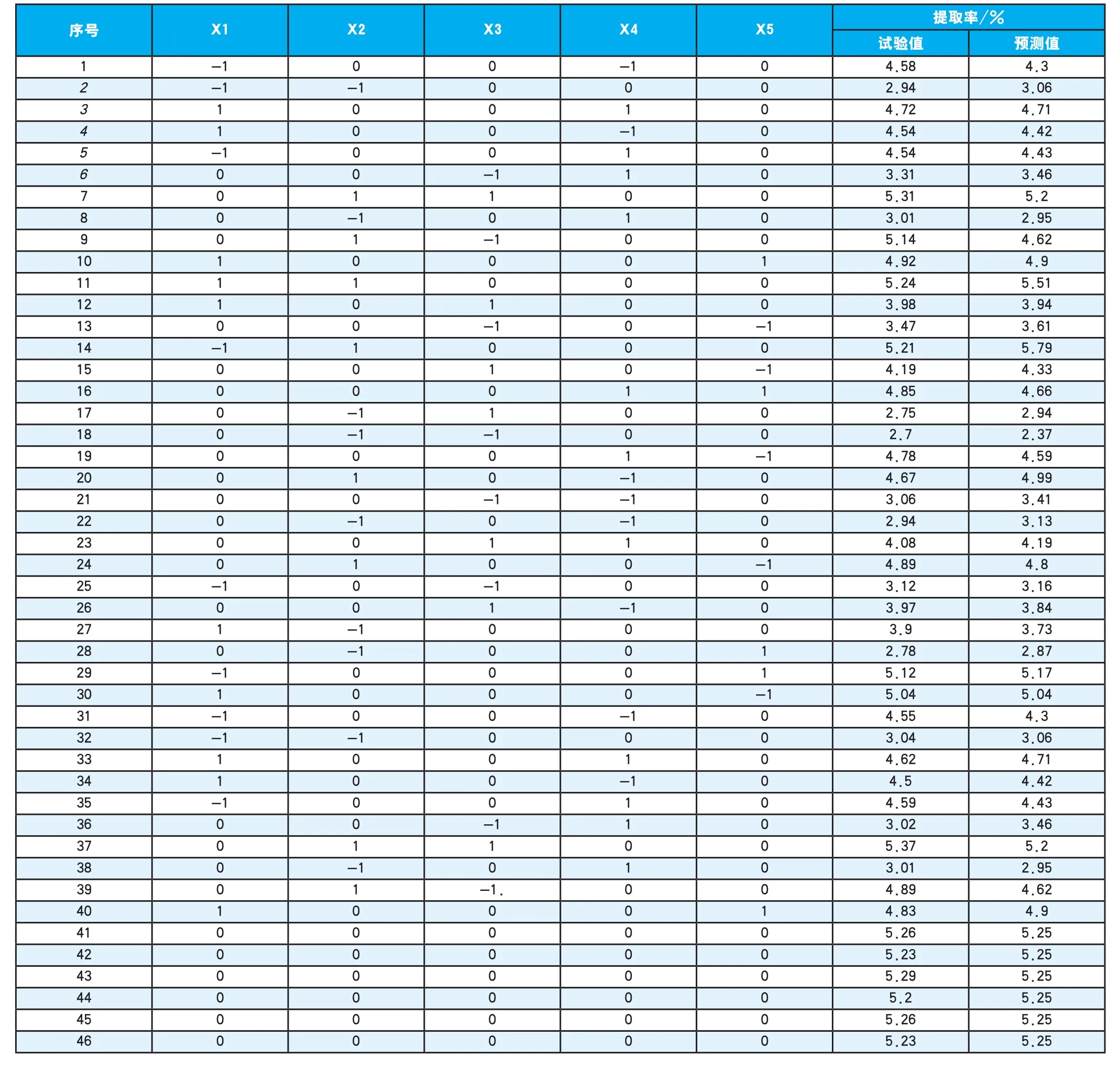
表2 Box—Behnken试验设计及试验结果
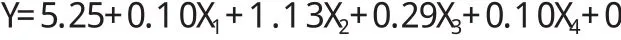

表3 回归分析结果
由表3可知,该实验所选模型(P<0.001)差异极其显著,且失拟项(P>0.05)差异不显著;模型拟合度R2=0.9490,校正决定系数Radj2=0.9081,说明该模型与实际试验拟合良好,可解释90.81%的响应值变化。拟合方程一次项X2、X3对红芪多糖的提取率影响极其显著(P<0.01);拟合方程二次项X22、X32、X42对红芪多糖的提取率影响极其显著(P<0.01);拟合方程X2X5对红芪多糖的提取率影响极其显著(P<0.01),X1X3对其提取率影响显著(P<0.05)。综上,五因素对红芪多糖提取率影响程度由大到小依次为:超声功率>溶液pH值>料液比>提取温度>用酶量,且超声功率与用酶量、提取温度与溶液pH值存在协同影响红芪多糖提取率的作用。
2.2.2 工艺提取条件的优化
根据Box-Bwhnken试验所得结果,结合回归模型,预测红芪多糖提取率的最佳工艺条件为:在提取温度为60.00℃,超声功率为120.00W,溶液pH值为4.82,料液比为1:10.33,用酶量为0.4%时,提取率为6.06%。为简化试验操作,将其最佳提取条件修正为:提取温度为60.00℃,超声功率为120.00W,溶液pH值为5.0,料液比为1:10,用酶量为0.4%
2.2.3 优化工艺的验证试验
按修正后最佳提取条件进行验证试验,测得红芪多糖提取率为5.98%,RSD=1.01(见表4)。实际测得红芪多糖提取率与预测值6.06%之间无显著差异(P=0.386)。


表4 最佳提取条件验证试验结果
3 、结论
本研究以甘肃道地药材红芪为研究对象,以超声波协同酶解技术为提取方法,在单因素试验的基础上,利用Design Expert软件,运用Box-Behnken试验设计,采用响应曲面分析法,建立了红芪多糖提取率与各因素间的拟合模型,对工艺条件进行了优化,获得了最佳工艺条件:在提取温度为60.00℃,超声功率为120.00W,溶液pH值为5.0,料液比为1:10,用酶量为0.4%下,红芪多糖提取率为5.98%,为超声波协同酶解技术的工业化应用提供理论指导及依据。
[1]欧阳亦华, 颜剑. 红芪多糖含量测定方法研究[J]. 中国中医药现代远程教育, 2002, 19(3): 296-301.
[2]国家药典委员会. 中华人民共和国药典(一部)[S]. 2010年版. 北京: 中国医药科技出版社, 2010: 142.
[3]中国科学院中国植物志编辑委员会.中国植物志[M]. 北京: 科学出版社, 1998, 42(2): 186.
[4]罗文蓉, 杨扶德, 张雅聪. 红芪的生药学研究[J]. 时珍国医国药, 2004,15(3): 157.
[5]谭玉玲. 中药红芪药材鉴定及多糖提取工艺研究[D]. 兰州: 兰州理工大学, 2010.
[6]TIAN H Y. Chemical composition of Radix Hedysari research[J]. Northwest University for Nationalities (Natural Science), 1996, 17( 1) : 89-91.
[7]毛小娟, 王军志, 王凤连. 红芪多糖和黄芪多糖的免疫调节作用[J]. 中国药理学通报, 1989, 5(6): 367-372.
[8]金智生, 张东鹏. 红芪多糖对2型糖尿病胰岛素抵抗大鼠IL-6的影响[J]. 甘肃中医学院学报, 2006, 23(5): 6-8.
[9]李世刚, 张永琦, 赵健雄. 红芪多糖体外抗肿瘤活性及构效关系研究[J]. 中药药理与临床, 2007, 23(6): 35-37.
[10]姚宝泰, 赵健雄, 王学习. 红芪总多糖体内抗肿瘤的实验研究[J]. 2008, 23(7): 627-629.
[11]胡燕, 程卫东, 刘欣, 等. 红芪多糖超声波提取工艺的正交实验优选研究[J]. 时珍国医国药, 2011, 22(8): 1953-1954.
[12]龚苏晓, 高展, 张铁军, 等. 微波辅助提取黄芪多糖及含量测定[J]. 时珍国医国药, 2008, 19(4): 784-786.
[13]刁文超, 王然, 王凤舞, 等. 超声波协同复合酶法提取南瓜多糖工艺优化[J]. 食品科学, 2012, 33(18): 14-20.
[14]Box G. P, Behnken D W. Some new three level design for the study of quantitative variables[J]. Technometrics, 1960(2): 456-475.
[15]李冰. 亚临界萃取文冠果籽油工艺的响应面优化[J]. 中国油脂, 2015, 40(2): 19-23.

