4-苯基丁酸改善休克后器官缺血缺氧损伤
彭小勇,李 涛,刘良明,朱 娱,蓝 丹,吴 跃,杨光明
缺血缺氧是多种疾病均存在的一种病理状态,是引起重要组织器官损伤最常见的因素。创伤失血性休克是导致机体有效循环血量不足、组织器官缺血缺氧的主要原因。防止休克后缺血缺氧所致器官损伤的关键是恢复有效血流灌注、改善组织氧供[1]。因此,寻找有效的改善组织缺血缺氧状态和器官功能的抗休克措施具有重要意义。4-苯基丁酸(4-phenyl butyric acid,PBA)是一种具有多种功能的新药,在临床上主要用于治疗儿童肾脏疾病和镰状细胞贫血等疾病[2-3],近来它在缺血缺氧和再灌注损伤中的作用成为临床医生和研究者关注的焦点[3-4]。我们近期研究发现,PBA对创伤性休克大鼠有明显的治疗作用,能显著改善休克动物的存活情况,那么它是否通过改善重要器官的血流灌注和线粒体功能对器官功能发挥作用?本实验对此进行了研究。
材料与方法
1 实验动物
SD大鼠128只(由第三军医大学第三附属医院实验动物中心提供),雌雄各半,体重180~220g。
2 实验方法
2.1 实验分组及模型制备 SD大鼠随机分为4组:乳酸林格氏液(LR)组、PBA 5mg/kg组、PBA 20mg/kg组、PBA 50mg/kg组,每组分别在休克前、休克末、复苏后1h和2h检测各项指标,每组每个时相点8只大鼠。本实验常规方法制备创伤失血性休克模型[5]:用3%戊巴比妥钠麻醉大鼠,右侧股动脉插管供观察血压和放血,股静脉插管用于给药复苏,折断大鼠左侧股骨,同时通过股动脉插管放血至血压40mmHg,维持3h。休克模型成功后按实验分组进行复苏,LR组输注2倍失血量的LR,PBA组按照分组剂量将PBA加入LR中输注,休克对照组不予复苏。
2.2 肝、肾血流量及肝、肾功能检测 在各时相点,行剖腹手术,充分暴露大鼠的肝脏和肾脏,用激光多普勒血流仪(PF5001,Perimed,瑞典)的探针刺入肝、肾组织下0.5cm左右,测定肝、肾并记录血流量。然后抽取2ml动脉血用生化分析仪(BXC800,Beckman,美国)检测肝、肾功能指标,包括天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、血尿素氮(BUN)和血肌酐(CREA)。
2.3 肝、肾、肠线粒体功能测定 取大鼠肝、肾和小肠组织,在冰上提取线粒体,用溶氧仪(MT200,Strathkelvin,苏格兰)测定线粒体功能。在30℃恒温条件下校准仪器,将提取的线粒体悬液加入反应介质中,观察在有二磷酸腺苷(ADP)刺激下的耗氧量(3态呼吸)和无ADP刺激下的耗氧量(4态呼吸),线粒体功能以其比值(呼吸控制率,RCR)来反映[6]。
3 统计学分析
结 果
1 PBA对创伤失血性休克大鼠肝、肾血流量的影响
休克后大鼠的肝、肾血流量均显著下降(P<0.01)。LR输注使肝、肾血流量有轻度升高。20mg/kg的PBA输注可明显恢复肝血流量,显著高于LR组(P<0.01),而PBA 5和50mg/kg组与LR组无明显差异;各剂量PBA都可明显升高肾脏血流量,均高于LR组(P<0.01),其中PBA 20mg/kg的恢复作用最为显著(图1)。
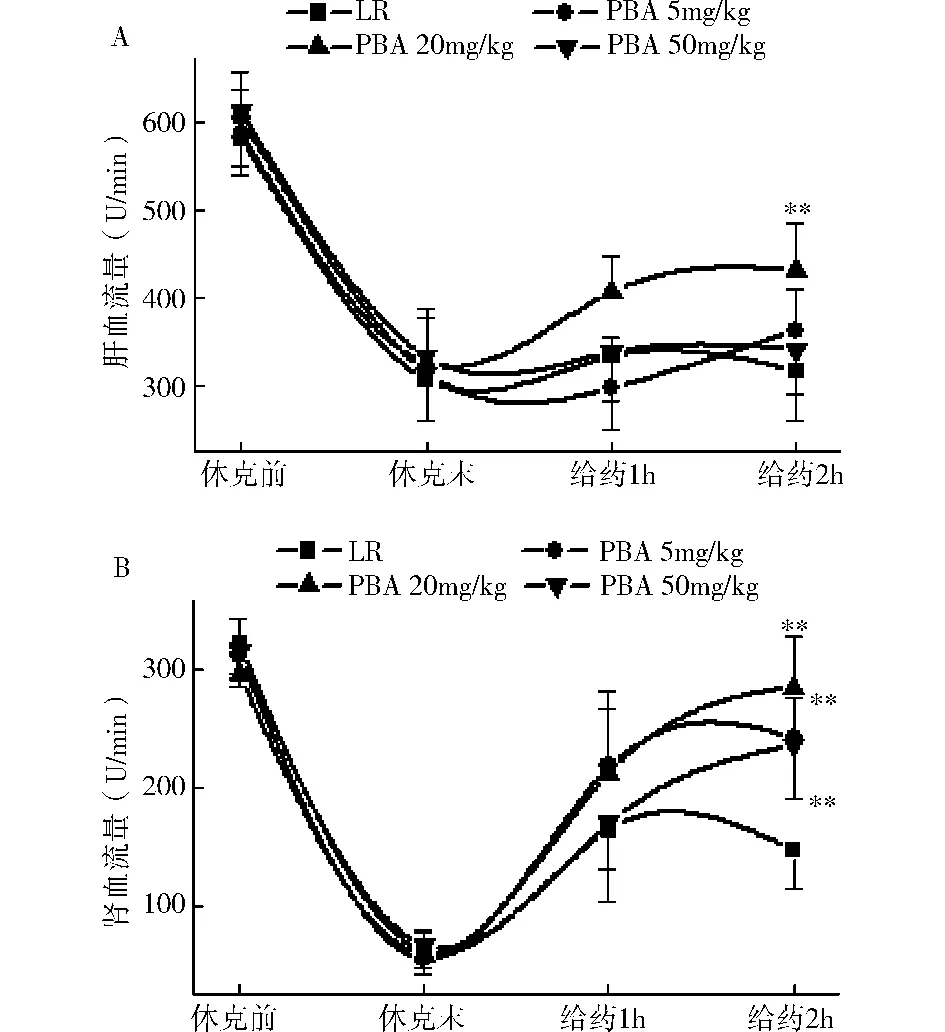
图1 PBA对创伤失血性休克大鼠肝(A)、肾(B)血流量的影响
2 PBA对创伤失血性休克大鼠肝、肾功能的影响
休克明显引起了肝、肾功能的损伤,反映肝、肾功能的各项指标,包括AST、ALT、BUN和CREA在休克后均显著高于正常水平(P<0.01)。PBA 20mg/kg输注可降低休克大鼠血浆中ALT和CREA的水平,明显低于LR组(P<0.05~0.01)。但LR和PBA输注对休克后升高的AST和BUN无明显影响(表1)。
3 PBA对创伤失血性休克大鼠肝、肾和小肠线粒体功能的影响
休克后大鼠的肝、肾、肠线粒体功能均显著下降。LR复苏对各器官线粒体功能的改善作用不明显。PBA 5和20mg/kg可明显恢复肝线粒体功能,3个剂量的PBA都能明显升高肾和肠的线粒体功能,其作用显著高于 LR组(P<0.01)。其中 PBA 20mg/kg的效果最为明显,PBA 20mg/kg组大鼠肝、肾、肠线粒体呼吸功能分别恢复至正常水平的88.7%、98.7%和101.0%(表2)。
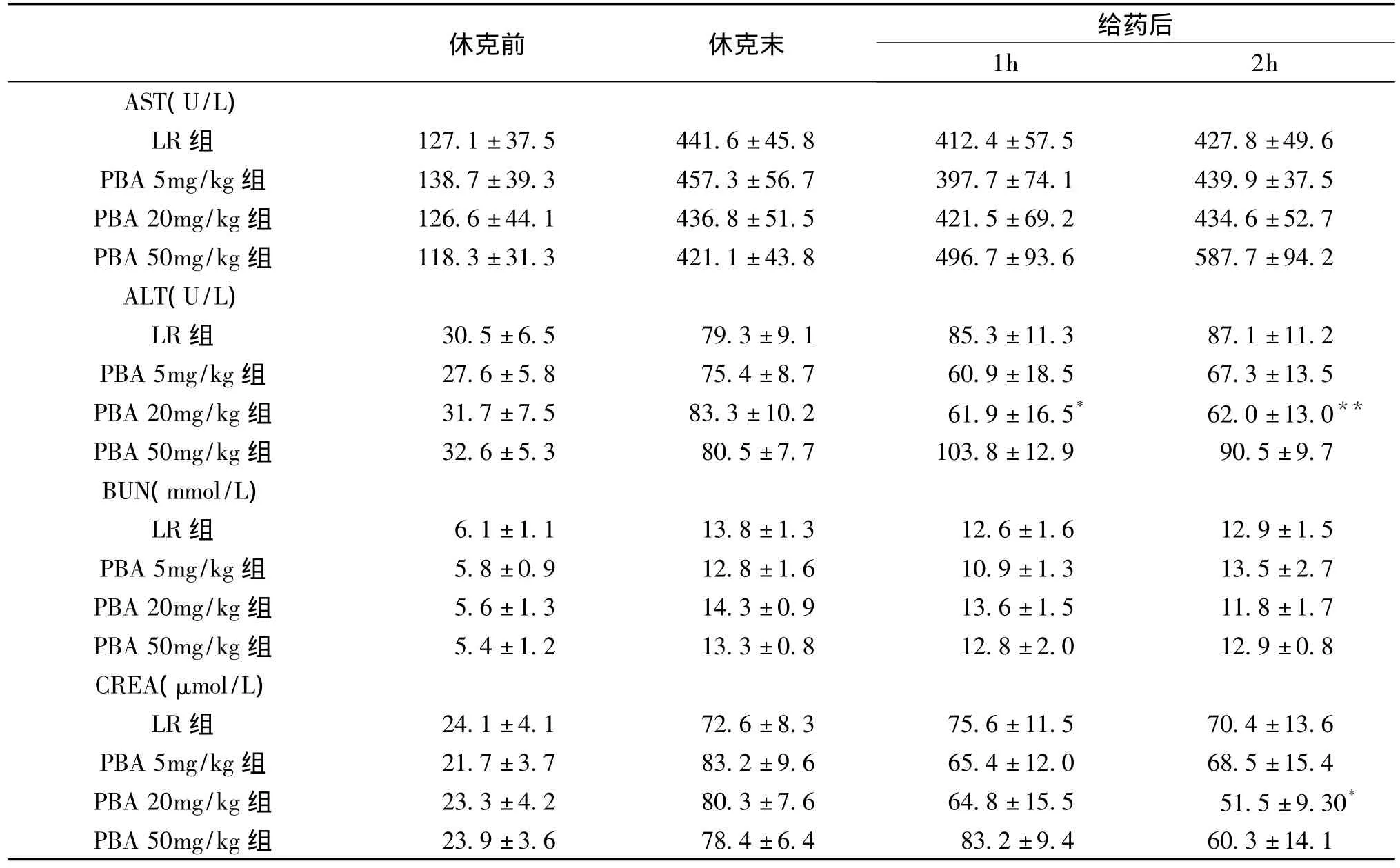
表1 PBA对创伤失血性休克大鼠肝、肾功能的影响
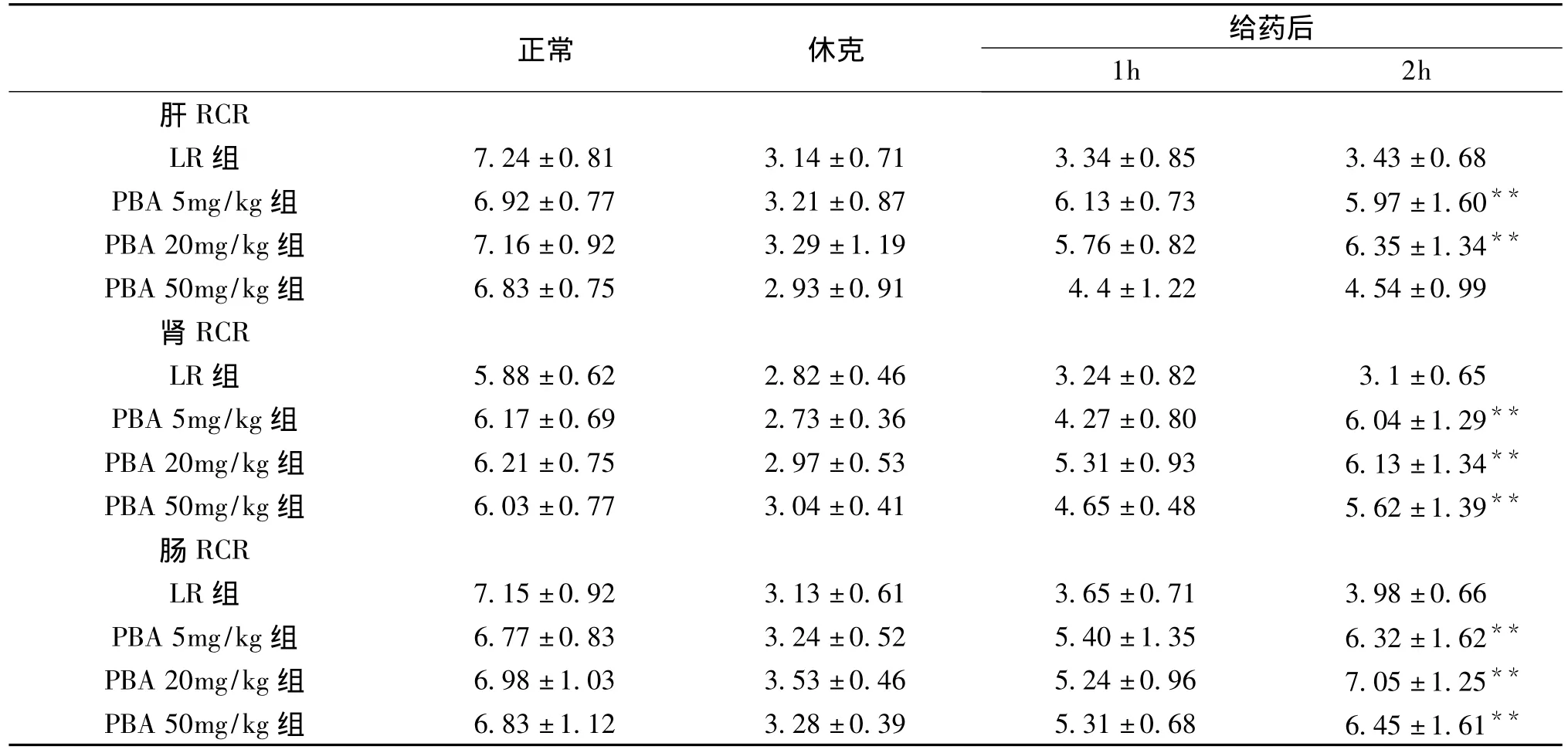
表2 PBA对创伤失血性休克大鼠肝、肾、肠线粒体功能的影响
讨 论
PBA是一种具有多种功能的新型药物,除了临床上用于治疗尿素循环障碍和贫血等疾病外,研究显示PBA在多种疾病过程中能发挥改善器官功能的作用,包括阿尔茨海默病、帕金森病、糖尿病、动脉粥样硬化、高血压及多种缺血缺氧性疾病[2-4,7]。本实验室前期研究发现,PBA对创伤失血性休克有很好的治疗作用,但它是通过什么途径发挥抗休克作用?本实验对此进行了研究。结果显示,休克引起了重要生命器官如肝和肾的血流量降低,同时反映肝、肾功能的四项重要指标均显著升高;PBA(20mg/kg)输注可恢复休克后降低的肝、肾血流量,并降低肝、肾功能的指标ALT和CREA,提示PBA对肝、肾等重要器官的血流灌注和功能都有较好的改善作用。线粒体是为细胞提供能量的重要细胞器,因此成为休克后缺血缺氧损伤的直接靶点,而线粒体功能紊乱直接影响细胞的功能和生存,最终导致组织器官损伤。本实验结果表明,休克后大鼠肝、肾、肠的线粒体功能都显著下降,PBA可明显改善各器官的线粒体功能,其中20mg/kg的PBA的作用最为显著,使治疗后大鼠的线粒体功能接近正常水平。此外,本实验结果显示,PBA 50 mg/kg对血流量和线粒体功能等指标的改善作用低于PBA 20mg/kg,并且 PBA 50mg/kg输注后肝功能指标ALT和AST并未降低、反而接近或高于休克组水平,提示高剂量的PBA可能增加发生不良反应的危险。当然,本实验仅初步观察到此现象,其可能原因需要更多的实验来研究。
目前研究显示,PBA主要通过2条途径来发挥其生物学效应。一是作为化学分子伴侣,具有稳定蛋白质结构和改善内质网功能的作用;二是具有组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitors,HDACi)的功能[3]。内质网是细胞内维持钙离子稳态、参与蛋白质合成、加工和运输的重要细胞器,在细胞代谢、功能发挥和细胞生存中具有重要作用。在多种病理状态下,刺激因素可引起内质网稳态失衡,诱发内质网应激(endoplasmic reticulum stress,ERS)。大量文献已证实,内质网应激是多种疾病发生、发展的共同的关键因素,PBA作为分子伴侣可抑制内质网应激,减轻ERS引起的器官损伤[8]。内质网和线粒体之间存在复杂的结构和功能上的联系,如内质网应激可诱导活性氧产生和释放钙入胞浆中,引起线粒体的膜电位降低和线粒体功能障碍,进一步增加了活性氧的产生,而活性氧可促进内质网释放钙,使线粒体内钙积聚,形成恶性循环,加重细胞损伤。此外,PBA作为HDACi可参与染色质组蛋白乙酰化的调节、发挥对基因表达和细胞凋亡的调控作用,故以往主要关注它的抗肿瘤作用,但近来研究发现HDACi对多种非肿瘤疾病也有治疗作用,如PBA通过其HDAC抑制功能发挥在亨丁顿病和脊髓性肌肉萎缩症中的神经细胞保护作用[3,9]。
综上所述,输注PBA能够明显增加肝、肾等重要器官的血流量、促进线粒体功能恢复、改善重要器官功能,对休克后缺血缺氧损伤有明显的治疗作用。但缺血缺氧损伤可激活多条级联反应,PBA是如何发挥改善器官和线粒体功能的作用,其具体机制还需进一步研究。
[1]刘良明.战创伤休克早期救治研究进展[J].创伤外科杂志,2013,15(2):100 -103.
[2]Lee B,Rhead W,Diaz GA,et al.Phase 2 comparison of a novel ammonia scavenging agent with sodium phenylbutyrate in patients with urea cycle disorders:safety,pharmacokinetics and ammonia control[J].Mol Genet Metab,2010,100(3):221 -228.
[3]Mimori S,Ohtaka H,Koshikawa Y,et al.4 - Phenylbutyric acid protects against neuronal cell death by primarily acting as a chemical chaperone rather than histone deacetylase inhibitor[J].Bioorg Med Chem Lett,2013,23(21):6015 -6018.
[4]Fessler EB,Chibane FL,Wang Z,et al.Potential roles of HDAC inhibitors in mitigating ischemia-induced brain damage and facilitating endogenous regeneration and recovery[J].Curr Pharm Des,2013,19(28):5105 -5120.
[5]杨光明,李涛,徐竞,等.V1a/V2受体在精氨酸血管加压素恢复失血诱导大鼠血管低反应性中的作用[J].创伤外科杂志,2008,10(1):47 -50.
[6]Li T,Lin X,Zhu Y,et al.Short- term,mild hypothermia can increase the beneficial effect of permissive hypotension on uncontrolled hemorrhagic shock in rats[J].Anesthesiology,2012,116(6):1288 -1298.
[7]Cuadrado - Tejedor M,Ricobaraza AL,Torrijo R,et al.Phenylbutyrate is a multifaceted drug that exerts neuroprotective effects and reverses the Alzheimer's disease - like phenotype of a commonly used mouse model[J].Curr Pharm Des,2013,19(28):5076 -5084.
[8]Mandl J,Mészáros T,Bánhegyi G,et al.Minireview:endoplasmic reticulum stress:control in protein,lipid,and signal homeostasis[J].Mol Endocrinol,2013,27(3):384 -393.
[9]Wiech NL,Fisher JF,Helquist P,et al.Inhibition of histone deacetylases:a pharmacological approach to the treatment of non - cancer disorders[J].Curr Top Med Chem,2009,9(3):257-271.
——疾病防治的新靶标

