印度-西太平洋胡椒鲷亚科鱼类DNA条形码及分子系统进化研究
梁日深 谭佳瑜 梁志刚 薛 涛 方浩航 吴灶和
(仲恺农业工程学院, 生命科学学院, 广州 510225)
印度-西太平洋胡椒鲷亚科鱼类DNA条形码及分子系统进化研究
梁日深 谭佳瑜 梁志刚 薛 涛 方浩航 吴灶和
(仲恺农业工程学院, 生命科学学院, 广州 510225)
为探讨COⅠ基因作为条形码在胡椒鲷亚科鱼类物种鉴定的可行性, 研究测定了胡椒鲷亚科8种鱼类51个个体线粒体COⅠ基因长度为651 bp的序列, 利用MEGA 5.0计算胡椒鲷亚科种内与种间的遗传距离,基于最大似然法与贝叶斯法构建了系统进化树。结果显示: 胡椒鲷亚科鱼类种间平均遗传距离(0.142)显著大于种内平均遗传距离(0.003), 物种间遗传距离均大于Hebert推荐的物种鉴定最小种间遗传距离0.020(2%)。系统进化树上, 同一物种不同个体间均能形成独立的单系分支, 表明 COⅠ基因可作为胡椒鲷亚科物种鉴定的有效条形码基因。研究同时揭示, 在形态分类上被认为是同种异名的两种胡椒鲷(条纹胡椒鲷与东方胡椒鲷)的COⅠ基因序列差异达到0.070, 有可能是两个独立的物种。此外, 在属级水平, 少棘胡椒鲷属与胡椒鲷属种类之间的平均遗传距离小于胡椒鲷属内部种间的遗传距离, 支持少棘胡椒鲷归属于胡椒鲷属的观点。
DNA条形码; COⅠ基因; 胡椒鲷亚科; 系统分类
胡椒鲷亚科(Plectorhynchinae)隶属鲈形目Perciformes鲈亚目 Percoidei仿石鲈科Haemulidae,包括胡椒鲷属(Plectorhinchus), 少棘胡椒鲷属(Diagramma)以及矶鲈属(Parapristipoma), 广泛分布于印度洋及太平洋西部温带, 亚热带及热带沿海及岛礁海域, 是重要的海洋经济食用及观赏性鱼类。世界上胡椒鲷亚科种类共记录30余种, 中国约8—12种, 主要分布在南海[1—4]。
胡椒鲷亚科鱼类是一类外部形态会随着个体发育逐渐变化的特殊类群, 幼鱼与成鱼在体色和斑纹上存在巨大差别。基于传统形态学分类方法, 许多物种难以准确鉴定, 导致目前形态学分类资料中物种命名十分混乱[1—6]。而在分子水平鉴定上, 关于胡椒鲷亚科鱼类的分子系统分类研究还没见报道, 仅在部分石鲈科鱼类系统进化分析研究涉及零星的胡椒鲷亚科鱼类, 如朱世华等[7]利用Cyt b基因分析5种仿石鲈科鱼类; 任岗等[8]利用16S rRNA序列分析了 11种仿石鲈科鱼类以及国外 Sanciangco等[9]与 Tavera等[10]利用多个分子标记分析北美海域的 30多种仿石鲈科鱼类的分子系统进化等, 其研究涉及的胡椒鲷亚科数目很少, 且重点分析内容均放在其他类群, 对于胡椒鲷亚科物种分类的数据分析十分缺乏, 关于胡椒鲷亚科鱼类的系统性的分类与鉴定研究依然存在巨大空白。
近年来, DNA条形码(DNA Barcoding)技术在分子系统进化, 物种快速鉴定上引起越来越多的关注。DNA条形码是通过一个标准目的基因的DNA序列分析从而进行物种鉴定的技术[11,12]。在鱼类中该基因是线粒体细胞色素C氧化酶亚基Ⅰ(COⅠ)基因5′端一段长度为648 bp的片段, 它能在分子水平上成功区分物种, 为生物的分类提供一种快速简便、可信可靠的分类方法[32]。目前, 世界各地已经开展了不同地理海区鱼类的DNA条形码研究分析, 在物种保护与鉴定研究工作中取得了不小的突破[13—15]。
本研究选择DNA条形码标准基因——COⅠ作为标记, 分析胡椒鲷亚科鱼类分子系统进化关系,探讨 COⅠ基因在胡椒鲷亚科鱼类物种分子鉴定的有效性, 为解决胡椒鲷亚科形态分类混乱与物种鉴定困难的问题提供分子水平的分类学依据, 为今后的相关模糊物种的分类鉴定提供快速便捷鉴定依据。
1 材料与方法
1.1 材料来源
胡椒鲷亚科标本材料主要在南海采集。此外,部分世界其他海区分布的样品主要由以下单位提供:南非水生物多样性研究院(South African Institute for Aquatic Biodiversity, SAIAB)、美国堪萨斯大学生物
多样性研究中心(Biodiversity Institute, University of Kansas)、南太平洋岛国新喀里多尼亚努美阿泻湖水族馆(Noumea Aquarium des Lagons)。最后共得到胡椒鲷亚科样品材料18种(表1)。实验材料均取肌肉或尾鳍, 于 95%的乙醇固定, 用于实验室基因组DNA提取。
1.2 总基因组DNA的提取
基因组DNA提取采用改良的酚/氯仿抽提法。提取的DNA溶解于50 μL灭菌水中, 经1%琼脂糖凝胶电泳检测, –20℃保存备用。
1.3 PCR扩增及序列测定
用于扩增 COⅠ基因片段序列的引物为 DNA条形码通用引物: COⅠ-F1: 5′-TCAACYAATCAYAA AGATATYGGCAC-3′, COⅠ-R1: 5′-ACTTCYGGGTGRCCRAARAATCA-3′[16]。PCR反应体系为50 μL,其中10×buffer 5 μL, dNTPs (各2.5 mmol/L) 2 μL, 上下游引物各1 μL, Ex Taq酶(1 U/μL) 2 μL。PCR反应条件为: 94℃预变性5min, 94℃变性30s, 60℃退火1min, 72℃延伸1min30s, 35个循环, 最后72℃延伸10min。PCR产物经1.5%琼脂糖凝胶电泳分离,纯化后送到上海英骏生物技术有限公司进行双向测序。
表1 实验材料的种类和采集地Tab. 1 The experimental species and the origins
1.4 数据分析
所得序列运用 BioEdit 软件查看序列结果并辅助测序峰图进行人工校正。利用Clustal W[17]进行序列排列比对, 去除两端冗余序列。利用 MEGA 5.0[18]计算序列的碱基组成、序列间的碱基变异频率和转换颠换频率, 基于Kimura’s 2-parameter模型计算各物种的遗传距离。分子系统进化树利用最大似然法(Maximum likelihood, ML)和贝叶斯法(Bayesian inference, BI)进行构建。最大似然树在PHYML v2.4.4软件中完成, 分支的置信度采用重复抽样分析(Bootstrap analysis)方法, 重复抽样的次数为1000次。贝叶斯法分析在 MrBayes 3.1.2[20, 21]软件中完成, 随即选取起始树, 计算1000000代, 取样代数100, 系统进化树节点置信度由后验概率(Posterior probabilities)提供。
2 结果
2.1 序列分析
本研究中, 所获得序列是 COⅠ基因 5′端的一段长度为651 bp的片段, 编码272个氨基酸, 无碱基的插入、缺失。序列碱基组成中A、T、G、C 碱基平均含量分别为 23.1%、27.5%、19.5%、29.9%, 其中 A+T 含量(50.6%)略高于G+C 含量(49.4%)。密码子第1位4种碱基含量相差不大, 其中G-1含量最高, 占31.3%, 密码子第2位中, T-2含量明显高于其他3种, 占41.0%, 密码子第3位中C-3含量最高,为33.2%, 而G-3含量仅有14.3%, 表现出明显的反G偏倚(图1)。在G+C含量中, 密码子第1位点G+C含量(56.7%)显著高于第2和第3密码子位点(43.1% 和 48.4%)。此外, 在长度为 651 bp序列中, 除去外类群, 保守位点 430个, 约占 66.1%; 变异位点221个, 约占34.0%; 简约性信息位点183个, 约占28.1%。
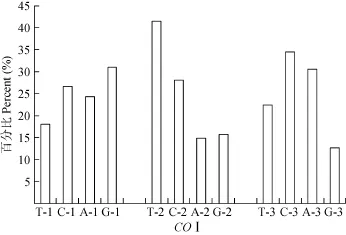
图1 COⅠ基因第一、二、三位密码子碱基组成Fig. 1 The composition of the 1st, 2nd, 3rd codon of COⅠgene
所有个体序列核苷酸变异情况见表 2。序列中转换与颠换之比值为3.24 (Kimura 2-parameter模型),转换明显大于颠换, 显示这些位点没有突变饱和。全部位点中不变位点有 567个, 转换位点有 64个,颠换位点有20个。其中不变位点属第2密码子位点最多, 为 217个; 而转换位点和颠换位点均属第 3密码子位点最多, 分别为58个和19个(表2)。这可能与密码子第 3位发生的碱基替换不易造成氨基酸突变, 第1、第2位点的替换容易引起氨基酸突变有关。
2.2 种间及种内的遗传距离
基于Kimura 2-parameter模型计算出18种胡椒鲷亚科种内与种间遗传距离如表 3所示, 在所有胡椒鲷亚科鱼类中, 种内遗传距离为 0.000—0.010,其中斑胡椒鲷种内遗传距离最大, 为0.010, 其余种类种内遗传距离均低于 0.005, 平均遗传距离为0.003, 显著低于Hebert等[11]所推荐的物种鉴定最小种间遗传距离0.020 (2%)。18种胡椒鲷亚科鱼类种间平均遗传距离为0.142, 是种内遗传距离的47倍,其中最大种间遗传距离为查氏胡椒鲷与黑胡椒鲷(0.193); 最小种间遗传距离为查氏胡椒鲷与红唇胡椒鲷(0.036), 均大于 Hebert等[11]设定的 2%的遗传差异。此外, 归类于少棘胡椒鲷属的两种少棘胡椒鲷与胡椒鲷属的种类遗传距离范围在 0.084—0.194之间, 平均遗传距离为0.134, 少于胡椒鲷属内种间的平均遗传距离0.141。

表2 COⅠ片段碱基转换和颠换数Tab. 2 Numbers of transition and transversion of COⅠ sequences
2.3 胡椒鲷亚科科鱼类分类及分子系统树
基于所得序列, 采用ML法和BI法, 对胡椒鲷亚科3个属18种鱼类51个个体构建分子系统树(图2), 两者得到的系统树具有相似的拓扑结构, 并且都具有较高的节点支持率。在进化树上, 胡椒鲷亚科同种鱼类不同个体均聚为同一分支, 各自形成单系, 节点支持率为100%。18种鱼类大致形成4个类群, 其中矶鲈属位于石鲈亚科类群基部, 种类数量最多的胡椒鲷属在进化树上并没有形成严格的单系,少棘胡椒鲷属以较高节点支持率位于胡椒鲷属内部,与胡椒鲷属中的斑胡椒鲷与暗点胡椒鲷有较近的亲缘关系。

表3 基于 Kimura-2模型计算17种胡椒鲷亚科鱼类COⅠ种内遗传距离(最后一列)及种间平均遗传距离(下三角) Tab. 3 Pairwise distances among 22 species of for COⅠ sequences based on Kimura-2-Parameter model

图2 18种胡椒鲷鱼类基于COⅠ序列利用最大似然法与贝叶斯法构建的分子系统进化树Fig. 2 The molecular phylogenetic trees of 18 Sweetlips constructed by maximum likelihood and Bayesian inference method, based on CO Ⅰsequences
3 讨论
3.1 DNA条形码在胡椒鲷亚科鱼类物种鉴定中的适用性
研究表明, 较大的种间序列差异是对物种进行准确鉴定的先决条件[22]。利用 DNA条形码对物种进行正确分类取决于种内遗传距离和种间遗传距离之间的差异大小, 即条形码缺口(Barcoding gap)。Hebert等[11]对11个门13320个物种的COⅠ基因序列进行分析, 发现 COⅠ序列间的差异能够很好地区分所有研究物种, 其分析得出物种内的 COⅠ遗传距离很少有大于 2%, 大部分的种内距离是小于1%。同时, Hebert等[11, 12]提出, 利用COⅠ序列有效地进行物种鉴别的关键点是种间的遗传距离必须大于种内的遗传距离, 并且距离差异大约为10倍。在本研究中18种胡椒鲷亚科鱼类51个个体的种内遗传距离平均值为 0.003, 种间遗传距离平均值为0.142, 种间遗传距离是种内的47倍。此外, 胡椒鲷亚科鱼类种内遗传距离范围为 0.000—0.010, 显著低于Hebert等[11]所推荐的物种鉴定最小种间遗传距离0.020 (2%); 而种间遗传距离范围为0.036—0.193,大于Hebert设定的2%的遗传差异。可知, COⅠ基因序列作为胡椒鲷亚科 DNA条形码, 可有效进行物种的分子鉴定分析。
3.2 基于 DNA条形码序列胡椒鲷亚科鱼类分子系统进化关系分析
本研究基于 COⅠ序列构建的系统进化树, 胡椒鲷亚科同种鱼不同个体均可聚在同一分支内, 形成严格的单系, 不同物种间的聚类关系均拥有较高的支持率。在系统进化树上, 胡椒鲷亚科中的矶鲈属分类地位最低, 位于进化树的基部。而种类数目最多的胡椒鲷属主要形成三个分支, 分支一的胡椒鲷属鱼类绝大多数种类具有鲜艳的色彩与斑纹, 分支二与分支三的胡椒鲷属鱼类, 大多体色单一, 无鲜艳色彩与斑纹, 进化树上许多种类都以高支持率聚成姐妹种, 结果可为形态学存在争议的物种分类提供分子生物学证据[5, 6]。
3.3 P. vittatus与P. orientalis物种有效性分析
目前绝大多数分类资料认为条纹胡椒鲷 P. vittatus (Linnaeus, 1758)与东方胡椒鲷 P. orientalis (Bloch, 1793)均为同一个物种: Oriental sweetlips[23—26]。Satapoomin与Randall[27]研究也指出, P. vittatus与P. orientalis两者是同种异名, P. vittatus是有效种名[28]。本研究分别获得鉴定为条纹胡椒鲷与东方胡椒鲷的样本材料, 其中条纹胡椒鲷标本由南非水生生物多样性研究所(SAIAB)提供, 共 3尾样本, 采集于西印度洋的塞舌尔群岛; 东方胡椒鲷标本由作者采集于西沙群岛, 共 4尾样本。基于 COⅠ基因分析表明, 条纹胡椒鲷与东方胡椒鲷的平均遗传距离为0.070, 显著高于Hebert等[11]所推荐的最小种间遗传距离0.020 (2%), 并且大于部分胡椒鲷属内部种间遗传距离: 如查氏胡椒鲷与红唇胡椒鲷(0.036)、查氏胡椒鲷与白条胡椒鲷(0.048)等。而两种胡椒鲷种内个体间平均遗传距离仅分别为 0.002 与 0.003, 远远小于其种间的遗传距离。这显示条纹胡椒鲷与东方胡椒鲷在基因上已经达到种以上的分化水平。在进化树上, 条纹胡椒鲷、东方胡椒鲷的个体分别聚为一支, 然后两者再相聚, 进化树上的枝长差异清晰把两种胡椒鲷区分开来。故基于分子水平的研究结果, 本研究认为, 条纹胡椒鲷与东方胡椒鲷可能是两个独立的物种, 不应该确定为同种异名。
3.4 少棘胡椒鲷属在胡椒鲷亚科中的系统进化地位
基于 COⅠ序列差异分析, 少棘胡椒鲷属与胡椒鲷属平均种间遗传距离(0.134)少于胡椒鲷属内部平均种间遗传距离(0.142)。并且在个体上, 大部分胡椒鲷属与少棘胡椒鲷属个体之间的遗传距离比其自身属内种间的遗传距离要小很多。在系统进化树上, 少棘胡椒鲷属的分类地位没有独立于胡椒鲷属类群之外, 而是位于胡椒鲷属内部, 与斑胡椒鲷和暗点胡椒鲷的种类聚在一起, 显示少棘胡椒鲷与胡椒鲷属之间很近的亲缘关系。该结果与近期分子系统分类研究一致[8—10], Sanciangco等[8]与Tavera等[9]对北美仿石鲈科鱼类的系统分类研究均揭示少棘胡椒鲷位于胡椒鲷属的内部。Tavera等[9]认为少棘胡椒鲷属与胡椒鲷属应该归为同一个属。在形态上,少棘胡椒鲷属与胡椒鲷属的一个主要形态差异就是少棘胡椒鲷属背鳍鳍棘数比胡椒鲷属要少, 前者数目为9—10, 后者为12—14[5, 6, 29—31]。此外, 两者之间软鳍条数目和侧线上鳞数也存在差别。在分子水平上, 少棘胡椒鲷属与胡椒鲷属之间的差异很小,本研究结果也支持了将少棘胡椒鲷属归为胡椒鲷属的分类学观点。
参考文献:
[1] Cheng Q T, Zheng B S. Systematic Synopsis of Chinese Fishes [M]. Beijing: Science Press. 1987, 339—341 [成庆泰,郑葆珊. 中国鱼类系统检索.北京:科学出版社. 1987, 339—341]
[2] Shen S J. Fishes of Taiwan [M]. Taibei: Taiwan University Press. 1993, 360—363 [沈世杰. 台湾鱼类志. 台北: 台湾大学出版. 1993, 360—363]
[3] Huang Z G. Species and Distribution of Marine Organisms in China [M]. Beijing: China Ocean Press. 1994, 708—709[黄宗国. 中国海洋生物种类与分布. 北京: 海洋出版社. 1994, 708—709]
[4] Meng Q W, Su J X, Miu X Z. Systematics of Fishes [M]. Beijing: Chinese Agricultural Press. 1995, 636—640 [孟庆闻, 苏锦祥, 缪学祖. 鱼类分类学. 北京: 中国农业出版社. 1995, 636—640]
[5] Mckay R J. Haemulidae. In: Fischer W, Bianchi G (Eds.), FAO Species Identification Sheets for Fishery Purposes. Western Indian Ocean (Fishing Area 51). Vol. 2. FAO, Rome. 1984
[6] Carpenter K E, Niem V H. FAO Species Identification Guide for Fishery Purposes.ISSN 1020—6868. The Living Marine Resources of the Western Central Pacific. Volume 5: Bony fishes part 3 (Menidae to Pomacentridae) [M]. FAO, Rome. 2001, 2961—2989
[7] Zhu S H, Zheng W J, Zou J X, et al. Molecular phylogenetic analysis of five Pomadasyidae fish based on mitochondrial cytochrome b sequences [J]. Journal of Tropical Oceanography, 2006, 25(4): 42—45 [朱世华, 郑文娟, 邹记兴, 等. 5种石鲈科鱼类细胞色素b基因序列及分子系统分析. 热带海洋学报, 2006, 25(4): 42—45]
[8] Ren G, Zhang Q, Qian K C, et al. Sequence analysis of twelve grunt fishes basedon 16S ribosomal RNA gene fragments [J]. Journal of Tropical Oceanography, 2007, 26(3): 48—52 [任岗, 章群, 钱开诚, 等. 12种石鲈科鱼类线粒体 16S rRNA基因的部分序列分析. 热带海洋学报, 2007, 26(3): 48—52]
[9] Sanciangco M D, Rocha L A, Carpenter K E. A molecular phylogeny of the Grunts (Perciformes: Haemulidae) inferred using mitochondrial and nuclear genes [J]. Zootaxa, 2011, 2966: 37—50
[10] Tavera J, Acero A, Balart E F, et al. Molecular phylogeny of grunts (Teleostei, Haemulidae), with an emphasis on the ecology, evolution, and speciation history of New World species [J]. BMC Evolutionary Biology, 2012, 12: 57
[11] Hebert P D N, Cywinska A, Ball S L et al. Biological identifications through DNA barcodes [J]. Proceedings of the Royal Society B-Biological Sciences, 2003a, 270: 313—322
[12] Hebert, P D N, Ratnasingham S, deWaard J R. Barcoding animal life: cytochrome c oxidase subunit 1 divergences among closely related species [J]. Proceedings of the Royal Society B-Biological Sciences, 2003b, 270: 596 —599
[13] Emre K, Sevan A, Ali˙ S T DNA barcoding common non-native freshwater fish species in Turkey: Low genetic diversity but high population structuring [J]. ?Mitochondrial DNA, 2013, 24(3): 276—?287
[14] Keskin E, Atar H H. DNA barcoding commercially important fish species of Turkey [J]. Molecular Ecology Resources, 2013, 13(5): 788—797
[15] Mao Y T, Gan X N, Wang X Z. DNA Barcodes and molecular phylogeny of Botiinae fishes based on the mitochondrial COⅠgene [J]. Acta Hydrobiologica Sinica, 2014, 34(4): 737—744 [毛云涛, 甘小妮, 王绪祯. 基于线粒体COⅠ基因的沙鳅亚科鱼类DNA条形码及其分子系统发育研究. 水生生物学报, 2014, 34(4): 737—744]
[16] Ward R D, Zemlak T S, Innes B H, et al. DNA Barcoding Australia’s fish species [J]. Philosophical Transactions of the Royal Society of B-Biological Sciences, 2005, 360: 1847—1857
[17] Thompson J D, Higgins D G, Gibson T J. Clusial W: improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position specific gap penalties and weight matrix choice [J]. Nucleic Acids Research, 1994, 22(22): 4673—4680
[18] Tamura K, Peterson D, Peterson N, et al. MEGA5: Molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods [J]. Molecular Biology Evolution, 2011, 28: 2731—2739
[19] Swofford D P. Phylogenetic Analysis Using Parsimony (and Other Methods) Version 10 [M]. Sinauer, Sunderland, MA. 2003
[20] Huelsenbeck J P, Ronquist F. MrBayes: Bayesian inference of phylogeny [J]. Bioinformatics, 2001, 17: 754—755
[21] Ronquist F, Huelsenbeck J P. MrBayes 3: Bayesian phylogenetic inference under mixed models [J]. Bioinformatics, 2003, 19: 1572—1574
[22] Peng J L, Wang X Z, Wang D. et al. Application of DNA barcoding based on the mitochondrial COⅠ gene sequences in classification of Culter (Pisces: Cyprinidae) [J]. Acta Hydrobiologica Sinica, 2009. 33(2): 271—276 [彭居俐, 王绪祯, 王丁, 等. 基于线粒体COⅠ基因序列的DNA条形码在鲤科 鲌属鱼类物种鉴定中的应用. 水生生物学报, 2009, 33(2): 271—276]
[23] Randall J E, Lim K K P. A checklist of the fishes of the South China Sea [J]. Raffles Bulletin of Zoology Supplement, 2000, (8): 569—667
[24] Gell F R, Whittington B. Diversity of fishes in seagrass beds in the Quirimba Archipelago, northern Mozambique [J]. Marine Freshwater Research, 2002, 53: 115—121
[25] Gillibrand C J, Harris A R, Mara E. Inventory and Spatial Assemblage Study of Reef Fish in the Area of Andavadoaka, South-West Madagascar (Western Indian Ocean) [J].Western Indian Ocean Journal of Marine Science, 2007, 6: 183—197
[26] Unsworth R K F. 2010. Seagrass meadows of the Wakatobi National Park [M]. In: Clifton, J, R K F Unsworth, D J Smith (Eds.), Marine Conservation and Research in the Coral Triangle: The Wakatobi National Park. Nova Publishers. New York. 2010, 101—126
[27] Satapoomin U, Randall J E. Plectorhinchus macrospilus, a new species of thicklip (Perciformes Haemulidae) from the Andaman Sea off southestern Thailand [J]. Phuket Marine Biological Center Research Bulletin, 2000, 63: 9—16
[28] Froese R, Pauly D. FishBase. World Wide Web Electronic Publication www.fishbase.org, version (9/2013)
[29] Randall J E and Lim K K P. A checklist of the fishes of the South China Sea [J]. The Raffles Bulletin of Zoology, 2000, 8(Supplement): 569—667
[30] Ramesh R, Nammalwar P. Database on coastal information of Tamilnadu [M]. Institute for Ocean Management Anna University Chennal-600 025. 2008, 1—132
[31] Shao K T, Ho H C, Lin P L, et al. A checklist of the fishes of southern Taiwan, Northern South China Sea [J]. The Raffles Bulletin of Zoology, 2008, 19(Supplement): 233—171
THE DNA BARCODING, CLASSIFICATION, AND PHYLOGENY OF INDO-WESTERN PACIFIC PLECTORHYNCHINAE
LIANG Ri-Shen, TAN Jia-Yu, LIANG Zhi-Gang, XUE Tao, FANG Hao-Hang and WU Zao-He
(College of Life Science, Zhongkai University of Agriculture and Engineering, Guangzhou 510225, China)
To explore whether COⅠsequences could be used as the DNA barcodes in the identification of Plectorhynchinae species, we analyzed the 651 bp COⅠsequences from 51 individuals of 18 Plectorhynchinae fish in this study. The genetic distances between and within species were calculated using MEGA 5.0, and the molecular phylogenetic trees were constructed using the maximum likelihood and Bayesian inference methods. The results showed that the average inter-species genetic distance (0.142) was 47 times higher than the average intra-species genetic distance (0.003). All the interspecies genetic distances were larger than the minimum value 0.020 (2%) suggested by Hebert for the species identification. In the molecular phylogenetic trees, each individual of the same species could form an independent monophyletic group, indicating that COⅠcould be potentially used as an effective barcode gene in the rapid and accurate identification of Plectorhynchinae species. According to the genetic distance values, we found that two Plectorhinchus species, P. orientalis and P. vittatus which were conventionally regarded as synonyms, could be actually two distinct species because of their large COⅠgenetic variations (0.070). The average genetic distance between Diagramma and Plectorhinchus was lower than the values of intra-Plectorhinchus species, which implied that the genetic variation between Diagramma and Plectorhinchus might be below the significant level. This supported the notion that Diagramma could be classified into the Plectorhinchus genus.
DNA barcodes; COⅠgene; Plectorhynchinae; Phylogeny
Q346+.3
A
1000-3207(2015)04-0766-08
10.7541/2015.100
2014-10-08;
2015-01-12
国家自然科学基金项目(30972258); 广东省大学生创新创业训练计划项目(201511347028); 仲恺农业工程学院大学生创新基金项目(2014A23)资助
梁日深(1984—), 男, 广东开平人; 博士, 讲师, 主要研究方向为水生生物学。E-mail: cheetahliang@126.com

