草鱼呼肠孤病毒衣壳蛋白VP7真核重组质粒的构建及免疫效果评价
郝贵杰 袁雪梅 潘晓艺 徐 洋 姚嘉赟 蔺凌云 尹文林 沈锦玉
(浙江省淡水水产研究所, 农业部淡水渔业健康养殖重点实验室, 浙江省鱼类健康与营养重点实验室, 湖州 313001)
草鱼呼肠孤病毒衣壳蛋白VP7真核重组质粒的构建及免疫效果评价
郝贵杰 袁雪梅 潘晓艺 徐 洋 姚嘉赟 蔺凌云 尹文林 沈锦玉
(浙江省淡水水产研究所, 农业部淡水渔业健康养殖重点实验室, 浙江省鱼类健康与营养重点实验室, 湖州 313001)
为研究开发草鱼呼肠孤病毒(Grass carp reovirus, GCRV)基因疫苗, 以编码其主要衣壳蛋白VP7的序列为靶基因, 克隆构建了真核表达重组质粒 pEGFP-N1-VP7。用脂质体法将其转染真核细胞COS-1和CIK进行瞬时表达, 荧光显微镜观察及特异性RT-PCR检测结果表明, 成功转染并得到了高效表达。大量扩增重组菌, 提取并制备重组质粒pEGFP-N1-VP7, 肌肉注射免疫(20±5) g的健康草鱼, 重组质粒按0.5和5 µg分为2 组, 同时设5 µg空载体组及对照组。免疫草鱼22d后, 检测草鱼肠、外周血、肾脏、脾脏的呼吸暴发活性及淋巴细胞的增殖反应; 免疫草鱼21d、28d、35d、42d、56d、70d、84d和98d后, 分别尾静脉采血并分离血清, 用双抗体夹心ELISA方法进行抗体水平的测定。结果表明, 构建的含VP7蛋白的核酸疫苗既可诱导草鱼的细胞免疫, 又可诱导特异性体液免疫, 具有明显的免疫应答作用。按照每尾0.5 µg重组质粒的剂量免疫草鱼后35d进行攻毒, 免疫保护率达到67%, 此研究为GCRV基因疫苗的研制提供了实验资料。
草鱼呼肠孤病毒; 衣壳蛋白; 真核表达; 体液免疫; 细胞免疫
草鱼(Grass carp, Ctenopharyngodon idellus)是一种草食性鱼类, 饲养成本低, 养殖地域广, 是中国淡水养殖的主要鱼类, 其产量占淡水养殖总产量的20%以上, 具有较高的经济价值[1, 2]。但草鱼病毒性出血病的频频发生大大降低了其成活率, 对全国草鱼养殖产业造成重大威胁, 常引起草鱼鱼种及成鱼的大批死亡,该病已被中国农业部列入二类动物疫病病种名录[3]。该病的病原为草鱼呼肠孤病毒(Grass carp reovirus, GCRV), 是水生呼肠孤病毒(Aquareovirus, ARV)属中毒力最强的一成员, 也是中国分离鉴定并在国际上首次完成全基因序列分析的的第一株鱼类病毒[4—6]。GCRV直径大小约为75 nm, 无囊膜, 具有双层衣壳, 在pH3—11之间十分稳定, 对氯仿和乙醚处理不敏感, 其基因组由11条dsRNA组成[7, 8]。其中S10 节段共有909 bp, 仅有一个ORF编码VP7蛋白, 约34 kD, VP7为病毒的外衣壳蛋白, 具有溶蛋白裂解作用, 在病毒的感染及免疫中起着不可替代的作用[9—11]。Attoui等[12]在2012年第九届国际病毒分类委员会报告中指出水生呼肠孤病毒属A-G亚型的划定主要是根据S10基因及其编码蛋白VP7的变异水平。近年来, 本实验室与中国科学院武汉病毒研究所方勤课题组针对草鱼出血病开展了一些合作研究, GCRV的VP7蛋白被体外表达并证明具有较好的抗原性, 并且通过制备VP7抗体进行中和实验, 证明其具有较高的中和活性, 表明 VP7是GCRV主要抗原表位之一[13—16]。因此, 以其为靶蛋白, 研制GCRV的基因疫苗成为可能。
基因疫苗(Genetic vaccine)根据其特点被称为第三代疫苗, 第一代为弱毒、灭活疫苗, 第二代为基因重组的亚单位疫苗。我们平时常说的核酸疫苗(Nucleic acid vaccine)、DNA疫苗(DNA vaccine)也是指基因疫苗, 与传统疫苗的最大区别是该疫苗是通过宿主细胞的转录系统合成抗原蛋白, 从而诱导免疫动物产生对该目标抗原蛋白的免疫应答, 以达到预防和治疗疾病的目的。其核心是将编码某种已知目标抗原蛋白的外源基因克隆到真核表达载体上,将重组的质粒 DNA直接注射到动物体内而实现体内真核表达。与传统疫苗相比, 基因疫苗具有较多的优势, 如可与其他免疫原组成多价疫苗、免疫效果好、生产成本低、保护期长和安全性好等优点[17, 18]。目前, 关于鱼用基因疫苗的研究与应用主要有鲤春病毒血症病毒(Spring viraemia of carp virus, SVCV)、淋巴囊肿病毒(Lymphocystis disease virus, LCDV)、病毒性出血败血症病毒(VHSV)和鲑、鳟的传染性造血器官坏死病毒(Infectious haematopoietic necrosis virus, IHNV)等传染性病毒病防治的相关报道[19—21]。近年来也有细菌 DNA 疫苗研究的报道[22, 23], 有关草鱼出血病基因疫苗的报道较少, 本研究是在前期构建真核重组质粒pCI-VP7的基础上[25], 再选择真核表达载体 pEGFP-N1为载体, 构建融合表达增强型绿色荧光蛋白(EGFP)和VP7蛋白的真核表达载体,并初步研究该基因疫苗对草鱼的免疫效果, 为进一步研制GCRV多价基因疫苗提供数据与实验基础。
1 材料与方法
1.1 实验用质粒、细胞株及实验动物等
真核表达载体pEGFP-N1由浙江大学动物科学学院惠赠, 含 VP7整个编码区的克隆载体 pMD19-T-VP7由本室构建。CIK细胞由本实验室(农业部淡水渔业健康养殖重点实验室)保存, COS-1细胞由扬州大学兽医学院惠赠, 分泌草鱼IgM单抗的杂交瘤细胞株4D5由本室制备保存, GCRV毒株为本室自行分离保存, 标准参考株 GCRV873, 由长江水产研究所鱼病研究室惠赠。健康草鱼, 体重(20±5) g,购自湖州浙北新品种繁育公司。
1.2 GCRV VP7基因PCR的扩增
根据真核表达载体pEGFP-N1的多克隆位点序列及目的片段不能带终止密码子的特性, 在VP7蛋白编码区设计了 1对含酶切位点的特异性引物, 上游和下游引物序列为 F1: 5′-CGGAATTC ACCACG ATGCCACTTCAC-3′ (26 bp, 划线处为EcoRⅠ酶切位点), R1: 5′-CGGGATCC GGATGGCTCCACATGC AA-3′ (26 bp, 划线处为BamHⅠ酶切位点), 预计产物为830 bp, 以本室构建的克隆载体pMD19-T-VP7重组质粒为模板, 扩增体系按照Ex Taq酶(TaKaRa)推荐的体系进行, 50 μL反应体系中加入10倍稀释质粒模板DNA 1 μL进行PCR扩增, 反应条件: 95℃预变性 5min; 然后 94℃预变性 50s; 55℃退火 50s; 72℃延伸1min; 共35个循环; 最后72℃延伸10min, 12 ℃ 10min 。取产物进行琼脂糖凝胶电泳检测。1.3 重组质粒pEGFP-N1-VP7的构建
将上述PCR产物回收纯化, 以EcoR Ⅰ/BamHⅠ分别双酶切载体pEGFP-N1和回收的PCR产物, 再经过回收纯化、连接及转化, 涂布于含卡那霉素(50 μg/mL)的LB板上筛选鉴定。阳性克隆扩增后小量提取质粒, 经PCR和酶切鉴定后, 送至南京金斯瑞生物公司测序。
1.4 重组质粒pEGFP-N1-VP7质粒转染及鉴定
将阳性重组质粒转染COS-1和CIK细胞, 转染方法参照文献[25]进行, 在荧光显微镜下观察并拍照。
按 RNA提取试剂盒说明书提取转染 pEGFPN1-VP7 质粒的COS-1和CIK细胞总RNA, RT-PCR检测转染质粒的转录, 根据重组质粒测序的基因序列, 设计1对能扩增包括重组质粒中VP7和GFP的部分序列的PCR引物, 共约712 bp, F3: 5′-GACCAT CCCACCAAACCG-3′, R3: 5′-CTCGATGCGGTTCA CCAG-3′, 反应体系: cDNA模板1 μL, 10×Ex Taq buffer (内含Mg2+) 5 μL, F3、R3 (100 nmol/L)各1 μL, dNTP (2.5 mmol/L) 4 μL, Ex Taq酶(5U)0.25 μL, 补ddH2O 37.75 μL 至50 μL。反应条件: 94℃预变性5min; 然后94℃变性50s; 48℃退火50s; 72℃延伸1min; 36个循环; 最后72℃延伸10min, 12 ℃ 10min 。产物进行琼脂糖凝胶电泳鉴定。
1.5 核酸疫苗的制备及免疫
将重组质粒 pEGFP-N1-VP7在含卡那霉素(50 μg/mL )的LB液体培养基中大量扩增, 采用除内毒素质粒提取试剂盒提取质粒 DNA, 并用超微量分光光度计(NanoDrop2000, USA)对核酸浓度进行定量。
草鱼在过滤的池塘水中充氧饲育, 水温(20—22) ℃。试验共分4个组, 每组35尾, 分别为肌肉注射: (1)注射 PBS对照, (2)注射空载体 pEGFP-N1 (5 μg/尾), (3)注射重组质粒pEGFP-N1-VP7(5 μg/尾), (4)注射重组质粒pEGFP-N1-VP7(0.5 μg/尾), 以上各处理组注射体积均为100 μL/尾。草鱼免疫22d后进行解剖, 在无菌条件下取不同组织用于淋巴细胞悬液的制备并测定实验指标。另外, 在草鱼免疫后不同时间进行尾静脉采血, 4℃冰箱过夜后经低速离心取血清, –20℃保存, 用于血清抗体的检测。
1.6 受免草鱼细胞免疫效果评价
免疫细胞的制备 参照郑风荣[26]的方法, 分别制备草鱼外周血淋巴细胞及草鱼脾脏、肠黏膜、肾脏淋巴细胞, 胎盘兰染色计数, 调细胞浓度为106cells/mL。
淋巴细胞转化的测定 取 96孔细胞培养板,每孔加入淋巴细胞悬液100 μL, 再加入1 mg/mL的PHA各10 μL, 放入22℃细胞培养箱中, 每24h吹打一次, 48h后每孔加入80 μL MTT(噻唑蓝); 继续培养4h 后, 每孔加入80 μL的DMSO, 570 nm处测吸光值, 并进行统计学分析。*表示免疫组与对照组之间具有显著性差异(P<0.05), **表示免疫组与对照组之间具有极显著性差异(P<0.01)
呼吸暴发的测定 取96孔酶标板, 每孔加入淋巴细胞悬液100 μL, 分别加入100 μL 1 mg/mL的NBT(四氮唑蓝, 10 mmol/L、pH 7.4的PBS 配制), 22 ℃细胞培养箱中孵育1h; 分别加入100 μL无水甲醇, 400 g/min水平离心10min, 弃上清, 用70 %甲醇洗3遍, 每孔加入100 μL、2 mol/L的KOH和140 μL 的DMSO, 620 nm处测吸光值, 并进行统计学分析。1.7 受免草鱼体液免疫效果评价
建立评价疫苗效果的 TAS-ELISA方法 用包被液 CBS(pH9.6碳酸盐缓冲液)将本课题组纯化的VP7融合蛋白稀释到50 μg/mL, 100 µL/孔, 加入96孔酶标板, 4℃冰箱包被过夜, PBST充分洗涤包被板, 每次3—5 min , 洗涤3—4次; 用含8%脱脂奶粉的PBS封闭, 200 µL/孔, 37℃封闭2h, 同上洗涤。将草鱼血清分别进行1︰80 稀释, 每孔加入100 µL, 37℃孵育1h, 同上洗涤。然后每孔加入100 µL 1︰1000稀释的草鱼IgM单抗腹水(本室制备), 37℃孵育1h, 同上洗涤。每孔加入50 µL 1︰2000稀释的羊抗鼠IgG酶标抗体, 37℃孵育1h, 同上洗涤。用磷酸-柠檬酸缓冲液配制的 OPD底物液进行显色, 每孔50 µL, 37℃避光显色10—l5min。2 mol/L 硫酸终止反应, 每孔加50 µL。用Versanmax全波长酶标仪测定 A490值。P/N≥2.1者判为阳性, P/N<2.1者判为阴性。(P代表TAS-ELISA所测受免草鱼血清中抗体的OD值, N代表所测健康草鱼的相应血清中抗体的OD值)
受免草鱼血清中抗体的测定 每组草鱼在免疫21d、28d、35d、42d、56d、70d、84d和98d后,分别尾静脉采血并分离血清, 每组采 3尾。用前文描述的双抗体夹心 ELISA(TAS-ELISA)方法进行抗体水平的测定。
1.8 相对免疫保护率测定
按照 1.5中方法进行草鱼免疫, 核酸疫苗含量为0.5 μg/尾, 每组免疫30尾, 并设对照组, 注射同样剂量的PBS。注射免疫后35d, 进行GCRV攻毒,攻毒用毒株为自行分离的江西株 GCRV JX2008(根据前期攻毒实验及细胞培养测定, Karber氏方法进行计算, 测得其半数致死量为 107.5LD50/mL, 半数组织细胞感染量为109.0TCID50/mL), 腹腔注射剂量为 0.2 mL。28℃左右水温饲养, 观察 20d。计算各试验组和对照组死亡率后, 按下列公式进行计算:
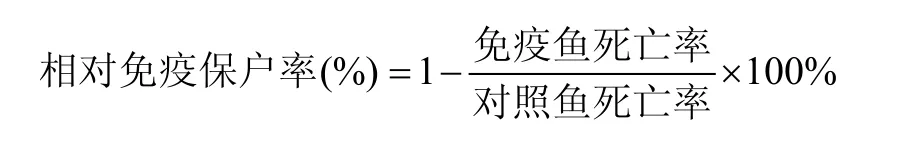
2 结果
2.1 重组质粒pEGFP-N1-VP7的构建与鉴定
将编码VP7蛋白的目的基因按照1.2及1.3中的方法进行PCR扩增、克隆及筛选鉴定, 获得阳性重组质粒pEGFP-N1-VP7。按照1.4中方法进行重组质粒的转染鉴定, 在荧光显微镜下观察到转染细胞胞核胞质均有绿色荧光, 说明EGFP与VP7融合基因在转染细胞中能够成功表达。转染细胞经RT-PCR鉴定, 具有预期的目的条带, 而正常细胞对照则无任何条带, 图略。
2.2 草鱼各组织淋巴细胞的增殖活性
噻唑蓝法(MTT法)测定草鱼外周血、肠黏膜、脾脏、肾淋巴细胞增殖反应(图 1), 4种组织的淋巴细胞增殖活性与对照组相比均有显著性差异, 其中外周血和肠黏膜中的增殖比例明显高于脾脏和肾,说明该核酸疫苗具有提高特异性 T细胞增殖反应的功能。并且随剂量的增加有所增强, 但差异不显著。
2.3 草鱼各组织淋巴细胞的呼吸暴发活性
四氮唑蓝法(NBT法)测定草鱼外周血、肠黏膜、脾脏、肾淋巴细胞呼吸暴发活性(图2)。4种组织的淋巴细胞呼吸暴发活性与对照组相比均有显著性差异, 其中外周血和肠黏膜的活性高于脾脏和肾, 说明该核酸疫苗具有提高特异性 T细胞增殖反应的功能。并且随剂量的增加有所增强, 但差异不显著。
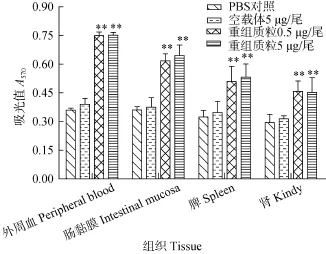
图1 草鱼肌肉注射重组质粒pEGFP-N1-VP7 22d淋巴细胞增殖反应(n=3)Fig. 1 The lymphocyte proliferation response of the grass carps on Day 22 after the muscle injection of the recombinant plasmid pEGFP-N1-VP7
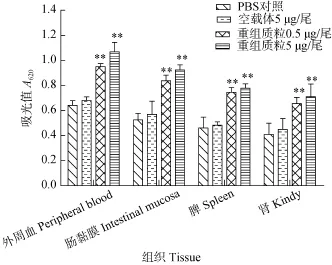
图2 草鱼肌肉注射pEGFP-N1-VP7 22d后各组织淋巴细胞呼吸暴发活性反应(n=3)Fig. 2 The respiratory burst response of the grass carps on Day 22 after the muscle injection of the recombinant plasmid pEGFP-N1-VP7
2.4 免疫草鱼的抗体水平
核酸疫苗免疫接种后不同时间, 草鱼血清中抗GCRV抗体的变化(图3)。从图中可以看出, 接种核酸疫苗 pEGFP-N1-VP7 21d后, 草鱼血清抗GCRV的抗体比对照组有明显增加, 35d后增加更为显著,达到最高峰, 但 56d后开始下降, 两种剂量产生抗体水平没有明显差异, 且持续到 98d实验结束时抗体水平依然高于对照组。
2.5 相对免疫保护率测定
按照 1.8中方法测定核酸疫苗免疫草鱼的相对免疫保护率, 结果表明, 核酸疫苗 pEGFP-N1-VP7 以 0.5 μg/尾注射免疫草鱼, 其相对免疫保护率为67%, 而对照组为30%, 显示出较好的免疫效果。
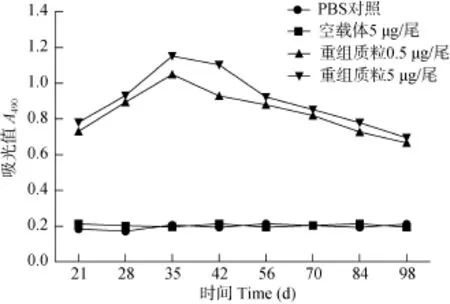
图3 草鱼肌肉注射核酸疫苗pEGFP-N1-VP7不同时间后血清抗体水平(n=3)Fig. 3 The serum antibody level in the grass carp at different time points after the muscle injection of the recombinant plasmid pEGFP-N1-VP7
3 讨论
自20世纪70年代以来, 草鱼出血病一直影响我国淡水养殖业的健康发展, 因此有关该病的病原及其防治技术方面的研究多次被列为国家科技攻关项目, 也曾获得过国家科技进步一等奖。多年来, 许多科学家致力于该病毒的研究, 全国各地相继应用组织浆灭活疫苗和细胞灭活疫苗进行免疫防治, 使得出血病在一定程度上得到了控制。但组织浆灭活疫苗需大量鱼体扩增病毒, 费时费力, 并存在扩散病毒的危险。细胞灭活疫苗的制备也需大量培养病毒, 成本很高, 并要求严格的检测手段以防止灭活不完全带来的致病风险, 这些疫苗本身的缺点限制了疫苗的推广与应用。近年来, 细胞弱毒疫苗也得到了广泛的应用, 并取得了较好的免疫效果, 但也存在毒力返强的风险, 而且毒株的变异会对疫苗的效果产生影响。所以以现代分子生物学和基因工程为基础, 研制一种安全、高效的单价或多价的基因疫苗为控制草鱼出血病带来了新的探索和希望。
DNA疫苗因其具有的特点和优势得到越来越多的研究与探索, 其在鱼类的应用已有成功报道[27, 28], 2005年, 虹鳟(IHNV)的DNA疫苗就是世界上拿到使用许可证书的两种 DNA疫苗的一种[29]。目前GCRV基因疫苗的研究仅见徐诗英等[24]的报道, 其将VP7基因克隆至转移载体pFastBzcTMDualz中, 获得了较好的免疫保护, 但其使用剂量较高, 可能与载体的表达水平有关。本课题组在前期构建pCI-VP7 的基础上[25], 进一步探讨编码GCRV外衣壳蛋白 VP7基因成为基因疫苗新材料的可能性, 选择 pEGFP-N1作为真核表达的载体, 其含有增强型绿色荧光蛋白(EGFP)标记基因, 因此可在动物细胞中表达含EGFP的融合蛋白, GFP是一种生物发光物质, 其荧光强弱取决于蛋白的含量, GFP分子量小,不影响外源蛋白的构象和功能, 并且在活细胞内长时间存在, 有利于真核重组质粒的鉴定及构建多价核酸疫苗。本研究成功构建了pEGFP-N1-VP7真核表达载体, 荧光显微镜下观察结果显示, 在大部分转染后的COS-1细胞和CIK细胞可观察到绿色荧光,进一步表明构建的重组质粒已成功转染到细胞中,并可以在其中自行高效表达。本研究前期为了比较所构建的两种重组质粒的免疫效果, 将两者以同样的剂量和途径免疫Balb/C小鼠3次后, ELISA测定其产生的抗GCRV特异性抗体, 结果表明核酸疫苗pCI-VP7及 pEGFP-N1-VP7均能在小鼠体内成功表达, 并诱导产生特异性 GCRV抗体, 最高效价分别达1︰160和到1︰320, 表明pEGFP-N1-VP7比pCIVP7表达VP7抗原的水平更高一些, 所以本研究选择pEGFP-N1-VP7进行草鱼免疫来进一步研究其免疫效果。
研究表明, DNA疫苗可以同时引起机体的细胞免疫和体液免疫反应, 而且常以细胞免疫为主。为了进一步研究核酸疫苗诱导草鱼产生免疫应答的机制, 本研究经背鳍基部肌肉免疫草鱼, 从细胞免疫和体液免疫两个方面进行评价。齐鹏等[30]用噻唑蓝法(MTT法)检测了猪口蹄疫合成肽疫苗可引起特异性T淋巴细胞免疫应答。杨馥如等[31]通过检测小鼠细胞因子如IFN-γ等产生的水平来评价H1亚型流感DNA疫苗诱导细胞免疫的水平。因为目前没有商品化检测鱼类细胞因子的试剂盒, 本研究通过噻唑蓝法(MTT法)检测了草鱼外周血、肠黏膜、脾脏和肾的淋巴细胞增殖反应, 用四氮唑蓝法(NBT法)测定了各组织淋巴细胞的呼吸暴发活性, 结果显示: 受免草鱼在免疫后 22d, 各免疫相关组织的淋巴细胞增殖和呼吸暴发活性均显著高于对照组, 且随免疫剂量的增加而提高, 但差异不显著。本研究应用本人之前制备的草鱼IgM单克隆抗体[32], 建立了双抗体夹心ELISA法检测抗GCRV抗体IgM的方法, 用该方法检测草鱼进行基因免疫后不同时间的血清抗体, 结果表明, 接种21d后, 两种不同剂量的核酸疫苗抗GCRV抗体均有明显增加, 35d后达到最高峰, 但56d后开始下降, 直到98d还维持在明显高于对照组的抗体水平, 两种剂量产生抗体水平没有明显差异。免疫保护率实验表明其相对保护率为 67%,对照组为30%, 这是因为目前该基因型的GCRV没有强毒株(目前流行的另一基因型毒力较强), 对照攻毒组也无法达到100%的死亡。从免疫保护率结果可以看出, 该疫苗还需要进一步优化, 如可通过构建多价疫苗(包括选择同基因型不同的抗原或不同基因型的保护性抗原作为靶抗原), 与分子佐剂联合使用及采用在生物体内可降解的高分子聚合物作为载体递送DNA疫苗[33], 来提高DNA疫苗的免疫效果。本研究为进一步开发草鱼出血病DNA疫苗奠定了重要基础。
[1] Ge X P. Current state and construction of the industry technology system on conventional freshwater fish [J]. China Fisheries, 2010, (5): 5—9 [戈贤平. 我国大宗淡水鱼养殖现状及产业技术体系建设. 中国水产, 2010, (5): 5—9]
[2] Wang F H, Li A X. Advances in research of hemorrhage of grass carp [J]. South China Fisheries Science, 2006, 2(3): 66—71 [王方华, 李安兴. 草鱼病毒性出血病研究进展.南方水产, 2006, 2(3): 66—71]
[3] Chen A P, Jiang Y L, Qian D, et al. Hemorragic disease of grass carp [J]. China Fisheries, 2010, 11(2): 34—35 [陈爱平,江育林, 钱冬, 等. 草鱼出血病. 中国水产, 2010, 11(2): 34—35]
[4] Chen W W, Wang Q, Liu Y K, et al. Isolation and identification of new GCRV strain and primary study on its immunogenicity [J]. Acta Hydrobiologica Sinica, 2011, 35(5): 790—795 [曾伟伟, 王庆, 刘永奎, 等. 一株草鱼呼肠孤病毒弱毒株的分离、鉴定及免疫原性初步分析. 水生生物学报, 2011, 35(5): 790—795]
[5] Rangel A A, Rockemann D D, Hetrick F M, et al. Identification of grass carp haemorrhage virus as a new genogroup of aquareovirus [J]. Journal of General Virology, 1999, 80: 2399—2402
[6] Winton J R, Lannan C N, Fryer J L, et al. Morphological and biochemical properties of four members of a novel group of reoviruses isolated from aquatic animals [J]. Journal of General Virology, 1987, 68(2): 353—356
[7] Ke L H, Fang Q, Cai Y Q. Characteristics of a novel isolate of grass carp hemorrhagic virus [J]. Acta Hydrobiologica Sinica, 1990, 14(2): 153—159 [柯丽华, 方勤, 蔡宜权. 一株新的草鱼出血病病毒分离物的特性. 水生生物学报, 1990, 14(2): 153—159]
[8] Fang Q, Attoui H.Francois J, et al. Sequence of genome segments1, 2 and 3 of the grass carp reovirus (genus aquareovirus, family reoviridae) [J]. Biochemical andBiofisical Research Communications, 2000, 274(3): 762—766
[9] Qiu T, Lu R H, Zhang J, et al. Compete nucleotide sequence of the S10 genome segment of grass carp reovirus (GCHV) [J]. Diseases of Aquatic Organisms, 2001, 44(1): 69—74
[10] Fang Q, Shah S, Liang Y, et al. 3D Reconstruction and capsid protein characterization of grass carp reovirus[J]. Science in China Series C, 2005, 48: 593—600
[11] Fang Q, Seng E K, Ding Q Q. Characterization of infectious particles of grass carp reovirus by treatment with proteases [J]. Archives of Virology, 2008, 153: 675—682
[12] Attoui H, Mertens P P C, Becnel J, et al. Family reoviridae. In Virus Tsxonomy: Classification and Nomenclature of Viruses. Ninth Report of the International Committee on Taxonomy of Vireses [M]. Edited by King A M Q, M J Adams, E B Carstens, et al. London: Academic Press. 2012, 541—637.
[13] Zhang L L, Shen J Y, Fang Q, et al. High level expression of grass carp reovirus VP7 protein in prokaryotic cells [J]. Virologica Sinica, 2008, 23(1): 51—56
[14] Shao L, Sun X, Fang Q. Antibodies against outer-capsid proteins of grass carp reovirus expressed in E. coli are capable of neutralizing viral infectivity [J]. Virology Journal, 2011, 8: 347
[15] Xu Y, Hao G J, Shen J Y, et al. Isolation and identification of two Grass carp Reovrus strains in Jiangxi Province [J]. Freshwater Fisheries, 2010, 40(3): 54—59 [徐洋, 郝贵杰,沈锦玉,等. 两株草鱼呼肠孤病毒江西株的分离与鉴定.淡水渔业, 2010, 40(3): 54—59]
[16] Hao G J, Shen J Y, Pan X Y, et al. Isolation and identification of a strain of Grass carp reovirus in Huzhou [J]. Progress in Fishery Sciences, 2011, 32(1): 47—52 [郝贵杰,沈锦玉, 潘晓艺, 等. 草鱼呼肠孤病毒湖州分离株的分离及鉴定. 渔业科学进展, 2011, 32(1): 47—52]
[17] Wang K. Animal nucleic acid vaccine research status and prospects for development [J]. China Animal Husbandry & Veterinary Medicine, 2010, 37(8): 186—188 [王凯. 动物核酸疫苗研究现状及发展前景. 中国畜牧兽医, 2010, 37(8): 186—188]
[18] Hao G J, Shen J Y, Pan X Y. The current development of nucleic acid vaccine and its application in fish [J]. Journal of Dalian Fisheries University, 2007, 2(2): 142—148 [郝贵杰,沈锦玉, 潘晓艺. 核酸疫苗的研究进展及其在鱼类免疫中的应用. 大连水产学院学报, 2007, 2(2): 142—148]
[19] Zheng F R, Sun X Q, Liu H Z, et al. Study on the distribution and expression of a DNA vaccine against lymphocystis disease virus in Japanese flounder (Paralichthys olivaceus) [J]. Aquaculture, 2006, 261: 1128—1134
[20] Lorenzen N, Lorenzen E, Einer—Jensen K, et al. DNA vaccines as a tool for analyzing the protective immune response against rhabdoviruses in rainbow trout [J]. Fish & Shellfish Immunology, 2002, 12(5): 439—453
[21] Utke K, Kock H, Schuetze H, et al. Cell-mediated immune responses in rainbow trout after DNA immunization against the viral hemorrhagic septicemia virus [J]. Develomental and Comparative Immunology, 2008, 32: 239—252
[22] Chen Z H, Lin T L, Xia C. Current development in the studies of fish DNA vaccines [J]. Acta Hydrobiologica Sinica, 2003, 27(6): 648—653 [陈振海, 林天龙, 夏春. 鱼类DNA疫苗研究的新进展. 水生生物学报, 2003, 27(6): 648—653]
[23] Sun Y, Hu Y H, Liu C S, et al. Construction and analysis of an experimental Streptococcus iniae DNA vaccine [J]. Vaccine, 2010, 28(23): 3905—3912
[24] Hao G J, Pan X Y, Yao J Y, et al. Construction and identification of recombinant eukaryotic expression vector pCI-VP7 containing GCRV VP7 gene [J]. Journal of Fisheries of China, 2010, 34(5): 807—813 [郝贵杰, 潘晓艺,姚嘉赟 , 等. 草鱼呼肠孤病毒衣壳蛋白VP7基因真核表达载体 pCI-VP7的构建及鉴定, 水产学报, 2010, 34(5): 807—813]
[25] Zheng F R. The research about protective efficiency and safety of DNA vaccine against Lymphocystis disease virus (LCDV) [D]. Thesis for Doctor of Science. Ocean University of China, Qingdao. 2006 [郑风荣. 淋巴囊肿病毒核酸疫苗的免疫效果评价及安全性研究, 博士学位论文, 中国海洋大学, 青岛. 2006]
[26] Tonheim T C, D, Dalmo R A, Bgwald J, et al. Specific uptake of plasmid DNA without reporter gene expression in Atlantic salmon (Salmo salar L.) kidney after intramuscular administration [J]. Fish & Shellfish Immunology, 2008, 24(1): 90—101
[27] Tian J Y, Sun X Q, Chen X G. Formation and oral administration of alginate microspheres loaded with pDNA coding for lymphocystis disease virus (LCDV) to Japanese flounder [J]. Fish & Shellfish Immunology, 2008, 24: 592—599
[28] Lorenzen N, Lapatra S E. DNA vaccines for aquaculture fish [J]. Revue Scientifique et Technique (International Office of Epizootic), 2005, 24: 201—203
[29] Qi P, Xiao J, Wang N, et al. Cellullar immunologic response of immunized Swine following Synthetical peptide vaccine by MTT assay [J]. Chinese Journal of Veterinary Drug, 2011, 4(2): 13—15 [齐鹏, 肖进, 王楠, 等. MTT法评价猪口蹄疫合成肽疫苗的细胞免疫应答. 中国兽药杂志, 2011, 4(2): 13—15]
[30] Yang F R, Yu H, Wang B, et al. Construction of a universal vaccine against H1 subtype influenza viruses and its protective efficacy in mice [J]. Acta Veterinaria et Zootechnica Sinica, 2013, 44(2): 240—249 [杨馥如, 于海, 王斌, 等. H1 亚型流感病毒通用疫苗的构建及其对小鼠免疫保护效力研究. 畜牧兽医学报, 2013, 44(2): 240—249]
[31] Hao G J, Shen J Y, Xu Y, et al. Production andcharacterization of monoclonal antibodies against grass carp immunoglobulin [J]. China Journal Cell Molecular Immunology, 2009, 25(9): 808—810 [郝贵杰, 沈锦玉, 徐洋, 等. 草鱼免疫球蛋白单克隆抗体的制备及其特性鉴定.细胞与分子免疫学杂志, 2009, 25(9): 808—810]
[32] Zhang H, Wang G L, Han X Y, et al. Preparation and immunogenicity of ploy (Lactide-Co-Glycolide) microparticles DNA vaccine against Porcine Reproductive and Respiratory syndrome [J]. Acta Veterinaria et Zootechnica Sinica, 2013, 44(7): 1117—1123 [张辉, 王光利, 韩秀英, 等. PRRS 聚乳酸乙醇酸微粒DNA疫苗的制备及其免疫原性. 畜牧兽医学报, 2013, 44(7): 1117—1123]
THE CONSTRUCTION OF PEGFP-N1-VP7 CONTAINING GCRV VP7 GENE AND STUDIES ON ITS IMMUNE EFFICACY
HAO Gui-Jie, Yuan Xue-Mei, PAN Xiao-Yi, XU Yang, YAO Jia-Yun, LIN Ling-Yun,
YIN Wen-Lin and SHEN Jin-Yu
(Agriculture Ministry Key Laboratory of Healthy Freshwater Aquaculture, Key Laboratory of Fish Health and Nutrition of Zhejiang Province, Zhejiang Institute of Freshwater Fisheries, Huzhou 313001, China)
In this study, to research and development the gene vaccine for Grass carp reovirus (Grass carp reovirus, GCRV), the recombinant plasmid pEGFP-N1-VP7 which carried the gene of the major capsid protein VP7 of GCRV was constructed and identified. Then the recombinant plasmid was transfected into COS-1 and CIK cells with lipofectamine 2000, and the fluorescence microscope and RT-PCR were used to detect the transient expression. The results showed that the 830 bp fragment of VP7 gene was successfully transfected and expressed in COS-1 and CIK cells. To evaluate the immune efficacy of the DNA vaccine, the plasmids were extracted and purified from the mass culture of the recombinant bacteria containing the recombinant plasmid pEGFP-N1-VP7. Vaccine was diluted into 0.5 µg/100 µL and 5 µg/100 µL with PBS. Immune experiment was divided into four groups that are 0.5 µg group, 5 µg group, empty plasmid group and PBS control group. They were injected intramuscularly grass carp which weighs (20±5) g. Lymphocytes from different tissues and organs, such as the peripheral blood, the mesentery, the spleen and the kidney, were collected on Day 22 after the vaccination. The respiratory burst function was measured with NBT and the lymphocyte proliferation assay was conducted with MTT. The lymphocyte function of grass carps was up-regulated after the immunization with the DNA vaccine. In addition, the blood samples were also collected on Day 21, 28, 35, 42, 56, 70, 84 and 98 after the immunization. The specific antibody against VP7 in the sera of grass carps was detected with the triple antibody sandwich ELISA. These results demonstrated that the DNA vaccine could evoke both the cellular and the humoral immune response. The grass carps were immunized with 0.5 µg recombinant plasmids per tail, and the protection rate could reach 67%. Our study provided fundamental information on the research of the gene vaccine of GCRV.
Grass carp reovirus; Major capsid protein; Eukaryotic expression; Humoral immunity; Cellular immunity
S942.1
A
1000-3207(2015)04-0751-07
10.7541/2015.98
2014-08-12;
2014-12-16
浙江省科技厅重大科技专项重点农业项目(2012C12009-4); 湖州市科技攻关计划项目(2011GG11); 浙江省公益技术研究农业项目(2012C22046)资助
郝贵杰(1979—), 女, 安徽六安人; 硕士; 主要从事水生动物病害及免疫学研究。E-mail: melissa511@sina.com
沈锦玉(1963—), 女, 浙江湖州人; 研究员; E-mail: sjinyu@126.com

