五倍子降低大肠杆菌耐药性的效果
韦 嫔, 谭艾娟, 黄弘宇, 吕世明, 王学君, 符东顺, 蒋庆庆
(1.贵州大学 生命科学学院, 贵州 贵阳 550025; 2.贵州大学 动物科学学院, 贵州 贵阳550025)
五倍子降低大肠杆菌耐药性的效果
韦 嫔1, 谭艾娟1, 黄弘宇1, 吕世明2*, 王学君1, 符东顺1, 蒋庆庆1
(1.贵州大学 生命科学学院, 贵州 贵阳 550025; 2.贵州大学 动物科学学院, 贵州 贵阳550025)
为探明五倍子对大肠杆菌耐药质粒的消除效果和恢复对抗菌药物的敏感性,研究五倍子提取物处理耐药大肠杆菌E11、E22、E33、E44和E55,通过影印培养法筛选出耐药性消除菌落,应用微量肉汤稀释法检测其对抗菌药物敏感性的变化,同时检测消除子内质粒的丢失情况。结果表明:经1/2 MIC(最小抑菌浓度)五倍子提取物作用48 h后的耐药大肠杆菌E11、E22、E33、E44和E55对庆大霉素耐药性的消除率分别为24.41%、11.67%、10.33%、5.33%和16.67%,远高于十二烷基硫酸钠处理对照组(2.87%);耐药消除子对多种抗菌药物的MIC值出现下降,对庆大霉素、卡那霉素、地美环素和头孢唑林的敏感性除个别菌恢复至中介外,均从耐药、高度耐药恢复至敏感,MIC值降低最高达256倍。五倍子能恢复耐药菌对抗菌药物的敏感性,但耐药菌的质粒丢失与细菌耐药性下降无相关性。
五倍子; 大肠杆菌; 耐药性; 质粒; 消除
大肠杆菌是人类及动物肠道的正常寄生繁殖菌群,在环境中也广泛存在,作为条件性致病菌,其具备接受、储备和传播耐药遗传因子的能力,是潜在的耐药基因储存库或中介站,其质粒常携带多种耐药基因,以不同的方式在菌株间以较高的频率转移,是耐药性传播的重要方式[1]。近年来,随抗菌药物广泛使用,尤其是不规范使用,导致大肠杆菌的耐药水平不断增加,高度耐药和多重耐药现象十分严重。因此,如何有效消除大肠杆菌耐药质粒,减少耐药基因的传播,对降低或消除细菌耐药性的危害具有重要意义[2]。为此,笔者用五倍子提取物消除大肠杆菌的耐药性及耐药质粒,从而使其恢复对抗菌药物的敏感性,以减少耐药基因的传播,降低或消除细菌耐药性的危害。
1 材料与方法
1.1 药物与试剂
药物:五倍子,购于西安海佳生物科技有限公司;庆大霉素(GEN)、卡那霉素(KAN)、环丙沙星(CIP)、氧氟沙星(OFL)、地美环素(DMCT)、四环素(TET)、磺胺嘧啶(SD)、头孢唑林(CEF),均购自大连美仑生物技术有限公司。试剂:LB培养基、伊红美兰琼脂、MH琼脂,均购自上海博微生物科技有限公司;氯化钠(NaCl,分析纯),购于南汇彭德公社营房化工厂;十二烷基硫酸钠(SDS,分析纯),购自广东顺德化学生物研究所;质粒DNA抽提试剂盒,购自上海生工生物工程股份有限公司。
1.2 菌株
耐药大肠杆菌E11、E22、E33、E44和E55,分离自贵州省的部分规模养猪场,对卡那霉素、四环素、头孢唑林、庆大霉素、环丙沙星、氧氟沙星、地美环素和磺胺嘧啶均耐药。
1.3 五倍子提取液的制备及MIC测定
将中药五倍子按刘玉庆等[3]的方法煎煮提取后浓缩,使药液中生药含量为1 g/mL,115℃灭菌25 min,保存于4℃冰箱备用。参照文献[3-6]的方法测定五倍子提取液对耐药大肠杆菌的最小抑菌浓度(MIC)值。
1.4 耐药质粒消除子的筛选与鉴定
在LB肉汤培养基中加入五倍子提取液,使肉汤中五倍子的浓度为1/2 MIC,再分别加入耐药大肠杆菌(菌落数为5×l05CFU/mL),37℃恒温培养48 h,同时设不加药物的空白组和SDS对照组;然后再划线培养于无药LB培养基平板上,37℃培养,待长出单个菌落后随机挑取300个菌落,按照影印培养法[7-8]用无菌牙签分别挑取菌落对应点种于含GEN的MH琼脂平板及无药MH琼脂平板上,37℃培养24 h,挑取在含庆大霉素平板上不生长而在无药平板上生长的菌落,在LB固体培养基上传代后,再次接种在含庆大霉素平板上证实不生长的细菌,即为消除子。根据耐药性消除菌落数与检测菌落总数之比,计算大肠杆菌耐药性的消除率[9]。
1.5 菌株的质粒分析和耐药表型变化
通过提取5株耐药大肠杆菌及其相应消除子的质粒DNA,经琼脂糖凝胶电泳检测,观察耐药性消除后菌株质粒是否丢失。参照CLSI标准,应用微量肉汤稀释法测定5株大肠杆菌及其消除子对GEN、KAN、CIP、OFL、DMCT、TET、SD和CEF的MIC值,对比分析耐药性消除前后的耐药表型变化和药物敏感性的恢复效果。
2 结果与分析
2.1 五倍子提取液对大肠杆菌的MIC值
经测定,五倍子提取液对大肠杆菌表现出较好的抑菌效果,对大肠杆菌E11、E33和E55的MIC值均为7.81 mg/mL,对大肠杆菌E22和E44的MIC值均为15.62 mg/mL。
2.2 对庆大霉素耐药性的消除
从表1看出,五倍子对菌株耐药性表现出一定的消除效果,作用24 h后,对耐药菌株的最高消除率可达22.33%,平均消除率为12.53%;48 h后最高消除率可达24.41%,平均消除率为13.68%,对大肠杆菌耐药性的消除率均高于十二烷基硫酸钠组。未经药物处理的空白对照的耐药性自发消除率为0,说明细菌耐药质粒无法自然丢失。
2.3 耐药性消除前后菌株的质粒
大肠杆菌经五倍子提取液作用48 h后,除E11和E55菌株质粒条带没有丢失外,E22和E33均丢失了2条质粒条带,E44丢失1或3条质粒条带(图示),说明中药五倍子有消除大肠杆菌耐药质粒的效果。
表1 五倍子提取物处理后5株大肠杆菌对庆大霉素耐药性的消除率
Table 1 Elimination rate of 5E.colistrains treated with Galla Chinensis extract to Gentamicin resistance
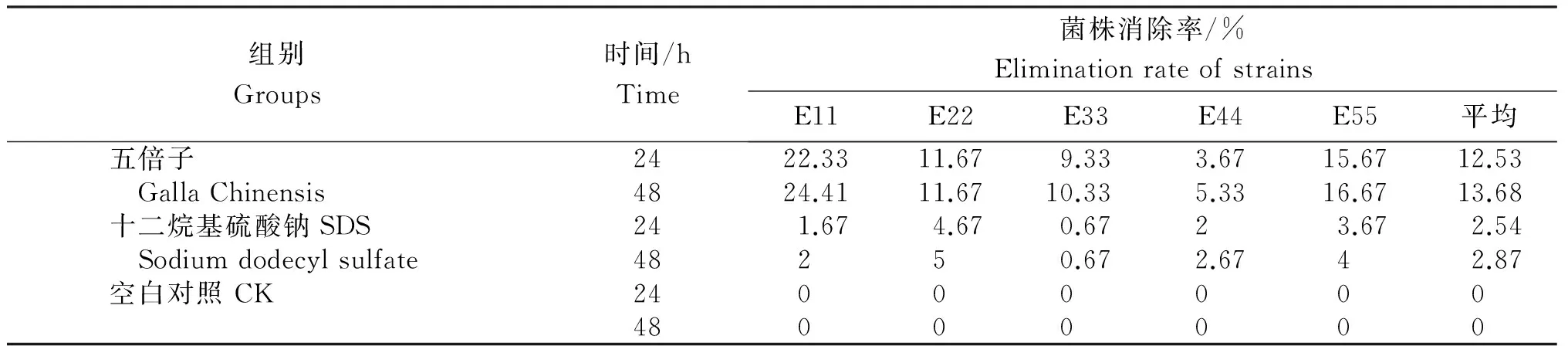
组别Groups时间/hTime菌株消除率/%EliminationrateofstrainsE11E22E33E44E55平均五倍子2422.3311.679.333.6715.6712.53 GallaChinensis4824.4111.6710.335.3316.6713.68十二烷基硫酸钠SDS241.674.670.6723.672.54 Sodiumdodecylsulfate48250.672.6742.87空白对照CK2400000048000000
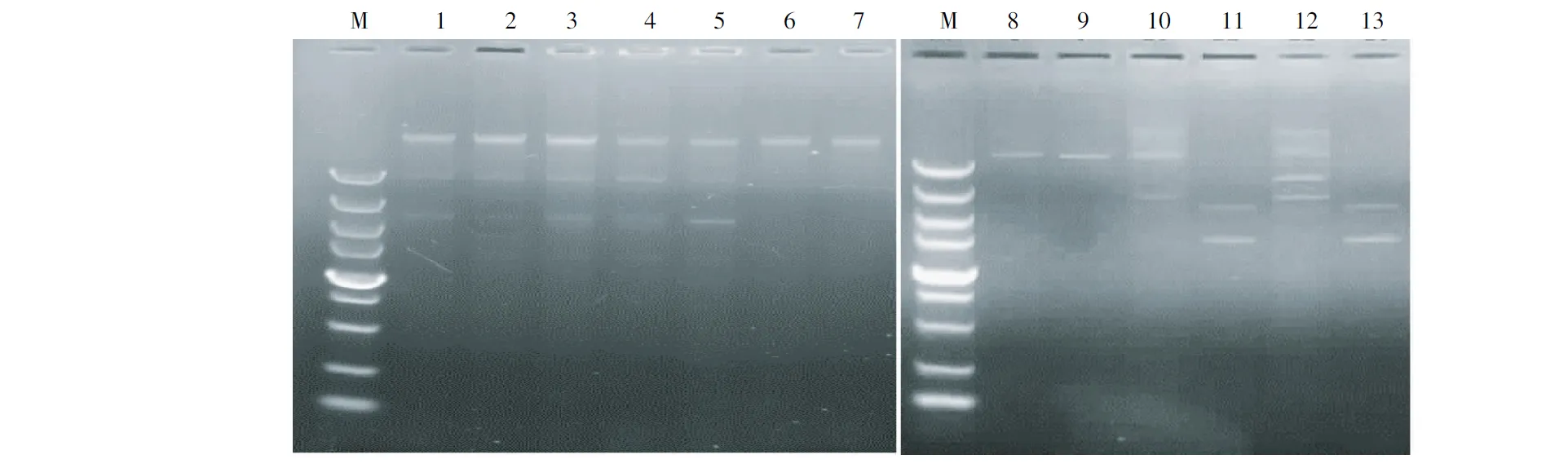
注:M为5 000 DNA Mark,1为E11,2为E22,3为E33,4和5为E11消除子,6为E22消除子,7为E33消除子,8~10为E44消除子,11为E55消除子,12为E44,13为E55。
Note: M, 5000DNA Marker; 1, E11; 2, E22; 3, E33; 4 and 5, Drug resistant colony of E11; 6,Drug resistant colony of E22; 7, Drug resistant colony of E33; 8~10, Drug resistant colonies of E44; 11, Drug resistant colony of E55; 12, E44; 13, E55.

图示 耐药大肠杆菌质粒消除前后的图谱
注:S表示敏感,I表示中介,R表示耐药。
Note: S, Susceptibility; I, Intermediary; R, Resistance.
2.4 耐药性消除前后细菌的耐药表型
从表2看出,未经五倍子提取液作用前,5株大肠杆菌对8种抗菌药物均耐药,经五倍子消除处理后,除对磺胺嘧啶的MIC值变化较小外,其余药物的MIC值均下降,其中,对卡那霉素、庆大霉素从高度耐药均恢复敏感,对头孢唑啉除E22变为中介外其余4株均由高度耐药恢复至敏感,对地美环素除E44变为中介外均由耐药恢复至敏感。
3 结论与讨论
3.1 五倍子抑制大肠杆菌的效果
中药是纯天然物质,具有来源广泛、安全可靠、毒副作用小、不易产生耐药性等特点,在中国应用于动物和人类已有几千年的历史[10],有些中药成分具有抑菌作用,可以消除细菌的耐药质粒[11]。五倍子作为传统中药,有敛肺涩肠功效,对大肠杆菌的抑制效果较好。研究结果表明,五倍子提取液对大肠杆菌具有一定的抑制作用,与马驰[12]的研究结果一致。五倍子提取液对不同细菌的抑菌浓度不同,原因可能是与不同耐药菌株的耐药程度和耐药机制不同有关[13]。
3.2 五倍子对大肠杆菌耐药性的消除
研究结果表明,空白对照组大肠杆菌的耐药性消除率为0,表明耐药大肠杆菌其质粒自然丢失的概率极低,而五倍子对耐药大肠杆菌的耐药性具有消除作用,但对不同菌株耐药性的消除率不同,作用48h后对E11耐药性的消除率为24.41%,对E44仅为5.33%;且随着作用时间的延长,其消除率均有所提高,呈现时间依赖性。
3.3 五倍子可致大肠杆菌质粒丢失
测定结果表明,五倍子提取液可使细菌丢失质粒条带,质粒条带丢失的消除子对抗菌药物的耐药性明显降低,与马驰[12]、舒刚等[14]的研究结果一致。但五倍子引起细菌质粒丢失的难易程度和顺序,以及质粒丢失与耐药谱型变化的关系有待进一步研究。
3.4 五倍子可使耐药大肠杆菌的敏感性恢复
五倍子提取液作用后耐药菌对庆大霉素、卡那霉素、地美环素和头孢唑林的敏感性恢复程度较大,除个别菌外其他从耐药恢复至敏感,其最小抑菌浓度(MIC)降低最高达256倍,多数药物的MIC值出现下降。说明,五倍子可在一定程度上恢复耐药菌对抗菌药物的敏感性,但五倍子使耐药菌的质粒丢失与细菌耐药性下降未呈相关性,有些消除子虽然其质粒条带没有丢失,但其耐药性也明显降低,其原因可能是部分决定耐药基因的小分子转座子或插入序列被消除,由于碱基数量少,因此在质粒的凝胶电泳图谱上没有区别[15];也有可能是因为中药作用机理还不明确,作用后质粒条带虽未丢失,但致使菌株携带的耐药基因发生突变而不表达[16]。
[1] 张文波,李宏睿,邓舜洲,等.鸡源大肠杆菌强毒株耐药基因的定位及耐药质粒消除[J].中国畜牧兽医,2012,39(5):48-51.
[2] 李苌清,周歧山,凌保东.耐药质粒消除的研究概况与展望[J].川北医学院学报,2003,18(2):168-171.
[3] 刘玉庆,李 晔,车程川,等.大肠杆菌对中草药敏感性试验及其方法研究[J].中兽医医药杂志,2003(1):3-5.
[4] 杨建江,韩文瑜,杜 锐,等.30种中草药对耐药性猪链球菌的抑菌试验[J].中兽医医药杂志,2004,23(2):14-16.
[5] Clinical and Laboratory Standards Institute(CLSI).Performance standards for antimicrobial susceptibility testing twentieth;information supplement[S].Wayne,PA:Clinical and Laboratory Standards Institute,2010:59-123.
[6] 李仪奎.中药药理实验方法学[M].上海:上海科学技术出版社,1991:3-49.
[7] 张文平,曹镐禄,张文书,等.千里光水浸液对大肠埃希菌R质粒的消除作用[J].广东医学,2007,28(8):1238-1239.
[8] 田彩平,王芳,姚伯程,等.浅谈影印培养法在生物实验中的应用[J].甘肃医药,2014,33(1):34-37.
[9] 肖 潇,李英伦,杨 锐.复方蒲公英对金黄色葡萄球菌耐药质粒的体外消除试验[J].中国兽医科学,2010,40(3):307-311.
[10] 聂国兴,付艳茹,李玉柱.中草药饲料添加剂在养殖业中的应用现状[J].河南畜牧兽医,2002,23(4):14-15.
[11] 方有仪,才让措,钱俊栋.中药消除细菌耐药性研究进展[J].中兽医医学杂志,2014(4):28-30.
[12] 马 驰.不同中药对3种细菌耐药质粒的消除作用研究[D].四川:四川农业大学,2011:14-15.
[13] 蒋加进,朱 卫,庄禧懿.黄连对鸡源大肠杆菌质粒消除作用的研究[J].畜牧与兽医,2013,45(11):79-81.
[14] 舒 刚,马 驰,黄 春,等.4种中药复方对大肠杆菌、沙门氏菌R质粒的消除作用[J].河南农业科学,2013,42(11):149-153.
[15] 王小平,刘海江,甄 蕾,等.松萝酸对金黄色葡萄球菌耐药质粒的消除作用[J].中药材,2006,29(1):36-39.
[16] 祁汝峰,黄 瑞,祁小飞.中西药消除耐药质粒pRST98的研究[J].中国血液流变学杂志,2004,14(1):46-47.
(责任编辑: 冯 卫)
Effects of Galla Chinensis on Drug Resistance ofEscherichiacoli
WEI Pin1, TAN Aijuan1, HUANG Hongyu1, LV Shiming2*,WANG Xuejun1, FU Dongshun1, JIANG Qingqing1
(1.CollegeofLifeScience,GuizhouUniversity,Guiyang,Guizhou550025; 2.CollegeofAnimalScience,GuizhouUniversity,Guiyang,Guizhou550025,China)
The elimination drug resistance colonies were screened from 5E.colistrains (E11,E22,E33,E44and E55)treated with Galla Chinensis extract by replica plating method. The antibiotic susceptibility and plasmid loss of elimination drug resistance colonies were detected by micro-broth dilution method to explore the elimination effects of Galla Chinensis on drug resistant plasmid and restoring antibiotic susceptibility ofE.colii strains.Results:The elimination rate of E11, E22, E33, E44 and E55E.colistrains with drug resistance treated with 1/2 MIC ( minimum inhibition concentration) Galla Chinensis extract after 48 h to Gentamicin resistance is 24.41%, 11.67%, 10.33%, 5.33% and 16.67% respectively, significantly higher than Sodium dodecyl sulfate treatment (2.87%).MIC value of drug resistant elimination colonies against multiple antibacterial agents reduces and the susceptibility of drug resistant elimination colonies against Gentamycin, Kanamycin, Demeclocycline and Cefazolin recovers from drug resistance and high drug resistance except for individual colonies. MIC value of drug resistant elimination colonies can decrease by 256 times compared with original drug resistant elimination colonies. Galla Chinensis can recover the susceptibility of drug resistant bacteria against antibacterial agents but plasmid loss of drug resistant bacteria is not related to reduction of drug resistance of bacteria.
Galla Chinensis;Escherichiacoli; drug resistance; plasmid; elimination
2015-03-25; 2015-07-09修回
贵州省科技厅社会发展攻关计划项目“猪肉食品安全保障关键技术研究”[黔科合SY字(2012)3060];贵州大学研究生创新基金项目“中药消除大肠杆菌耐药质粒的研究”(研农2015013)
韦 嫔(1990-),女,在读硕士,研究方向:细胞功能成分研究与利用。E-mail:425702628@qq.com
*通迅作者:吕世明(1963-),男,教授,博士,从事兽医药理学及毒理学研究。E-mail:lvlvsm@163.com
1001-3601(2015)07-0381-0137-03
S858.28
A

