反胶束水合萃取技术在生物工程领域的研究进展
兰 宇,孙向东,赵冬梅*
(1.黑龙江东方学院食品与环境工程学部,黑龙江哈尔滨 150066;2.黑龙江省农业科学院农产品质量安全研究所,黑龙江哈尔滨 150086)
反胶束水合萃取技术在生物工程领域的研究进展
兰 宇1,孙向东2,赵冬梅1*
(1.黑龙江东方学院食品与环境工程学部,黑龙江哈尔滨 150066;2.黑龙江省农业科学院农产品质量安全研究所,黑龙江哈尔滨 150086)
介绍了反胶束的基本概念和反胶束萃取技术在国内外的最新研究动态,综述了反胶束水合萃取技术的反应机理及其在生物工程中的应用研究进展,并对其在生物领域的应用前景进行了展望。
反胶束;水合;生物工程
近年来,科学技术的快速发展和人们生活水平的提高,使得人们对环保的意识逐渐增强,而对新能源的开发利用及其在生物技术领域的应用扩展,促使水合物分离技术的应用研究受到国内外学者的高度重视,许多发达国家也将水合物的形成及分离技术视为具有很大发展前景的新兴技术,并将其作为主要进军领域。水合物技术对低温溶液特别有效,且水合形成消耗反胶束内部分自由水的同时可以减小反胶束大小,使得其中的酶活性产生变化。水合物技术对反萃取的进程还具有催化作用,一般会把它运用在反胶束体系中生物酶活性的控制以及萃取。反胶束萃取技术与碱提酸沉方法相比应用潜力更为广泛,具有萃取率高,溶剂可循环使用,反应条件温和,对人体无毒,经济,易于操作等优点。反胶团的庇护功能下形成一道屏障,避免蛋白质与有机溶液之间的接触反应,维持生物活性物质的固有活性,从而实现蛋白质的溶解和分离[1]。反胶束水合萃取技术即反胶束萃取技术与水合物生成技术相结合的一种分离技术,具有良好的发展空间,能够高效地控制和提取生物活性物质且易与反胶束溶液分离。
笔者介绍了反胶束萃取技术的基本概念及其在生物工程领域的应用进展,并对水合物技术在反胶束体系中的作用机理和应用进展进行了综述,展望其在未来的发展前景。
1 反胶束萃取技术的理论基础
1.1 反胶束的基本概念反胶束萃取技术作为一种新兴的物质分离技术,既适用于分离非极性体系中的极性化合物,也适用于酶的固定化,可广泛应用于生物活性物质的提取。
当表面活性剂与有机溶剂混合在一起,且其浓度相对于临界胶团的浓度较大时,有机相中便会自然地聚集在一起汇成纳米级聚集体即反胶束体系,且这种纳米聚集体具有透明、热力学稳定等特性,其中的极性头向内,非极性尾则向外,形成的亲水内核,谓之“水池”(图1),它可以增强溶解蛋白质以及氨基酸等极性物质的作用[2],同时酶也可以被固定在反胶束的“水池”中进行催化反应。而表面活性剂的分子层能够阻止极性物质接触有机溶剂,保持被提取物质的活性。
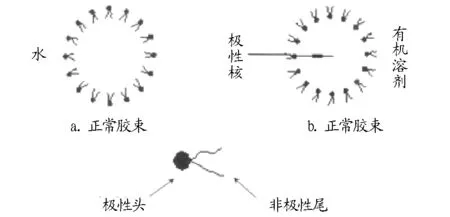
图1 正常胶束与反胶束示意
反胶束体系的性质常用参数W0表示,W0表示含水量(mol/L)与表面活性剂的量(mol/L)的比值,如式(1)所示,一般W0越大,有机相形成反胶束微粒的直径越大。W0是反映反胶束中含水量多少的一个重要参数,在可形成反胶束的浓度范围内,随着W0增加,更多的水与表面活性剂形成结合水从而提升萃取率。阳离子型以及非离子型,这两者表面活性剂所形成的反胶束溶液的增溶水量都比阴离子型的小,而非离子型的则比两性离子型的增溶水量小[3]。
W0=
(1)
1.2 反胶束的萃取原理及特点极性物质渗入反胶束溶液的过程是由多种作用相互协助产生的,即在宏观两相界面之间的表面活性剂层,和相邻的极性物质分子产生静电引力,导致形变,从而界面之间产生拥有这个极性物质的反胶束,继而分散到有机相中,以此达到极性物质的萃取(图2a)。这一过程称为前萃取;通过改变条件使极性物质从反胶束转移到水相中,从而分离出此物质,即为后萃取(图2b)。
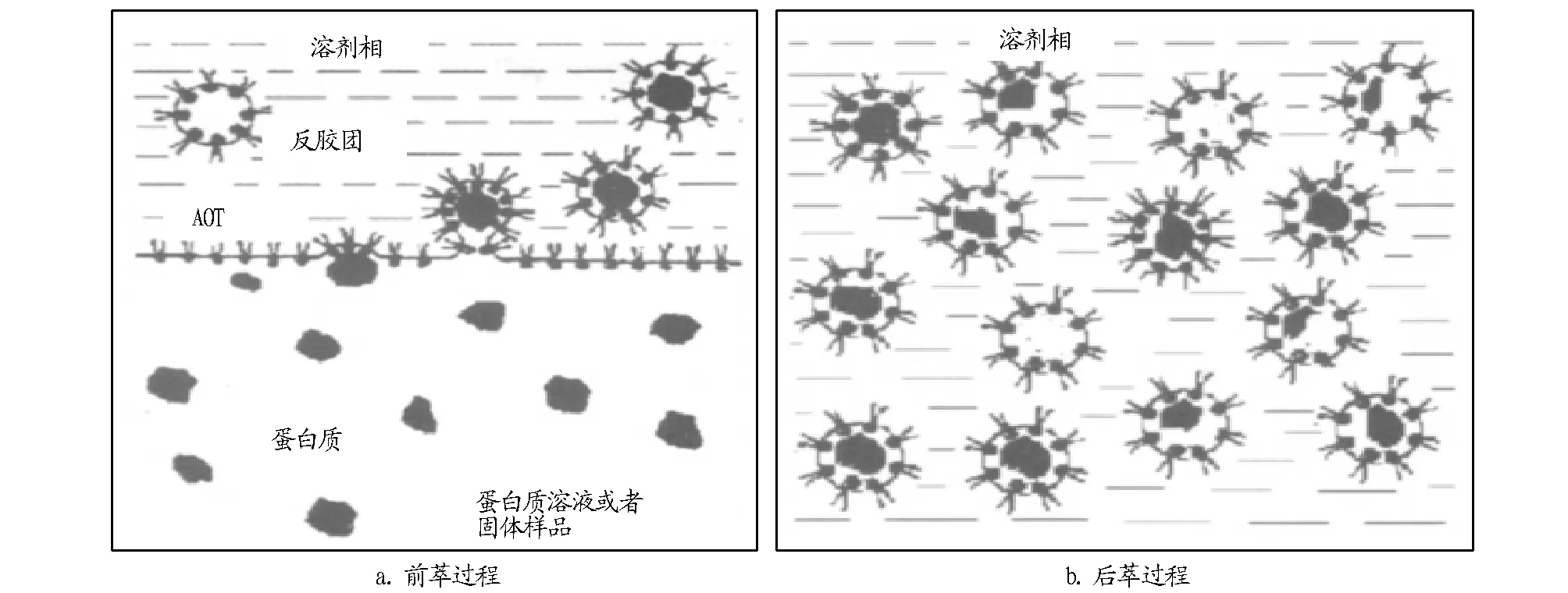
图2 反胶束法萃取蛋白质过程示意
反胶束“水池”增溶蛋白质等极性物质的驱动力,主要包括疏水力、二硫键作用力、离子作用力、静电作用力以及羟基间的相互作用力等,这些作用力都可能使极性物质的结构产生变化,从而对萃取率产生重要影响。所以,任何能够影响这些应用的因素,都会改变蛋白质的萃取效果。而这些影响因素主要有反胶束的尺寸、表面活性剂的种类、pH、离子浓度、蛋白质电荷量及有增容水量等[4-7]。
2 反胶萃取技术在生物工程领域的应用
2.1 反胶束萃取蛋白质
2.1.1蛋白质混合物分离。蛋白质的分子质量较为接近,可根据等电点不同或另外等原因所导致溶解度之间存在差异,采用反胶束溶液对其进行选择性的提取。
Aires-Barros等[8]采用AOT/异辛烷反胶束体系从黏稠色杆菌中分离纯化出2种不同等电点的脂酶——脂酶A和脂酶B,脂酶A的分子质量是1.2×105Da,等电点为3.7,脂酶B的分子质量是3×104Da,等电点为7.3。萃取率分别达到86%和75%。从研究的成效可以看出,反胶束法运用在分子质量接近的蛋白质分离中有较好的应用前景。
2.1.2蛋白质和油脂同时分离。油脂工业通常采用先浸油再分离蛋白的工艺分别提取植物油和蛋白,而利用反胶束法可同时分离油脂和蛋白质。李飞等[9]采用AOT/异辛烷反胶束体系同时提取玉米胚芽油脂和蛋白质,通过单因素试验,研究了前萃取和后萃取过程中的主要因素对油脂和蛋白质提取率的影响,得到了最佳萃取工艺条件。通过反胶束法、浸出法、水酶法3种方法得到玉米胚芽蛋白,并对其同时所得油脂的性质进行分析对比,结果表明,以反胶束法萃取的油脂最优。碱提酸沉法(16.63%)和水酶法(22.01%)的蛋白质提取率略低于反胶束法(28.23%),而纯度方面反胶束法提取的蛋白质纯度(96.21%)较碱提酸沉法(72.97%)和水酶法(12.94%)优势更加明显。
2.1.3发酵液中酶分离和提纯。从发酵液中分离和提纯酶一直是生物工程领域研究重点之一,国外学者已利用反胶束技术成功地从发酵液中分离出某些高纯度酶。Cocotle-Ronzon等[10]利用CTAB/异辛烷反胶束溶液从木糖醇菌株——热带假丝酵母菌IEC5-ITV中分离纯化出木糖还原酶,得到8.1倍的纯化因子,回收率达到100%。研究结果为深入研究其稳定性及动态变化奠定了良好的基础。
2.2 氨基酸及维生素等功能性添加剂萃取将反胶束技术运用在氨基酸等添加剂的萃取方面具有很大的应用潜力,其中氨基酸等添加剂通过带电离子的方式被提取。相同种类的氨基酸在电离形式不同的情况下,所被萃取的实际值之间同样存在差距,而结构上具有差异的氨基酸在反胶束中分布的位置也截然不同。因此,根据氨基酸和反胶束作用之间的差异,来筛选出所需氨基酸。
王运东等[11]使用Pluronic型和R型2种Pluronic嵌段聚合物(由德国巴斯夫公司生产的),利用聚合物反胶团萃取氨基酸(L-苯丙氨酸和L- 异亮氨酸),结果显示,通过对比它与有机溶剂的物理萃取氨基酸的平衡时间,发现两者之间相差甚小,而溶质处于反胶团表层的平衡分配系数K值一般较高,在它的水池内也是如此,在氨基酸水溶液的pH处于等电点附近时会使萃取率最大化。依此判断,聚合物反胶团在萃取两亲性质的氨基酸的过程中,增溶作用的关键在其表层位置,涵盖在聚氧丙烯的外壳或者环绕聚氧丙烯链间的可能性较大。而亲油性以及氢键则为其萃取注入关键促进力。
2.3 抗生素萃取工业上采用液-液萃取法生产抗生素已经非常普遍。最近研究指出,反胶束溶液不仅可用于萃取以及分离抗生素,且在糖肽类抗生素的应用上发展潜力较大。Mohd-Setapar等[12]研究发现青霉素G与AOT相互作用时可作为一种界面活性复合物质,能有效提高提取效率。同时指出青霉素G的浓度、pH、表面活性剂浓度、水相中盐的种类和浓度等因素对反应起着重要作用。Hu等[13]利用AOT/异辛烷反胶束体系从丙烯酰胺中同时提取出新霉素和庆大霉素,并对影响因素进行了系统研究,得出最佳萃取条件,萃取后产品纯度高达90%以上。
2.4 核酸萃取反胶束溶液的运用不仅能够解决核酸较难溶于有机相中的问题,还使得核酸能够维持其原有的结构特征,这些特点为反胶束法能够成功从部分噬菌体或者染色质中萃取出核酸发挥了重要作用。Goto等[14]成功采用CTAB/异辛烷反胶束溶液从鲑鱼睾丸中提取DNA,结果表明,萃取的驱动力是阳离子表面活性剂和带负电荷的DNA之间产生的静电作用及表面活性剂的疏水性,指出表面活性剂浓度、萃取时间、pH、盐浓度在DNA萃取过程中发挥重要作用,结果证明反胶束不仅可以萃取大量的蛋白质,且可以有效分离出DNA。
2.5 多糖类物质萃取对于一些分子量很大的物质(>10kDa),由于其分子半径大,不易被萃取进反胶束内核,采用反胶束体系萃取多糖类等高分子量物质的研究较少,有关学者尚在进行探索性研究。曹学军等运用AOT/正庚烷,研究了茶多糖大分子物质的萃取以及反萃取过程中的主要影响因素,使萃取条件得到了明显改善。研究表明,将多糖萃取到反胶束的同时使反萃取率提升至2倍以上,使反胶束技术能够萃取大分子物质成为了可能[15]。
3 反胶束水合萃取
3.1 反胶束水合萃取机理水合物即为气-液的非均相中反应阶段结晶的产物,之后在液相中析出[16],反应如式(2)所示:
M(g)+nwH2O(l)→M·nwH2O(s)
(2)
反胶束水合萃取机理是水合物的生成调节了反胶束中含水量,然后在水池里形成核,这个过程也使束内的一些自由水发生变化,即在反胶束内的水合物晶体的浓度比有机溶剂高的条件下,由于反胶束在体系中反应的过程,会一直出现分离和重新结合的现象,此时水合物的晶核和晶体便会流出,而部分自由水也就是以晶体的状态转移出的,伴随晶体沉降这一进程的持续进行,束内水量持续减少,从而使得含水量以产生水合物的形式实现了调节[17]。利用静电或疏水作用,部分极性物质在水池里也可实现增溶,同时与水合物的形成过程同步,析出于反胶束中,使萃取更为显著,这种现象即是界面控制,且其主要影响因素有水相盐度、酸度以及压力等。
3.2 反胶束水合萃取技术的应用Nguyen等[18]研究了在热力学条件下笼形水合物在反胶束中生成过程,及在生成过程中的主要影响因素为水与表面活性剂摩尔比W0,研究表明W0在10~15时萃取出的酶活性最高,探讨了反胶束水合萃取的调节机理和氨基酸的提取机理即水合物形成使反胶束的尺寸发生改变,从而调节了反胶束中水池含水量,增溶氨基酸的能力也随之受到影响;Noritomi等[19]采用AOT/异辛烷—丙烷,CFM,TFE体系从牛胰腺中水合萃取细胞色素C和核糖核酸酶A,萃取率高达80%。该研究不需要考虑pH和离子强度的变化,且因TFE的添加,使萃取出细胞色素C可以恢复其固有活性;丁皓等[20]采用CTAB/正辛烷-正戊醇反胶束体系萃取螺旋藻中的藻蓝蛋白,对萃取效果及纯化效果进行了研究,并分析了水合萃取的温度、压力、CTAB浓度、含水量W0等因素对反胶束水合萃取藻蓝蛋白的作用,确定了最佳工艺参数,即初始条件为3 ℃、4 MPa、CTAB浓度0.10 mol/L、W040%时,藻蓝蛋白的萃取效果最佳,萃取率提至81.3%。这为进一步开展反胶束水合萃取技术的研究及水合物法保护生物物质活性提供了有益的参考。
4 展望
新兴的反胶束水合萃取工艺,拓宽了生物分离技术的发展领域,并取得了明显的成就。水合物的形成是萃取过程中控制和提取束内生物活性物质的关键。通过将反胶束技术和水合物技术有机地结合,不仅可以避免蛋白质等极性物质变性问题,且反胶束溶液可反复利用,萃取过程可连续操作、处理量大,试剂无毒,对人体没有伤害,耗费成本低,在工业化生产方面显示了很大的应用潜力。尽管这一技术目前仍处于探索性研究开发阶段,无论在机理还是应用方面均需要深入研究,如反胶束水合萃取的热力学和动力学基础研究尚不够深入细致,萃取后的生物活性物质结构变化及其对功能性影响还不明确等,但从长远来看,反胶束水和萃取技术在生物工程领域潜力巨大,虽然还有许多实际问题需要解决,但应用前景广阔。
[1] 王永涛,赵国群,张桂.反胶束萃取技术及其在食品中的应用[J].食品研究与开发,2008,29(7):171-173.
[2] 杨颖莹,陈复生,布冠好,等.反胶束萃取技术及其在食品科学中应用[J].粮食与油脂,2012(1):1-3.
[3] 郭晓歌,赵俊廷.不同反胶束体系增溶水的比较[J].精细石油化工进展,2008,9(2):22-24.
[4] 高艳秀,陈复生,郭珍,等.不同反胶束体系超声提取花生蛋白的研究[J].食品工业,2013,34(5):46-50.
[5] 刘海远,陈复生,布冠好,等.反胶束技术及其萃取蛋白质的研究进展[J].农产品加工,2010,(11):231-233.
[6] 郭 珍,陈复生,高艳秀,等.反胶束后萃蛋白质研究进展[J].食品与机械,2012,28(5):231-233.
[7] 赵晓燕,薛文通,陈复生,等.影响反胶束体系萃取蛋白能力的因素及机理[J].农业工程学报,2009,25(11):354-360.
[8] AIRES-BARROS M R,CABRAL J M S.Selective separation and purification of two lipases from chromobacterium viscosum using AOT reversed micelles[J].Biotechnology and Bioengineering,1991,38:1302-1307.
[9] 李飞,朱科学,周惠明,等.反胶束法同时提取玉米胚芽中蛋白质和油脂的前萃工艺研究[J].中国油脂,2009,34(11):27-30.
[10] COCOTLE-RONZON Y,ZENDEJAS-ZALDO M,CASTILLO-LOZANO M L,et al.Preliminary characterization of xylose reductase partially purified by reversed micelles from candida tropicalis IEC5-ITV,an indigenous xylitol-producing strain[J].Advances in Chemical Engineering and Science,2012,2:9-14.
[11] 王运东,施长云,CAN Q,等.聚合物反胶团萃取氨基酸的研究[J].粮食与油脂,2002,34(5):75-79.
[12] MOHD-SETAPAR S H,WAKEMAN R J,TARLETON E S.Penicillin G solubilisation into AOT reverse micelles[J].Chemical Engineering Research and Design,2009,87:833-842.
[13] HU Z,GULARI E.Extraction of aminoglycoside antibiotics with reverse micelles[J].J Chem Tech Biotechnol,1996,65:45-48.
[14] GOTO M,ONO T,HORIUCHI A,et al.Extraction of DNA by Reversed Micelles[J].Journal of Chemical Engineering of Japan,1999,32(1):123-125.
[15] 李松丽.反胶束技术萃取茶多糖[D].广州:华南理工大学,2012:1-55.
[16] 董树杰.氨基酸的反胶束水合萃取研究[D].杭州:浙江工业大学,2007:1-67.
[17] 贺亚.水合物在反胶束体系中的生成特性及反胶束含水量的影响机制,2005:1-62.
[18] NGUYEN H,PHILLIPS J B,JOHN V J.Clathrate Hydrate Formation in Reversed Micellar Solutions[J].The Journal of Physical Chemistry,1989,93(25):8123-8126.
[19] NORITOMI H,HIDAKA Y,KATO S,et al.Recovery of protein from reverse micelles through gas hydrate formation[J].Biotechnology Techniques,1999,13:181-183.
[20] 丁皓,裘俊红.反胶束水合萃取藻蓝蛋白研究[J].浙江工业大学学报,2011,39(4):372-375.
Research Advances of Hydrated Reverse Micelles Extraction Technology in Bioengineering
LAN Yu1, SUN Xiang-dong2, ZHAO Dong-mei1*
(1.Food and Environmental Engineering Department of Oriental Institute, Harbin, Heilongjiang 150066; 2.Institute of Agricultural Products Quality and Safety, Heilongjiang Academy of Agricultural Sciences, Harbin, Heilongjiang 150086)
The latest research developments at home and abroad on reverse micelles extraction technology was introduced in this paper, the reaction mechanism of hydrated reverse micelles extraction technology and application progress on bioengineering were reviewed.In addition, the application prospect of this technology in bioengineering was forecasted.
Reverse micelles; Hydration; Bioengineering
哈尔滨市优秀学科带头人基金项目(2013RFXYJ049);中国博士后基金项目(2013M531008)。
兰宇(1990- ),女,黑龙江五常人,硕士研究生,研究方向:食品质量与安全。*通讯作者,副教授,硕士生导师,博士,从事食品质量与安全方面的研究。
2015-02-02
S 188
A
0517-6611(2015)08-004-03

