多西紫杉醇联合顺铂与多西紫杉醇联合奈达铂治疗中晚期乳腺癌的临床对比研究
周 雍,胡 俊,王东升
(南京市红十字医院,南京 210001)
多西紫杉醇联合顺铂与多西紫杉醇联合奈达铂治疗中晚期乳腺癌的临床对比研究
周 雍,胡 俊,王东升
(南京市红十字医院,南京 210001)
目的:探讨多西紫杉醇联合顺铂与多西紫杉醇联合奈达铂治疗中晚期乳腺癌的疗效和不良反应。 方法:64例中晚期乳腺癌患者随机分为多西紫杉醇联合顺铂化疗组(TP组,32例)和多西紫杉醇联合奈达铂化疗组(TN组,32例),观察两组的近期和远期疗效以及不良反应。 结果:多西紫杉醇联合顺铂与多西紫杉醇联合奈达铂化疗组的近期有效率分别为 96.9%和93.75%(P>0.05)。TP组的3年生存率(70.97%)、局部复发率(15.63%)和远处转移率(6.25%)与TN组(分别为65.63%、16.13% 和6.45%)相比,差异均无统计学意义(P>0.05)。TP组的胃肠毒性和肾毒性发生率高于TN组(P<0.05),而TN组的血小板减少发生率高于TP组(P<0.05)。 结论:TP化疗与TN化疗均能明显提高中晚期乳腺癌患者的近期和远期疗效,并降低局部复发率和远处转移率。不良反应可以耐受。
乳腺肿瘤,化疗,顺铂,奈达铂,多西紫杉醇
乳腺癌是全球妇女恶性肿瘤发病率第二位的恶性肿瘤,无论是手术治疗还是化疗均能取得较好的疗效。乳腺癌化疗应用较广,对不同分期的乳腺癌均可进行化疗,尤其是中晚期患者。近年来,随着多种抗肿瘤药物的更新,多种联合化疗在乳腺癌的治疗中均显示出较好的疗效。本院于2010年7月—2013年7月对64例中晚期乳腺癌患者进行多西紫杉醇联合顺铂与多西紫杉醇联合奈达铂的临床对比研究,观察疗效和不良反应,现报道如下。
1 资料与方法
1.1 临床资料 研究对象为 2010年7月—2013年7月在本院接受治疗的中晚期浸润性乳腺癌患者64例,年龄均小于70岁;治疗前血常规,心、肝、肾功能等均基本正常,并无其他内科疾病;本次属首次化疗。所有病例均经病理活检确诊,临床分期按照美国癌症联合会(American Joint Committee On Cancer,AJCC)分期标准。将64例患者按住院号奇偶性随机分为多西紫杉醇联合顺铂化疗组(TP组,32例)和多西紫杉醇联合奈达铂化疗组(TN组,32例)。两组患者的一般资料见表1,各项指标具有可比性。
1.2 联合化疗 化疗前1日、第1日化疗之前0.5h、第2日化疗之前0.5 h,均先口服地塞米松8 mg;化疗第1日,两组均予多西紫杉醇75 mg/m2静脉滴注;化疗第2日,TP组予顺铂50~100 mg/m2,TN组予奈达铂80~100 mg/m2静脉滴注;化疗第21日开始第二周期,均持续4~6个周期。化疗期间,每周复查血常规,定期复查肝肾功能,必要时给予升高白细胞、止吐、保肝、护肾等对症处理。
表1 两组患者的临床病理特征
1.3 疗效观察 两组患者在化疗之前和化疗结束3~7 d内均查血常规、肝肾功能,化疗结束后1个月查乳腺癌标志物(CA153)和血清癌胚抗原(CEA),治疗前和治疗结束后1个月查胸部CT。治疗结束后,门诊定期随访复查。
1.4 疗效评价 近期疗效评价按照WHO实体瘤疗效评价标准,分为完全缓解、部分缓解、疾病稳定和疾病进展;完全缓解加部分缓解为有效。化疗结束后3个月时复查,评价近期疗效。同时对患者进行随访,评价远期疗效,计算局部复发率、远处转移率和3年生存率。
1.5 不良反应 按照WHO不良事件分级标准评价不良反应。
1.6 统计学处理 应用SPSS 13.0软件进行数据处理,计数资料的比较采用χ2检验,计量资料的比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 近期疗效 化疗结束3个月时,TP组和TN组的有效率分别为96.9%和93.75%,差异无统计学意义(P>0.05),见表2。
2.2 远期疗效 化疗结束后随访3年,TN组失访1例。TP组和TN组的3年生存率分别为70.97%和65.63%,局部复发率分别为15.63%和16.13%,远处转移率分别为6.25%和6.45%,各项指标两组差异均无统计学意义(P>0.05),见表3。

表2 两组患者的近期疗效情况比较 例(%)
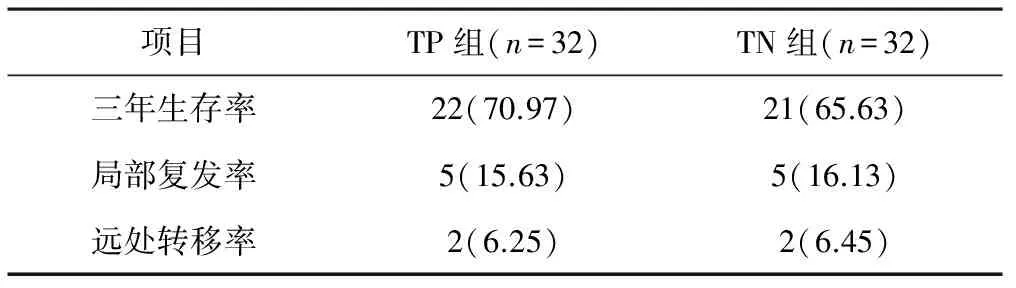
表3 两组患者远期疗效情况比较 例(%)
2.3 不良反应 两组的不良反应主要是骨髓抑制,其中TP组主要表现为白细胞计数下降,TN组主要表现为白细胞计数下降和血小板减少;两组的白细胞计数下降发生率差异无统计学意义(P>0.05),血小板减少发生率差异有统计学意义(P<0.05)。TP组的胃肠不良反应和肾功能损害发生率明显高于TN组,差异均有统计学意义(P<0.05)。两组均未见明显的肝功能损害。所有不良反应经对症处理后均能好转,耐受良好。两组患者的不良反应见表4。
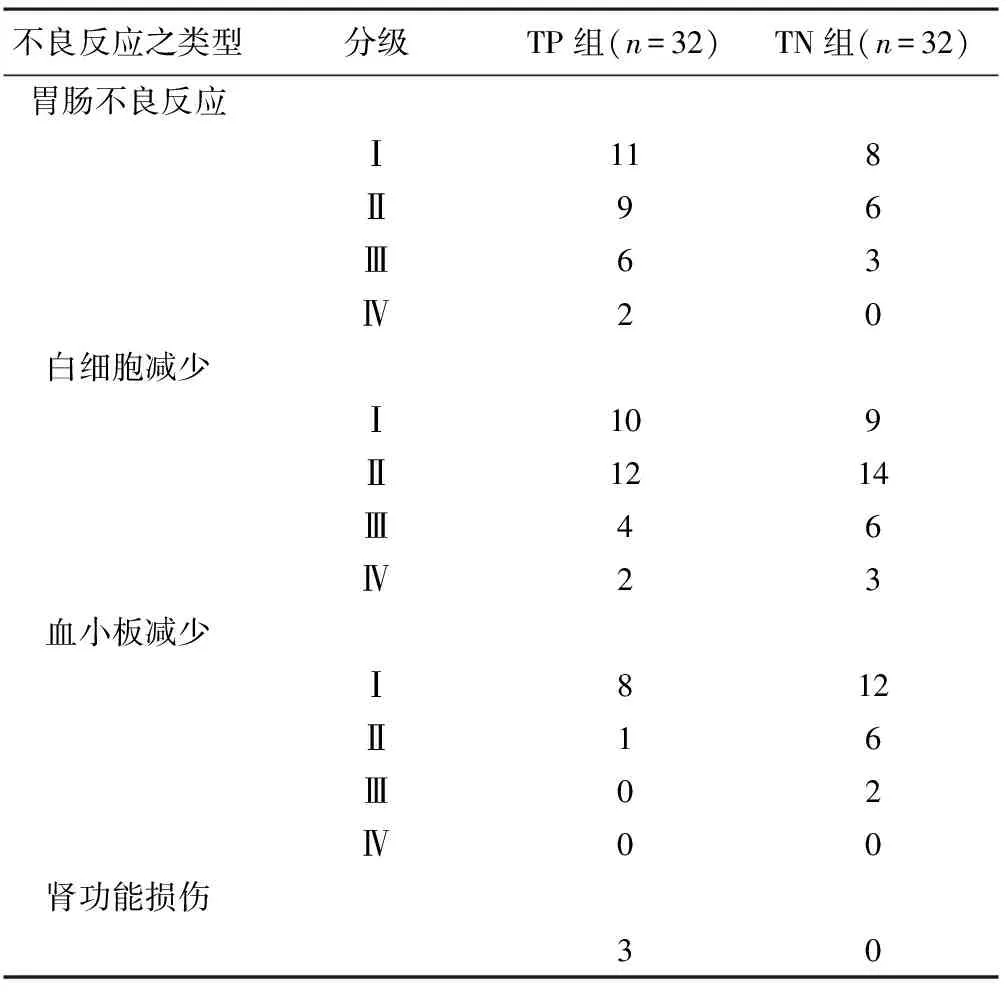
表4 两组患者不良反应发生情况比较 例(%)
3 讨论
中晚期乳腺癌患者的首选治疗手段是化疗,其次根据化疗后的具体情况考虑进一步手术,但Ⅱ期和Ⅲ期患者的5年生存率仍波动于60%~80% 和50%~60%之间,导致治疗失败的主要原因是肿瘤的局部未控和复发,其次为远处转移[1]。多西紫杉醇是一种可以特异性作用于细胞周期的半合成的二萜类化合物,通过抑制微管蛋白活性和诱导肿瘤细胞凋亡[2],干扰丝裂原活化的蛋白激酶信号转导通路[3],干扰抗凋亡因子的表达[4],抑制肿瘤微血管形成[5]等机制发挥抗癌作用。值得强调的是多西紫杉醇抑制微管蛋白活性的作用比紫杉醇高出2倍,因此对肿瘤细胞具有更强的杀伤力[6];两种紫杉类药物相比,多西紫杉醇具有更高的疗效[7,8]。目前,联合化疗治疗恶性肿瘤,尤其中晚期恶性肿瘤已成为不争的事实。2010年,美国综合癌症网指出联合化疗能够提高高危乳腺癌患者的生存率,联合顺铂化疗治疗恶性肿瘤的疗效确切而稳定。奈达铂是日本研发的一种铂类衍生物[9],经临床研究证实,奈达铂与其他化疗药物联合应用,可显著提高疗效[10,11]。
本研究中,TP组的近期有效率达 96.9%,3年生存率、局部复发率和远处转移率分别为70.97%、15.63%和6.25%;TN组的近期有效率达93.75%,3年生存率、局部复发率和远处转移率分别为65.63%、16.13%和6.45%。两组比较,差异均无统计学意义(P>0.05)。本研究中,TP组的胃肠毒性和肾毒性发生率均高于TN组(P<0.05),而TN组的血小板减少发生率高于TP组(P<0.05)。两组的白细胞计数下降发生率差异无统计学意义(P>0.05)。
本研究结果显示,多西紫杉醇联合顺铂化疗与联合奈达铂化疗治疗中晚期乳腺癌均能够提高患者生存率、降低局部复发率和远处转移率。在不良反应方面,顺铂具有较强的胃肠毒性和肾毒性,而奈达铂的血小板毒性相对较强。今后需要扩大样本量,进一步确定最佳的乳腺癌化疗辅助支持治疗方案。
1 Bidoli P, Bajetta E, Stani C,etal. Ten-year suurvival with chemotherapy and radiotherapy in patients with squamous cell carcinoma of the esophagus[J].Cancer,2002,9(2):352-361
2 吴永娟,胡道珍,王敬忠,等.紫杉醇的抗肿瘤机制及研究进展[J].中国医药导报,2010,12(2):265-266
3 Okano J, Nagahara T, Matsumoto K,etal. The growth inhibition of liver cancer cells by paclitaxel and the involvement of extracellular signal-regulated kinase apoptosis[J]. Oncol Rep,2007,15(5):1195-1200
4 Leunen K, Cadron I, Van Gorp T,etal. Does paclitaxel-carboplatin chemotherapy in a dose-dense regimen enhance survival of BRCA-related ovarian cancer patients[J]. Int J Gynecol Cancer,2009,19(9):1501-1504
5 Herdeg C, Gohring-Frischholz K, Haase K K,etal. Catheter-based delivery of fluid paclitaxel for prevention of restenosis in native coronary artery lesions after stent implantation[J]. Circ Cardiovasc Interv,2009 Aug,2(4):294-301
6 Gligorov J, Lotz J P. Preclinical pharmacology of the taxanes: implications of the differences[J]. Oncologist, 2004,9 (s2):3-8
7 Khoo, K , Manzoor Zaidi, H, Srimuninnimit, V,etal. Gemcitabine and split-dose paclitaxel or docetaxel in metastatic breast cancer: a random ised phase II study[J]. Eur J Cancer,2006, 42 (12): 1797-1806
8 Lin Y C, Chang H K, Chen J ,etal. A phase II random ized study of two taxanes and cisplatin form etastatic breast cancer after anthracycline: a final analysis[J]. Jpn J Clin Oncol,2007, 37(1):23-29
9 Yamada H, Uchida N, Maekawa R,etal. Sequence dependent antitumor efficacy of combination chemotherapy with nedaplatin, a newly developed platinum, and palitaxel[J].Cancer Lett, 2001, 172(1): 17-25
10 成美英,偰燕燕.替吉奥联合奈达铂治疗晚期食管癌近期疗效观察[J].齐齐哈尔医学院学报,2013(2):188-189
11 Shirai T, Hirose T, Noda M,etal. Phase II study of the combination of gemcitabine and nedaplatin for advanced non-small-cell lung cancer[J]. Lung Cancer, 2006, 52(2): 181-187
启 事
凡作者投稿,请将电子文件传至我编辑部电子邮箱:tjyaoxue@126.com,开据单位介绍信,注明个人联系方式(手机和地址),并通过邮局汇40元审稿费。
Comparison of clinical effects of docetaxel with cisplatin and with nedaplatin on advanced breast cancer
Zhou Yong, Hu Jun,Wang Dongsheng
Nanjing Red Cross Hospital, Nanjing 210001)
Objective: To investigate the curative and untoward effects of the combinations of docetaxeland cisplatin/nedaplatin in the treatment of middle-advanced breast cancer. Methods: Sixty-four patients with middle-advanced breast cancer were assigned randomly and evenly into two groups: TP group (docetaxel combined with cisplatin) and TN group (docetaxel combined with nedaplatin). The short- and long-term efficacy as well as the adverse reactions were observed. Results: The short-term response rates were 96.9% in TP group and 93.75% in TN group,respectively (P>0.05). Between these two groups, there were no statistically significant differencesin in the three-year survival (70.97%vs65.63%), local recurrence rate (15.63%vs16.13%) and distant metastasis rate (6.25%vs6.45%)(P>0.05). The incidence of gastrointestinal toxicity and renal dysfunction in the TP group were higher than that in the TN group (P<0.05), while the incidence of thrombopenia was lower in the TP group (P<0.05). Conclusion: Concurrent chemotherapy with docetaxel combined with cisplatin/ nedaplatin can improve both the short term and long term efficacy of treatment in middle-advanced breast cancer and reduce the local recurrence and distant metastasis as well. Adverse reactions of both treatment regimens were tolerable.
breast tumor,concurrent chemotherapy,cisplatin,nedaplatin,docetaxel
2015-07-29
R979.1
A
1006-5687(2015)05-0031-03

