红巧梅花色苷树脂静态纯化工艺研究
许小向,蒋 艳,洪艳平*,胡洁芳,
吴少福1,尹小莉2,王纯荣1
(1.江西农业大学食品科学与工程学院/江西省天然产物与功能食品重点实验室,江西南昌330045;2.江西农业大学图书馆,江西南昌330045)
红巧梅花色苷树脂静态纯化工艺研究
许小向1,蒋艳1,洪艳平1*,胡洁芳1,
吴少福1,尹小莉2,王纯荣1
(1.江西农业大学食品科学与工程学院/江西省天然产物与功能食品重点实验室,江西南昌330045;2.江西农业大学图书馆,江西南昌330045)
摘要:以红巧梅提取液为试验对象,通过考察树脂的静态吸附率和解吸率,从8种树脂中优选出DM-28为适合纯化红巧梅花色苷的树脂,并研究了DM-28纯化红巧梅花色苷的工艺参数。结果表明,DM-28静态纯化红巧梅花色苷的工艺参数为:在吸附温度为50 ℃,最适吸附pH 2.8,吸附时间6 h的条件下进行吸附,在40 ℃条件下以体积分数为90% pH 5.0乙醇溶液解吸效果最好。纯化后红巧梅花色苷色价为纯化前的4.84倍。
关键词:红巧梅;花色苷;树脂纯化
红巧梅(GlobeAmaranth),俗称妃子红茶,因其具有调节内分泌、解郁降火、补血、健脾胃、消炎、祛斑等功能活性,特别是对内分泌紊乱引起的黄褐斑、雀斑、肝斑、色斑、暗疮有明显疗效[1],因此,红巧梅常作为人们的一种日常养生保健饮用花茶。
花色苷是由花青素与糖以糖苷键结合而成的一类多酚类化合物,广泛存在于植物的根、茎、叶、花、果实等器官的细胞液中,在不同酸碱性环境下呈现出红色、蓝色或紫色等颜色,具有抗氧化[2]、抗炎症[3]、
抗肿瘤[4]、抗动脉粥样硬化[5]等生物活性,还具有延缓衰老、增强抵抗力、促进血液循环的保健功效[6-8]。近几年,因大孔树脂理化性质稳定、分离性能优良、使用方便、溶剂用量少等优点而被广泛地应用于天然植物活性成分的提取分离[9-11],利用大孔吸附树脂纯化天然植物花色苷多见于紫甘薯[12]、蓝莓果[13]、葡萄[14]等果蔬中。目前,对花色苷提取、纯化的研究有较多的文献报道,但关于红巧梅花色苷的研究未见报道。本试验以红巧梅为原料,通过测定花色苷提取得率,确定加热水提法提取红巧梅花色苷的提取工艺条件;再通过比较8种大孔树脂对红巧梅花色苷静态吸附与解吸效果,筛选出适合纯化红巧梅花色苷的树脂类型。以静态条件下的吸附率和解吸率为考察指标,通过单因素和正交试验,优化出大孔树脂 DM-28纯化红巧梅花色苷的工艺参数,试验结果可为进一步开发利用红巧梅提供一定的理论依据和实验参考。
1材料与方法
1.1试验材料
红巧梅:市场购买;实验药品:无水乙醇、氢氧化钠、盐酸、醋酸、醋酸钠均为分析纯;AB-8、DM-21、DM-28、DM-21、DM-2、DM-20、X-5、聚酰胺8种吸附树脂(山东鲁抗立科药业有限公司)。
1.2仪器
RE-52AA旋转蒸发仪,上海亚荣生化仪器厂生产;Q-350B3型高速粉碎机,上海冰都电器有限公司生产;FA2104V型电子天平,上海青浦仪器有限公司生产;V-5600型可见光分光光度计,上海元析仪器有限公司;TDL-5-A型低速大容量离心机,上海安亭科学仪器厂生产;ZD-A30普通型真空冷冻干燥机,上海安亭科学仪器厂生产;HZQ-2冷冻恒温振荡器,金坛市国旺实验仪器厂生产。
1.3试验方法
1.3.1红巧梅预处理将干燥的红巧梅置于Q-350B3型高速粉碎机中粉碎,密封待用。
1.3.2红巧梅花色苷含量测定(1)缓冲液的配制。醋酸-醋酸钠缓冲液:称取6.8 g醋酸钠定容500 mL,浓度为0.2 mol/mL;移取5.8 mL冰醋酸溶液定容500 mL,物质的量的浓度为0.2 mol/mL,按醋酸和醋酸钠不同体积比配置不同pH的醋酸-醋酸钠缓冲液。
(2)红巧梅花色苷最大吸收波长的确定。将一定量红巧梅花色苷提取液稀释,用醋酸-醋酸钠缓冲溶液调节pH至4.0,使其吸光值在一定范围内,并在400~700 nm波长范围内扫描,绘制吸收光谱曲线,确定红巧梅花色苷的最大吸收波长为530 nm,结果如图1。

图1 红巧梅花色苷光谱扫描图Fig.1 Spectrum scanogram of anthocyanins from Globe Amaranth
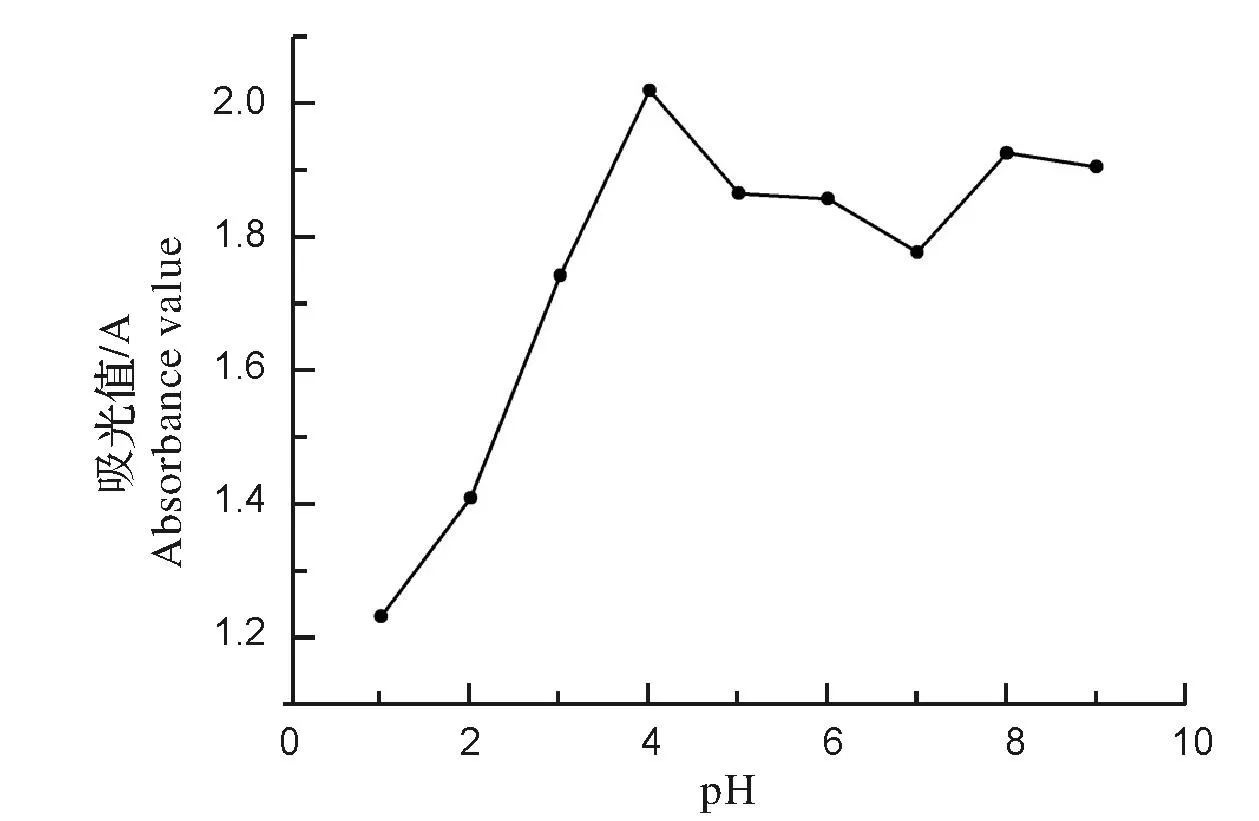
图2 不同pH红巧梅提取液的吸光值Fig.2 Absorbance of the extracts from Globe Amaranth in different pH
(3)花色苷提取得率的计算(以红巧梅干质量计)及水提工艺的确定。取3.0 g红巧梅粉末进行水提,将提取液用蒸馏水定容至250 mL,准确移取4 mL,加入不同pH醋酸钠-醋酸缓冲液,定容至10 mL,在波长530 nm处测定其吸光值(A),由图2可知,提取液在pH4.0时所测吸光值最大,因此,待测液在测定吸光值前将pH全部调至4.0后再测定,花色苷提取得率按下面公式计算:
花色苷提取得率(mg/g)=(A/εL)×Mw × Df × V/Mt
式中A为pH 4.0时花色苷的吸光值;Mw是矢车菊花素-3-葡萄糖苷的相对分子质量449.2;ε是矢车菊素-3-葡萄糖苷消光系数26 900;L为光程1 cm;Df为稀释因子;V为最终体积,mL;Mt为样品质量。
以红巧梅花色苷提取得率为指标,在考察pH、料液比、提取时间、提取温度4个单因素试验基础上,进行L9(34)正交设计试验,确定红巧梅花色苷最佳水提工艺为pH 5.0、料液比1∶30(W∶V)、提取时间30 min、提取温度50 ℃,以优化条件所得提取液用于树脂的纯化。
1.3.3树脂筛选(1)树脂预处理。将大孔树脂AB-8、DM-21、DM-28、DM-21D、DM-2、DM-20、X-5以体积分数为95%乙醇浸泡,不断搅拌,除去气泡后装入柱中。用3倍柱床体积(BV)95%乙醇洗脱,洗至洗脱液透明并在蒸干后无残渣(或极少残渣),然后用蒸馏水以相同流速清洗至无色无醇味。再依次用2倍BV 5% NaOH溶液浸泡后蒸馏水洗至pH为中性,2倍BV的4%盐酸浸泡并以蒸馏水洗脱至pH中性;聚酰胺按文献[15]方法处理;备用。
(2)静态吸附和解吸性能比较。分别称取活化处理的8种树脂0.5 g置于250 mL具塞锥形瓶中,加入pH 4.0吸光值0.438(A0)红巧梅花色苷粗提液50 mL,盖紧瓶塞。在摇床中放置24 h,吸取上清液测定其吸光值(A1)。将充分吸饱的树脂抽滤至干,各称取0.5 g置于250 mL具塞锥形瓶中,加入50 mL pH 4.0的80%乙醇溶液在摇床中解吸24 h,吸取上清液测定其吸光值(A2),按下列公式计算各树脂的静态吸附率和解吸率。

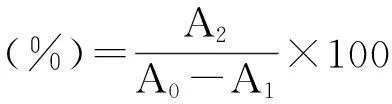
1.3.4DM-28树脂静态吸附单因素和正交试验准确称取活化处理的DM-28树脂0.5g于250mL具塞三角瓶中,加入吸光值相同的花色苷提取液50mL,在摇床中放置一定时间,取上清液测定吸光值。以吸附率为指标,分别考察吸附时间、溶液pH和温度对大孔树脂吸附效果的影响。在单因素试验基础上进行L9(34)正交试验,优选出DM-28吸附红巧梅花色苷的工艺条件,因素水平见表1。
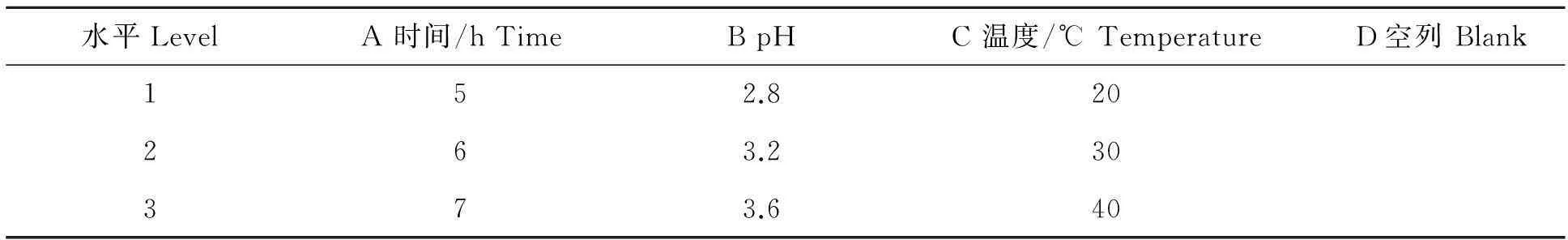
表1 红巧梅花色苷吸附正交试验因素水平表
1.3.5DM-28树脂静态解吸称取0.5 g按优化条件吸附饱和的DM-28树脂于250 mL具塞三角瓶中,加入相同体积的乙醇溶液在摇床中震荡24 h后取上清液测定吸光值。通过解吸率考察乙醇溶液pH值、解吸温度、乙醇浓度对吸附于DM-28树脂上花色苷解吸的影响。


2结果与分析
2.1八种树脂的吸附与解吸性能比较
由表2可知,8种大孔树脂对红巧梅花色苷均有一定的吸附性能,其中DM-28型、DM-21型相对其他树脂来说,其吸附率都比较高,但结合解析率,DM-28型大孔树脂对红巧梅花色苷的解析率高于DM-21型,故选择DM-28为本试验的最佳树脂。

表2 八种树脂对红巧梅花色苷静态吸附和解吸特性
2.2树脂静态吸附单因素和正交试验结果
2.2.1吸附时间、pH值、吸附温度对DM-28树脂吸附率的影响由图3(a)可知,随时间的延长红巧梅花色苷吸附率不断增大,在6 h后吸附率基本不变,由此可知大孔树脂已基本达到吸附饱和状态,故选择6 h为较适合的吸附时间;溶液的pH值对花色苷共轭结构影响极大,因而影响其对光的吸收而使花色苷在可见光下呈现出不同的色泽。戴余军等[9]在研究大孔树脂对黑胡萝卜花色苷纯化工艺时,指出花色苷类物质在酸性条件下较稳定,故本实验测定了在酸性条件下DM-28对红巧梅花色苷的吸附能力,结果如图3(b)所示,随着pH的增大,DM-28对红巧梅花色苷的吸附率呈先升后降的趋势。原因可能是由于溶液酸性的减弱,花色苷在溶液中存在的结构形式发生变化而引起花色苷极性变化,从而影响树脂对其的吸附力,并且由于结构改变使花色苷溶液在530 nm波长下的吸收受到影响。考虑到花色苷在酸性环境中具有较高的稳定性,确定溶液pH 3.2时为较佳吸附pH值;图3(c)结果表明,在一定温度范围内,温度的升高有利于树脂对花色苷的吸附,温度过高反而降低树脂对花色苷的吸附性能,原因可能存在于以下两个方面:其一,较高温度下花色苷分子的运动加剧,导致分子难以吸附在树脂表面,且温度的升高对花色苷有所破坏;第二,温度升高增大了溶液中花色苷的溶解度,从而导致树脂对花色苷的吸附效果下降。因此,在本试验的吸附过程中,在30 ℃吸附效果较好。
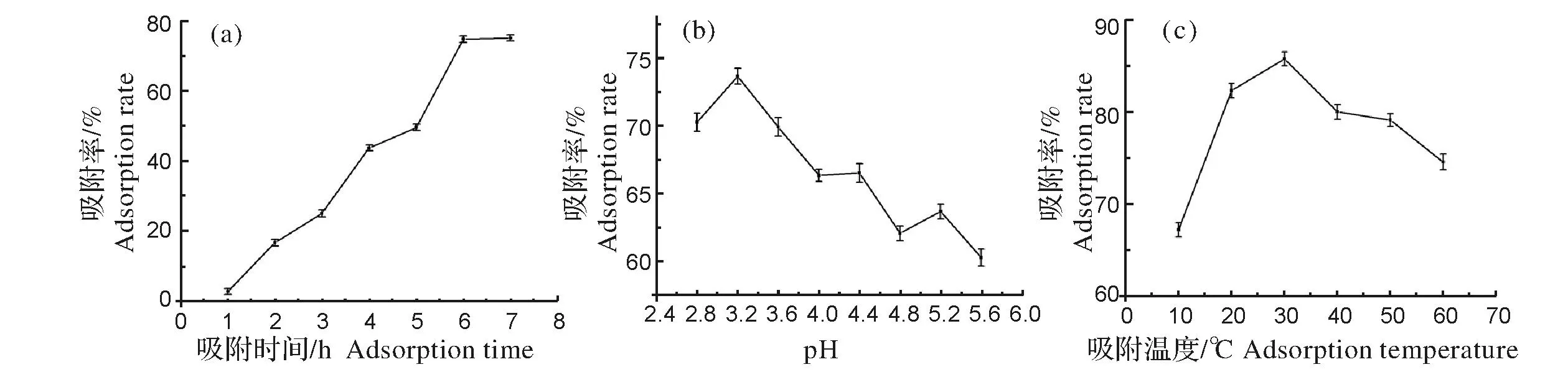
图3 吸附时间(a)、pH值(b)和吸附温度(c)对红巧梅花色苷吸附率的影响Fig.3 Effect of adsorption time(a),pH(b) and temperature(c) on adsorption rate of anthocyanins from Globe Amaranth
2.2.2红巧梅花色苷吸附正交试验结果由表3、表4、表5分析可知,各因素对树脂吸附效果影响的程度依次为温度>溶液pH>时间,且吸附温度对树脂吸附影响极显著,溶液pH影响显著,吸附时间影响不显著。综合极差分析、方差分析和多重比较分析结果可知,DM-28对红巧梅花色苷的最佳吸附条件为A3B1C2,但与正交试验中吸附率最高的第4组组合A2B1C2不同,因此,为了考察条件组合的可靠性,通过重复性试验进行验证,结果见表6。

表 3 正交试验设计与数据处理
(k1、k2、k3表示因素的每个水平的平均花色苷含量,极差R=同因素的k1、k2、k3中最大值-最小值)。
(k1,k2ork3shows the factors of each level of the average content of anthocyanins,Ris the same factor of the maximum and the minimum fromk1,k2,k3).

表 4 正交设计方差分析
P<0.01表示差异极显著;P<0.05表示差异显著。
P<0.01 shows extremely significant difference;P<0.05 shows significant differences.

表5 Duncan新复极差法多重比较结果
相同字母表示差异不显著,不同字母表示差异显著。
The same letter indicates no significant difference,different letters mean significant difference.
由表6可知,两种处理对大孔树脂吸附效果的影响差异不显著。综合考虑,确定最佳树脂吸附条件组合为A2B1C2,即:时间6 h,溶液pH2.8,温度30 ℃。

表 6 验证性试验结果
2.3树脂静态解吸试验结果
按最佳吸附条件吸附饱和的DM-28树脂在不同解吸温度、不同pH的乙醇溶液、不同乙醇浓度下的解吸结果如图4(a~c)所示,从图4(a)中解吸温度对红巧梅花色苷的解吸效果可知,在温度20~60 ℃内红巧梅花色苷的解吸率呈现先升后降的特征,相对较高的温度下,分子运动相对较快而有利于解吸;同时因天然色素稳定性不高,在温度过高的情况下解吸较长的时间则可能引起色素的分解,测试结果表明,在温度40 ℃时,红巧梅花色苷解吸率达到较高值,因此,选定解吸温度为40 ℃较适合。由图4(b)可知,在pH 2~7范围内,解吸液的吸光值先增大后减小,在pH 5.0时解吸率达到最大,这可能与红巧梅花色苷在酸性条件下以更为稳定的氧鎓盐结构有关[17],因此选择pH 5.0的乙醇溶液进行解吸较佳。图4(c)表明,随着乙醇溶度的增大,红巧梅花色苷解吸率总体呈上升的趋势,当乙醇体积分数为90%时,解吸率达到最大值,故以90%的乙醇溶液进行解吸较好。

图 4 解吸温度(a)、乙醇溶液pH(b)和乙醇浓度(c)对红巧梅花色苷解吸率的影响Fig.4 Effect of desorption temperature(a),ethanol solution pH(b) and ethanol concentration(c) on desorption rate of anthocyanins from Globe Amaranth
2.4红巧梅花色苷的色价测定
红巧梅花色苷经优选的静态树脂吸附和解吸条件纯化后,通过1.3.6所述方法测其色价,纯化后花色苷色价为纯化前的4.84倍,说明DM-28树脂对红巧梅花色苷的纯化效果较好。
3结论
按红巧梅花色苷优选水提工艺,提取所得红巧梅花色苷溶液用于树脂纯化,结合吸附率与解吸率,从8种大孔树脂中筛选出DM-28为纯化红巧梅花色苷较佳的大孔树脂类型。经单因素和正交试验优选出DM-28最佳静态吸附工艺为:吸附时间6 h,溶液pH 2.8,吸附温度30 ℃,在此条件下,吸附率达到86.26%;解吸液具有减弱被吸附物质与树脂之间吸附力的作用,解吸效果常受到解吸液浓度、解吸液pH及解吸温度等多种因素的影响,本试验得到红巧梅花色苷的解吸工艺参数为:解吸温度40 ℃、乙醇体积分数为90%、解吸pH5.0。经DM-28纯化后红巧梅花色苷色价为纯化前的4.84倍,结果表明DM-28型大孔树脂对分离纯化红巧梅花色苷具有较好的效果。
参考文献:
[1]耿丽晶,周围,陈博.蓝莓红巧梅花茶饮料加工工艺的研究[J].中国食物与营养,2011,17(4):57-59.
[2]刘国凌,郭红辉,尚彬.岗稔果皮花色苷体外抗氧化活性研究[J].食品工业,2014,35(1):203-206.
[3]王静,马养民,逯文静.蓝莓花青素的纯化及镇痛、抗炎药效学研究[J].食品工业科技,2013,34(5): 338-340.
[4]刘奕琳,王振宇.蓝靛果花色苷乙醇洗脱物抗癌活性的研究[J].食品工业科技,2012,33(19):159-161.
[5]林丽,李进,吕海英,等.黑果枸杞花色苷对小鼠动脉粥样硬化的影响[J].中国中药杂志,2012,37(10):1460-1466.
[6]Fournand D,Vicens A,Sidhoum L,et al.Accumulation and extract ability of grape skin tannins and anthocyanins at different advanced physiological stages[J].Journal of Agricultural and Food Chemistry,2006,54(19):7331-7338.
[7]Nayak C A,Srinivas P,Rastogi N K.Characterisation of anthocyanins fromGarciniaindicaChoisy[J].Food Chemistry,2010,118(3):719-724.
[8]田野,张会慧,王娟,等.遮荫对紫叶李幼苗叶片花色素苷含量和光合能量分配的影响[J].中南林业科技大学学报,2013,33(6):64-69.
[9]戴余军,潘国栋,张昭,等.大孔树脂对黑胡萝卜花色苷纯化工艺的研究[J].中国调味品,2013,38(4):114-118.
[10]杨武英,上官新晨,吴磊燕,等.大孔树脂精制芦荟叶黄酮的研究[J].江西农业大学学报,2010,32(1):169-174.
[11]李姣艳,杨武英,陈金印.H1020大孔树脂纯化芦荟蒽醌的工艺研究[J].江西农业大学学报,2009,31(6):1152-1155.
[12]孙健,岳瑞雪,钮福祥,等.紫甘薯花青素的大孔树脂动态吸附工艺优化[J].江苏农业科学,2013,41(6):227-229.
[13]李颖畅,郑凤娥,孟宪军.大孔树脂纯化蓝莓果中花色苷的研究[J].食品与生物技术学报,2009,28(4):496-500.
[14]李杨,韩业慧,李记明,等.葡萄皮花色苷的树脂纯化及稳定性研究[J].酿酒科技,2012,32(1):28-31.
[15]杨武英,上官新晨,徐明生,等.聚酰胺树脂精制青钱柳黄酮的研究[J].天然产物研究与开发,2008,20(2):320-324.
[16]吕晓玲,刘楠.黑胡萝卜花色苷精致工艺及其体外抗氧化性的研究[J].食品研究与开发,2008,29(12):75-77.
[17]王丰,明哲.红树莓果实花色苷提取工艺[J].江苏农业科学,2010,38(5):377-378.

郭熙,谢碧裕,叶英聪,等.基于一阶微分变换方法的南方丘陵稻田土壤电阻率高光谱特性研究[J].江西农业大学学报,2015,37(1):190-198.

饶丹,嘎利兵嘎,郭小权,等.HRM分析方法中不同扩增片段、染料和仪器的比较[J].江西农业大学学报,2015,37(1):169-175.
Purification of Anthocyanin fromGlobeAmaranthby
Macroporous Resin Static Adsorption
XU Xiao-xiang1,JIANG Yan1,HONG Yan-ping1*,HU Jie-fang1,
WU Shao-fu1,YIN Xiao-li2,WANG Chun-rong1
(1.Jiangxi Key Laboratory of Natural Products and Functional Food,College of Food Science and Engineering,JAU,Nanchang 330045,China;2.Library of JAU,Nanchang 330045,China)
Abstract:Through detecting the static adsorption and desorption rates of anthocyanins in the solution of Globe Amaranth,DM-28 was employed as the most favorable adsorption resin for anthocyanins from Globe Amaranth in the eight types of resins,and the resin purification conditions were explored.The result showed that the preferable adsorption and desorption parameters were adsorption at 50 ℃ and at pH 2.8 for 6 h and the desorption at 40 ℃with 90% ethanol solution at pH 5.0.The color value of the purified natural pigment was 4.84 times that of the origin sample.
Key words:Globe Amaranth;anthocyanin;resin purification
作者简介:许小向(1990—),女,硕士生,主要从事食品科学研究,E-mail:495540418@qq.com;*通信作者:洪艳平,副教授,E-mail:jxndspxy74@aliyun.com。
基金项目:国家科技支撑计划项目(2013BAD10B04-3)和赣鄱英才“555”工程领军人才培养计划
收稿日期:2014-06-20修回日期:2014-10-09
中图分类号:TS201.2
文献标志码:A
文章编号:1000-2286(2015)01-0163-06

