不同发育阶段视神经移植物对横断成年大鼠视神经再生修复的影响*
何家全 杨忠 蔡文琴
(1.川北医学院第二临床医学院·南充市中心医院神经外科, 四川 南充 637000; 2.第三军医大学基础部组织胚胎学教研室, 重庆 400038)
不同发育阶段视神经移植物对横断成年大鼠视神经再生修复的影响*
何家全1杨忠2蔡文琴2
(1.川北医学院第二临床医学院·南充市中心医院神经外科, 四川 南充 637000; 2.第三军医大学基础部组织胚胎学教研室, 重庆 400038)
目的 观察不同发育阶段大鼠视神经移植物对成年大鼠中枢神经损伤再生的影响。方法 将不同发育阶段的视神经移植到成年大鼠视神经的断端,并与其自身的坐骨神经移植物作对照,运用HE染色、镀银染色及神经示踪等方法观察不同发育阶段大鼠的视神经移植物对成年大鼠横断视神经修复的影响。结果 胚胎18天大鼠视神经移植物与坐骨神经移植物一样,在移植到成年大鼠视神经后20天,有大量的轴突穿过了移植区,经HRP伤侧眼球内注射顺行示踪显示,在视神经到达的靶区上丘出现了阳性标记的神经元,但这种现象在出生后大鼠视神经移植物的移植后从未见到,但如果移植物愈早,那么成年大鼠视神经近侧断端长出的纤维就愈多愈长。结论 在大鼠中枢神经系统成熟少突胶质细胞的膜上可能存在着抑制神经元突起生长的物质,这些物质可抑制损伤中枢神经系统神经纤维的再生延长及功能重建。
视神经; 移植; 中枢神经系统; 损伤再生
离体研究显示,成熟的少突胶质细胞具有抑制神经元突起生长的特性,那么在体的情况又如何呢?我们的研究发现,随着大鼠视神经不断发育成熟,视神经内成熟的少突胶质细胞的数量也不断增加。视神经为中枢神经。因此,我们在建立成年大鼠视神经横断损伤模型的基础上,通过将不同发育阶段的视神经移植到成年大鼠视神经的断端,并以其自身的坐骨神经移植作对照,运用形态学及神经示踪等方法,观测横断成年大鼠视神经的再生修复情况,从一个侧面探讨少突胶质细胞在自体情况下对损伤神经元轴突再生的影响。
1 材料与方法
1.1 实验材料
1.1.1 实验动物及分组 40只雄性成年Wistar大鼠,清洁2级,体重230~250克,平均分成10组,每组4只,分别用于E18、P0、P3、P5、P8、P15、P20、P90天大鼠视神经移植及坐骨神经移植和正常对照。每组用两只不同发育阶段的大鼠作为移植视神经的供体。
1.1.2 实验试剂 辣根过氧化物酶(HRP),为Sigma公司产品。
1.2 实验方法
1.2.1 成年大鼠一侧视神经横断移植模型的制作 本模型的制作采用Hausmann等[1]的方法进行,具体操作步骤如下:成年大鼠用0.5%戊巴比妥钠按40mg/kg腹腔内注射麻醉后固定于解剖板上,头皮剪毛后常规消毒铺巾,矢状位正中切开头皮。小心打开眶板,分离视神经。解剖显微镜下在球后约2mm处向后纵行切开视神经鞘,长约3mm,在鞘内将视神经横断,并剪切除约1~2mm长一段视神经,此步骤视移植物而定,如移植胚胎及发育早期的视神经时可只作切断,而不切除,因为切断的视神经有一定程度的收缩。将预先准备好的移植物纵行放置于视神经鞘内,断端互相接触。鞘切口处用小块明胶海绵覆盖,连续缝合头皮,清醒后自由喂养。对照组仅作视神经切断,止血后即缝合头皮。
1.2.2 移植物的准备 不同发育阶段的大鼠碘伏消毒后直接断头处死,在解剖显微镜下快速分离出视神经,并放入含0.6%葡萄糖的灭菌生理盐水中备用。成年(P90d)视神经移植物供体大鼠在断头取视神经前先于其双股后部消毒后切取坐骨神经。
1.2.3 顺行轴突追踪 成功模型动物用示踪剂HRP进行顺行示踪。具体步骤如下:动物存活18天后,用0.5%戊巴比妥钠麻醉,用微量进样器于移植侧眼球内注入HRP 10μl,HRP用2%的DSMO配制。留针5分钟后拔针,并用小纱布块压迫眼球30秒钟以防示踪剂渗漏,动物清醒后自由喂养。
1.2.4 取材固定及切片 注入示踪剂后48小时,常规麻醉,开胸,经左心室主动脉插管,剪开右心耳,首先灌入200ml肝素化的PBS,随后灌入250ml 1%多聚甲醛、2%戊二醛、0.1M PBS(pH7.4)。灌流后的大鼠在4℃冰箱中放置3~4小时后取出全脑及移植侧视神经,在相应固定液中固定6小时,再转入25%蔗糖、4%多聚甲醛中浸糖脱水,直至组织下沉至瓶底。行全脑冠状切片及视神经纵行恒冷冰冻切片,片厚为20μm,脑片切下后再入上述固定液中保存备用,而视神经切片则贴在预先包被APES的载玻片上,用于组织化学染色。
1.2.5 组织化学染色 HE染色及HRP示踪显色按常规进行。
1.2.6 视神经轴突镀银染色 采用易家农(1986)著《组织学与组织学技术》中介绍的方法。本染色结果新生轴突呈黑色,由于采用灌注躯血固定,背景清晰,对比鲜明。另外,不使用高价的硝酸铀而直接入氨银液,染色全过程只需40分钟左右即可完成,方法较简便。
2 结果
2.1 非移植对照大鼠横断视神经轴突的反应 在非移植对照组,解剖标本肉眼可见远侧断端(脑端)较近侧端(眼球端)明显变细;HE染色可见视神经断端钝园,为结缔组织所包绕(图1);镀银染色可见断端只有少量流产再生的轴突(图2);HRP示踪在整个脑组织内亦未见有HRP阳性标记的细胞。
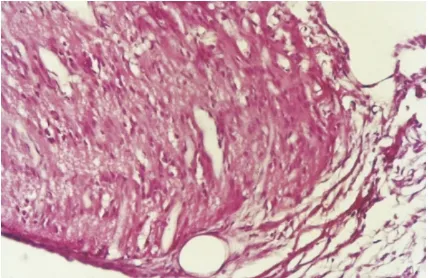
图1 HE染色非移植组,断端视神经被结缔组织包绕 ×200
Figure 1 The optic nerve surrounded by connective tissue on the broken stump in nonimplantation group (HE staining, ×200)
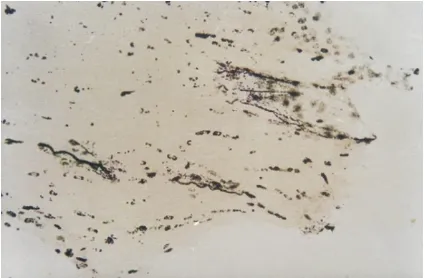
图2 镀银染色非移植组,视神经断端有少许再生轴突 ×200
Figure 2 The few regenerated axon on the broken stump in nonimplantation group (silver staining, ×200)
2.2 坐骨神经移植对照大鼠的反应 在坐骨神经移植组,无明显肉眼可见的两视神经断端直径的变化,HE染色在远近端横切面上无明显的不同;镀银染色可见两断端间有大量再生的无髓神经纤维(图3),HRP示踪可见在上丘部出现了阳性标记的神经元(图4)。
2.3 不同发育阶段视神经移植对横断视神经的影响 在本文视神经移植组大鼠均未发现肉眼可见的两断端视神经直径的改变。胎鼠视神经移植组可见两断端之间形成了瘢痕组织(图5),但瘢痕组织中可见较多新生无髓轴突通过(图6),HRP示踪亦可见在上丘部有较多阳性标记的神经元(图7、8);在P0天视神经移植组中,虽可见较多生长较长的新生无髓鞘轴突(图9),但HRP示踪始终未见脑区内有阳性标记的神经元;在P3天视神经移植组中,可见断端间新生的轴突较P0天明显减少,且其排列方向较杂乱(图10);到P15天视神经移植组,只见视神经断端有少许杂乱生长的轴突。P0天以后视神经移植组中,各脑区内均未见HRP阳性标记神经细胞。

图3 镀银染色坐骨神经移植组,断端可见大量再生轴突 ×200
Figure 3 The large regenerated axon on the broken stump in implantation group (silver staining, ×200)

图4 HRP示踪坐骨神经移植组,视神经靶区上丘出现了阳性标记神经元 ×400
Figure 4 The positive neuron with HRP tracing in implantation group (×400)

图5 HE染色胎鼠视神经移植组,断端视神经出现瘢痕组织 ×100
Figure 5 The scar tissue on broken stump of optic nerve in implantation group
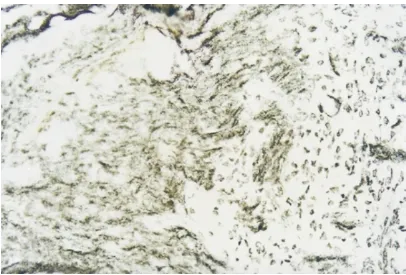
图6 镀银染色胎鼠视神经移植组,断端视神经间有大量再生的神经纤维通过 ×200
Figure 6 The regenerative nerve fibers at broken stump of optic nerve in implantation group

图7 HRP轴突示踪胎鼠视神经移植组,示踪剂到达靶区上丘 ×40
Figure 7 The tracer in superior colliculus in implantation group (×40)
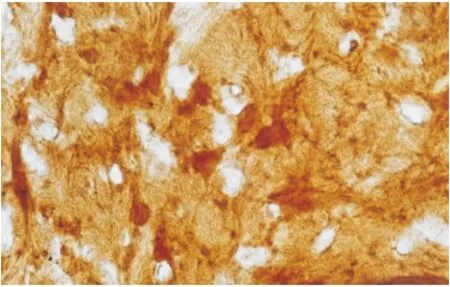
图8 HRP轴突示踪胎鼠视神经移植组,示踪剂到达靶区上丘×400
Figure 8 The tracer in superior colliculus in implantation group (×400)
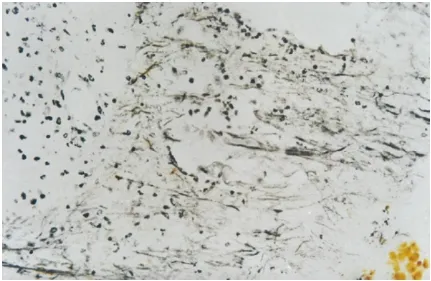
图9 镀银染色新生大鼠视神经移植组,断端视神经可见生长较长的神经纤维 ×200
Figure 9 The nerve fibers at broken stump of optic nerve of neonate rat

图10 镀银染色出生3天大鼠视神经移植组,断端视神经可见再生纤维明显减少 ×200
Figure 10 The nerve fibers at broken stump of optic nerve of rat 3 days after birth deceased
3 讨论
3.1 关于视神经损伤移植模型 视神经作为中枢神经系统纤维束因其纤维来源比较单一,结构也比较简单,它是由视网膜节细胞发出的轴突和属于中枢神经系统的神经胶质细胞组成,不含神经元,在活体上很容易进入,可行神经解剖追踪。另外,视神经还是唯一可以接受实验性处理而又不会直接影响中枢神经系统其它部分的中枢神经。自Vaughn等(1970)建立了视神经的横断损伤模型以来,由于其操作方便,对周围组织损伤小,视神经暴露较好,动物死亡极少,很快这一模型便被广泛应用于研究中枢神经系统的发育、变性与再生[2,3]。在本实验中成功运用这一模型,取得了良好的效果。
3.2 对本实验中所用检测方法的评价 在本实验中,我们采用了常规组织化学及HRP顺行轴突示踪来了解在不同移植条件下,横断成年大鼠视神经的变化情况。HE染色可以了解组织的大体形态及组织成分的相互毗邻关系;组织化学的方法是根据某些组织内所特有的化学物质(如某些酶类)在一定条件下所出现的呈色反应从而确定某种成份的存在。本实验所用的方法较好地显示了视神经断端新生的无髓神经纤维,这些纤维有人在脊髓中用电镜证实为再生的纤维[4]。用HRP顺行示踪,通过观察视神经到达靶区神经元的标记情况,间接地了解不同移植物对横断大鼠视神经轴突再生的影响。
3.3 不同移植物对横断成年大鼠视神经轴突再生的影响 本实验结果显示,横断成年大鼠的视神经在未接受外来移植物时其远端视神经出现萎缩变细,极少有新生的轴突。周围神经移植后,可见断端内有大量新生的神经纤维,HRP示踪在视神经的靶区上丘出现了阳性标记的神经细胞。胎鼠视神经移植,尽管在两断端间形成了瘢痕组织,但瘢痕组织中却有较多新生的神经纤维通过,这些纤维也使该组大鼠的上丘得到了阳性标记的神经细胞。不幸的是,出生后的视神经移植物虽然都能在一定程度上促进视神经轴突的生长,但始终未见有视神经靶区神经细胞的标记,只是在纤维生长数量与长度上,移植发育愈早的视神经,其断端新生的纤维数量愈多,长度愈长。这些结果说明,不同的移植物能影响成年大鼠横断视神经断端的生长情况。
3.4 不同移植物对横断视神经轴突生长影响的意义 先前的研究显示,成年动物的脑和脊髓在损伤后,其轴突不能再生以建立正常的连接。作为中枢神经系统的视神经,损伤后绝大部分轴突断裂的神经元会死亡,存活神经元也不能再生其轴突。然而后来大量研究显示,通过改变损伤区的组织环境,成年动物中枢神经系统损伤轴突的再生能力会大大增强,甚至重建功能[5]。其中周围神经移植物刺激中枢神经纤维的再生已得到了几乎所有实验研究一致的认同,本实验用其作为对照也不例外,并在视神经支配的靶区得到了阳性标记的神经细胞。本实验结果提示,发育早期的视神经具有较强的刺激中枢神经纤维再生的能力,而且发育视神经的这种能力随着视神经的不断发育成熟而逐渐丧失。我们早先的研究发现,发育早期的视神经内主要以星形胶质细胞为主,而出生后则很快就以少突胶质细胞为主。因此,我们不禁要问,不同发育阶段大鼠视神经内的这种变化与它们对横断视神经的作用关系究竟说明了什么呢?
3.4.1 星形胶质细胞与轴突的再生 Smith等(1990)认为,在星形胶质细胞的分化过程中可产生能刺激轴突生长的物质,其中包括中枢神经系统很少的细胞外基质蛋白及硷性成纤维细胞生长因子等。发育愈成熟的视神经其刺激轴突再生的能力愈弱,这与视神经在由幼年到成年的过程中星形胶质细胞内存在的这些刺激物质逐渐减少有关。正是由于发育视神经的这种变化,才导致了其刺激轴突再生能力的变化[6],本实验结果似乎可以说明这一点。我们有研究显示(资料待发表),成熟的视神经中星形胶质细胞的数量非常少,而大鼠横断的视神经处可出现增生的星形胶质细胞,它是组成胶质瘢痕的重要成分[7]。在离体研究中,我们也看到了星形胶质细胞对轴突生长的机械性阻挡作用。然而在本实验中,胎鼠视神经移植后20天,虽在两断端间形成了瘢痕组织,但其中仍可见大量新生的轴突通过,并在其靶区出现了阳性标记的神经元,这些事实均说明,胶质瘢痕对轴突生长的阻挡作用也不是绝对的。
3.4.2 少突胶质细胞与轴突的再生 本研究结果显示,随着视神经的发育成熟,其中的少突胶质细胞也在不断的分化成熟,它能明显地抑制轴突的生长。因此,视神经内成熟少突胶质细胞数量的增加势必加重对轴突生长的抑制作用。在本实验中,横断视神经不见明显的轴突再生,而且移植较成熟的视神经时,其促轴突再生能力较胚胎期视神经也显著减弱,从另一个角度也说明少突胶质细胞参与了抑制神经纤维的再生延长。现在有关少突胶质细胞抑制中枢神经系统轴突的生长及再生已得到了越来越多的神经科学工作者的承认,对于其抑制轴突再生的特性人们也正在寻找对策,希望能最大限度地促进中枢神经轴突的再生。有研究显示,直接应用少突胶质细胞毒性物质可促进损伤中枢神经系统轴突的再生并重建功能[8]。
少突胶质细胞抑制轴突的生长依赖于少突胶质细胞所产生的轴突生长抑制因子,它们包括鞘相关轴突生长抑制物NI-35/250(neurite growth inhibitor)、少突胶质细胞髓鞘糖蛋白OMgp(oligodendrocyte-myelin glycoprotein)和鞘相关糖蛋白MAG(myelin-associated glycoprotein)[9],通过敲除编码这些物质的基因,损伤的小鼠脊髓出现了轴突再生及功能重建。
4 结论
本研究结果显示,在大鼠中枢神经系统成熟少突胶质细胞的膜上可能存在着抑制神经元突起生长的物质,这些物质可抑制损伤中枢神经系统神经纤维的再生延长及功能重建。
[1] EHausmann B, Sievers J, Hermanns J,etal. Regeneration of axons from the adult rat optic nerve influence of fetal brain grafts laminin and artificial basement membrane[J]. J Comp Neurol, 1989, 281:447-466.
[2] Butt AM,Kirvell S. Glial cells in transected optic nerves of immature rats Ⅱ An immunohistochemical study[J]. Journal of Neurocytology, 1996, 25:381-392.
[3] Lazarov-Spiegler O, Solomon AS, Schwartz M. Peripheral nerve-stimulated macrophages simulate a peripheral nerve-like regenerative response in rat transected optic nerve[J]. Glia, 1998,24(3):329-337.
[4] Keirstead HS, Hughes HC, Blakemore WF. A quantifiable model of axonal regeneration in the demyelinated adult rat spinal cord[J]. Exp Neurol, 1998,151(2):303-313.
[5] Li Y, Field PM, Raisman G. Repair of adult rat corticospinal tract by transplants of olfactory ensheathing cells[J]. Science, 1997, 277:2000-2002.
[6] Hasan SJ, Keirstead HS, Muir GD,etal. Axonal regeneration contributes to repair of injured brainstem-spinal neurons in embryonic chick[J]. J Neurosci, 1993, 13:492-507.
[7] Frisen J, Egerotrand AH, Risling M. Spinal axons in central nervoussystem scar tissue are closed related to laminin-immunore active astrocytes[J]. Neuroscience, 1995, 65:293-304.
[8] Cohen A, Sivron T, Duvdevani R,etal. Oligodendrocyte cytotoxic factor associated with fish optic nerve regeneration: implication for mammalian CNS regeneration[J]. Brain Res, 1990, 537:24-32.
[9] Benxiu JI, Lauren CC, Kai LIU,etal. Assessment of functional recovery and axonal sprouting in oligodendrocyte-myelin glycoprotein(OMgp) null mice after spinal cord injury[J]. Mol Cell Neurosci, 2008, 39(2):258-267.
Effects of transplanted optic nerve of different ontogenetic stages on regeneration of axons in the optic nerve of adult rat
HE Jiaquan1,YANG Zhong2,CAI Wenqin2
(1.DepartmentofNeurosurgery,NanchongCentralHospital,Nanchong637000,Sichuan;2.DepartmentofHistologyandEmbryology,TheThirdMilitaryMedicalUniversity,Chongqing400037,China)
Objective To explore the effects of transplanted optic nerve of different ontogenetic stages on the regeneration of axons in the optic nerve of adult rat. Methods The implants of optic nerve in different ontogenetic stages were transplanted into the gap of transected optic nerve of adult rat, while the sciatic nerve as a control; HE staining, silver staining and nerve tracing were used to detect the axon regeneration of optic nerve in adult rats. Results The same as the sciatic nerve implants, a lot of axons got through the gap of transected optic nerve of adult rat 20 days later in the group that the optic nerve implants of embryonic day 18 rat were grafted, and the HRP nerve tracing demonstrated that the tracer got to the colliculus superior which is the target of optic nerve, but such a situation was never observed in the implantations of other ontogenetic stage of optic nerve graft, the younger the grafts, the more the neurite of optic nerve stump of the adult rat and the longer that extended . Conclusion Some neurite growth inhibitors must attach to oligodendrocyte from the CNS of rat, they can inhibit the neurite regeneration and functional reestablishment of injured CNS nerve fibers.
Optic nerve; Transplantation; Central nervous system; Regeneration
全军九五重点攻关课题(96M090)
R-33
A
10.3969/j.issn.1672-3511.2015.06.002
2014-07-24; 编辑: 母存培)
通迅作者:蔡文琴,Tel:65318230

